不同品种淫羊藿黄酮类有效成分的主成分分析及对肾阳虚大鼠保护作用的研究
2021-03-08尹程程陈昊媛李佳奇赵大庆睢博文
杨 洋,尹程程,陈昊媛,李佳奇,赵大庆,睢博文,齐 滨*
1长春中医药大学吉林省人参科学研究院;2长春中医药大学药学院,长春 130117
淫羊藿为小檗科植物巫山淫羊藿EpimediumwushanenseT.S.Ying、箭叶淫羊藿Epimediumsagittatum(Sieb.et Zucc.)Maxim.、柔毛淫羊藿EpimediumpubescensMaxim.或朝鲜淫羊藿EpimediumkoreanumNakai的干燥叶,4个种收载在2015版《中华人民共和国药典》[1]。本药始载于《神农本草经》,列为上品,别名诸多,《本经》中称刚前,《雷公炮炙论》中称仙灵脾,《日华子本草》中称放杖草、弃杖草、千两金、干鸡筋、黄连祖。《别录》、《药性论》、《蜀本草》以及《滇南本草》皆有记载,其性味辛、甘、温,归肝、肾二经,具有补肾阳、强筋骨、祛风湿的功效[2-7]。现代药理学研究表明,淫羊藿能兴奋性机能,提高人体免疫力,调节心脏供血供氧平衡,改善心脑缺血缺氧,促进造血功能,防治骨质疏松,亦有抗衰老、抗病毒、抗肿瘤、抗抑郁、抗炎等作用[8]。淫羊藿的化学成分包括黄酮、木脂素、苯酚苷、生物碱、多糖、挥发油、微量元素、有色原酮、菲、蒽醌、鞣质、倍半萜、甾醇等[9],其中,黄酮类成分如淫羊藿苷、朝藿定A、朝藿定B、朝藿定C为其主要活性成分[10]。主成分分析法是常用的对样本信息进行综合评价的方法之一,在中药领域的应用弥补了中药质量优劣评价中各指标权重的不确定性及某些指标间存在的相关性带来的不便,进一步完善了中药质量评价方法[11]。本研究采用采用高效液相色谱法,对其黄酮类主要有效成分淫羊藿苷、朝藿定A、朝藿定B、朝藿定C进行了含量测定,并结合主成分分析对淫羊藿进行了综合性评价,近期查阅文献得知,淫羊藿主要集中在免疫调节、抗炎、抗衰老、抗肿瘤等活性的研究,关于淫羊藿的补肾阳作用研究甚少,所以我们对其补肾阳的作用进行初步的探究。为淫羊藿的临床应用提供科学的理论依据和医用基础。
1 材料
1.1 样品采集
选择4个品种的淫羊藿,每个品种各3批,12个不同来源淫羊藿药材均来自各个主产区,经长春中医药大学药学院肖井雷副教授鉴定均为为小檗科植物巫山淫羊藿EpimediumwushanenseT.S.Ying、箭叶淫羊藿E.sagittatum(Sieb.et Zucc.) Maxim.、柔毛淫羊藿E.pubescensMaxim.和朝鲜淫羊藿E.koreanumNakai的干燥叶。样品来源见表1。

表1 淫羊藿药材样品来源情况Table 1 Source of Herba Epimedii samples
1.2 药品与试剂
淫羊藿苷、朝藿定A、朝藿定B、朝藿定C(南京森贝伽生物科技有限公司);氢化可的松注射液(河南润弘制药股份有限公司);乙腈、超纯水、无水乙醇、二甲苯、乙酸、生理盐水(北京化工厂);水合氯醛(北京酷来搏科技有限公司);HE染色试剂盒(南京建成生物科技有限公司);尿酸(UA)试剂盒(酶比色法)、尿素氮(BUN)ELISA试剂盒、肌酐(Cr)ELISA试剂盒(江苏菲亚生物科技有限公司);金匮肾气丸(北京同仁堂制药厂);石蜡(52~54 ℃,上海华永石蜡有限公司)。
1.3 动物
SPF级雄性SD大鼠,体重180~220 g,由依思实验动物科技公司提供.将动物实验室温度控制在24±2 ℃,湿度控制在55%±5%,光照时间为6∶30~18∶00。适应性喂养3天,进食普通饲料,自由饮水。
1.4 仪器
紫外可见分光光度计(UV-2550型,日本岛津公司);高效液相色谱仪(LC-1100 型,安捷伦公司);安捷伦ZORBAX SB-Aq C18色谱柱(4.6 mm×250 mm,5μm,安捷伦公司);粉碎机(AK-400A,温岭市奥力中药机械有限公司);分析天平(梅特勒MS204S型,瑞士梅特勒-托利多公司);注射器(20180918,江苏治宇医疗器械有限公司);灌胃器(20170923,江苏治宇医疗器械有限公司);全自动生化分析仪(CX4,美国贝克曼公司);移液枪(OH37709,Thermo仪器公司);自动包埋机(EG1150H型,德国LEICA);手摇切片机(RM2235型,德国LEICA);烘片机(HI1220型,德国LEICA);铺片机(HI1210型,HI1210型);体视显微镜(SMZ25,尼康仪器有限公司)。
2 方法
2.1 4 种活性成分含量测定
2.1.1 色谱条件
色谱柱:安捷伦 ZORBAX SB-Aq C18色谱柱(4.6 mm× 250 mm,5 μm);以乙腈为流动相A,以水为流动相B;流速:1 mL/min;柱温:35 ℃;270 nm检测波长;理论板数按淫羊藿苷峰计算应不低于1 500。

表2 流动相梯度洗脱表Table 2 Mobile phase gradient elution table
2.1.2 对照品溶液的制备
取淫羊藿苷、朝藿定A、朝藿定B、朝藿定C对照品适量,精密称定,加甲醇分别制成每1 mL各含0.1 mg的溶液,即得。
2.1.3 供试品溶液的制备
供试品溶液的制备 取本品粉末(过三号筛)约0.2 g,精密称定,置具塞锥形瓶中,精密加入50%乙醇20 mL,称定重量,超声处理(功率200 W,频率40 kHz)1 h,放冷,再称定重量,用50%乙醇补足减失的重量,摇匀,滤过,取续滤液,即得。
2.1.4 精密度试验
分别精密吸取“2.1.2”项下混合对照品储备液各10 μL,连续进样6次,计算峰面积,得出RSD值。
2.1.5 稳定性试验
精密吸取按“2.1.2”项下混合对照品储备液各10 μL,分别于0、2、4、8、12、24 h进样测定,计算峰面积,得出RSD值。
2.1.6 重复性试验
精密称取淫羊藿6份,按“2.1.3”项下方法制备供试品溶液,按“2.1.1”项下色谱条件测定,计算峰面积,得出RSD值。
2.1.7 线性关系考察
精密吸取“2.1.2”项下混合对照品溶液0.2、0.4、0.8、1.2、1.6、2.0、2.4 mL,分别置5 mL量瓶中,甲醇定容至刻度,摇匀,制成系列浓度对照品溶液。分别吸取上述七份对照品溶液各10 μL,按“2.1.1”项下色谱条件检测。以各对照品溶液的浓度(X)为横坐标,以峰面积(Y)为纵坐标绘制标准曲线。
2.1.8 加样回收率实验
取淫羊藿药材粉末(S1)6份,精密称定每份0.25 g,定量加入淫羊藿苷、朝藿定A、朝藿定B、朝藿定C对照品适量,按“2.1.3”项制备供试品溶液并进样分析,记录各化学成分峰面积并计算含量,按“2.1.1”项下方法进样检测。
2.2 样品含量测定
取“2.1.2”项下混合对照品溶液和“2.1.3”项下供试品溶液各10 μL,按“2.1.1”项下色谱条件进样分析。计算出各样品中淫羊藿苷、朝藿定A、朝藿定B、朝藿定C的含量。
2.3 主成分分析
主成分分析法是常用的对样本信息进行综合评价的方法之一,在中药领域的应用弥补了中药质量优劣评价中各指标权重的不确定性及某些指标间存在的相关性带来的不便,进一步完善了中药质量评价方法[11]。通过IBM SPSS 21.0统计软件,对12淫羊藿进行降维和因子分析,计算成分特征值、贡献率及特征向量。
2.4 肾阳虚大鼠保护作用
2.4.1 造模、分组与给药
取SD雄性大鼠40只,将34只大鼠每日腹腔注射氢化可的松注射液,给药剂量为100 mg/kg;剩余6只大鼠作为正常对照组,注射等体积生理盐水,连续四周。四周后挑选30只造模成功的大鼠随机分为阳虚模型对照组(模型组)、金匮肾气丸干预组(阳性组)、淫羊藿水提物低剂量组(YYH-LG组)、淫羊藿水提物中剂量组(YYH-MG组)和淫羊藿水提物高剂量组(YYH-HG组)。干预组给药量按照人鼠等效剂量折算。阳性组给予金匮肾气丸水溶液灌胃;淫羊藿干预组给予淫羊藿提取物浓缩液灌胃;模型组与空白对照组灌胃等体积蒸馏水。灌胃体积均为10 mL/kg,连续灌胃四周。
2.4.2 取材
连续给药30天,最后一天给药后24 h内禁食不禁水,采用水合氯醛麻醉,腹主动脉取血,以3 000 rpm速率离心10 min,取上层血清,分装,冻存于-20 ℃备用。取大鼠肾脏,置于20倍体积4%多聚甲醛中固定24 h,备用。
2.4.3 生化指标检测
采用全自动生化分析仪检测尿酸(UA)、肌酐(CRE)和尿素氮(BUN)的含量。
2.4.4 HE染色
按照HE染色试剂盒说明对组织切片进行染色。
2.4.5 数据分析
脏器指数计算公式:
脏器指数=(脏器质量/体重)×100%
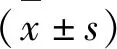
3 实验结果
3.1 4种有效成分含量测定结果
3.1.1 方法学考察
方法学考察结果见表3,结果表明,该方法精密度、重复性、稳定性良好,符合含量测定要求。

表3 方法学考察结果(n=6)Table 3 Methodology (n=6)
3.1.2 线性考察结果
线性考察结果见表4。结果表明淫羊藿苷、朝藿定A、朝藿定B、朝藿定C,R2>0.999,线性关系良好,符合含量测定要求。
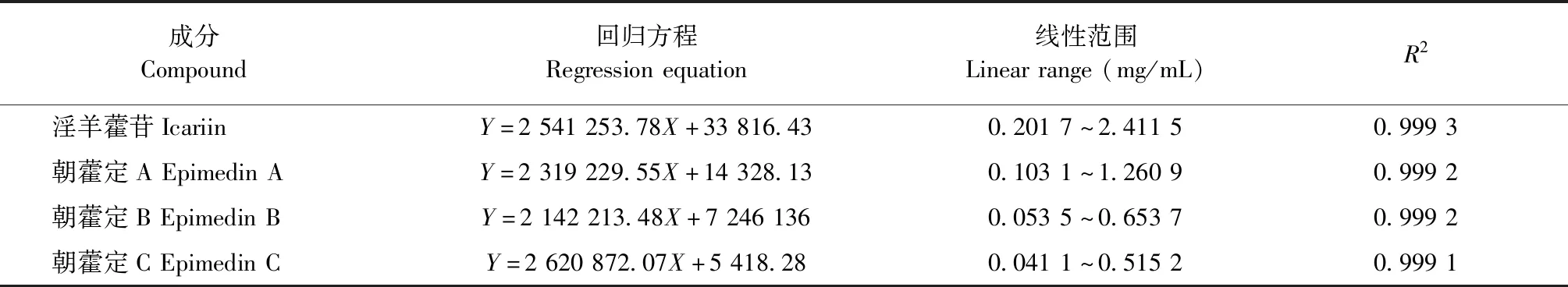
表4 4种指标性成分线性范围Table 4 Linear relationships of four constituents
3.1.3 加样回收率结果
加样回收率实验结果如表5所示,加样回收率
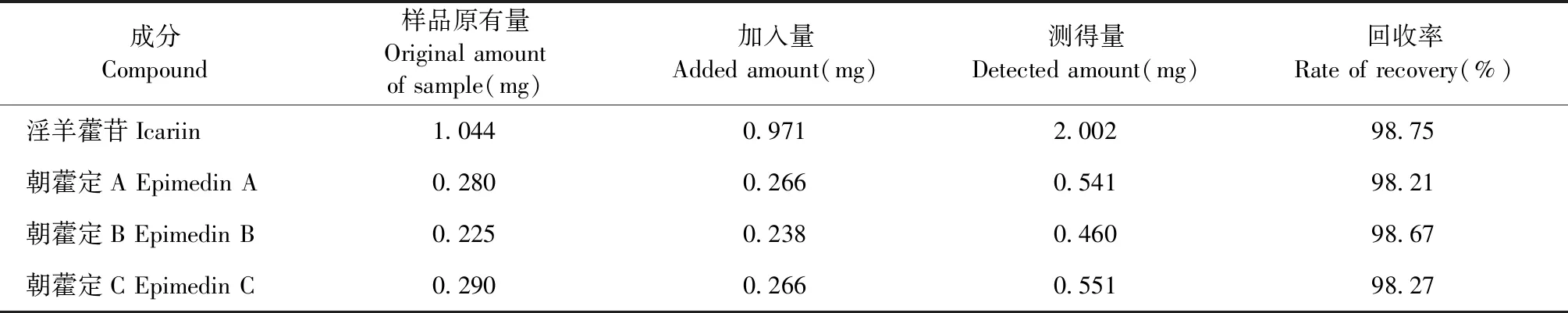
表5 加样回收率试验结果(n=6)Table 5 Results of recovery test(n=6)
均高于98%,加样回收试验结果良好。
3.1.4 淫羊藿苷、朝藿定A、朝藿定B、朝藿定C含量测定结果
对12批淫羊藿淫羊藿苷、朝藿定A、朝藿定B、朝藿定C进行含量测定,测定结果如表6。
表6 不同批次淫羊藿淫羊藿苷、朝藿定A、朝藿定B、朝藿定C含量测定结果Table 6 The quantification of icariin,epimedin A,epimedin B and epimedin C in different samples
3.2 主成分分析结果
应用SPSS 21.0 统计分析软件对含量测定结果进行分析,方差贡献率结果见表7,主成分计算结果见表8。
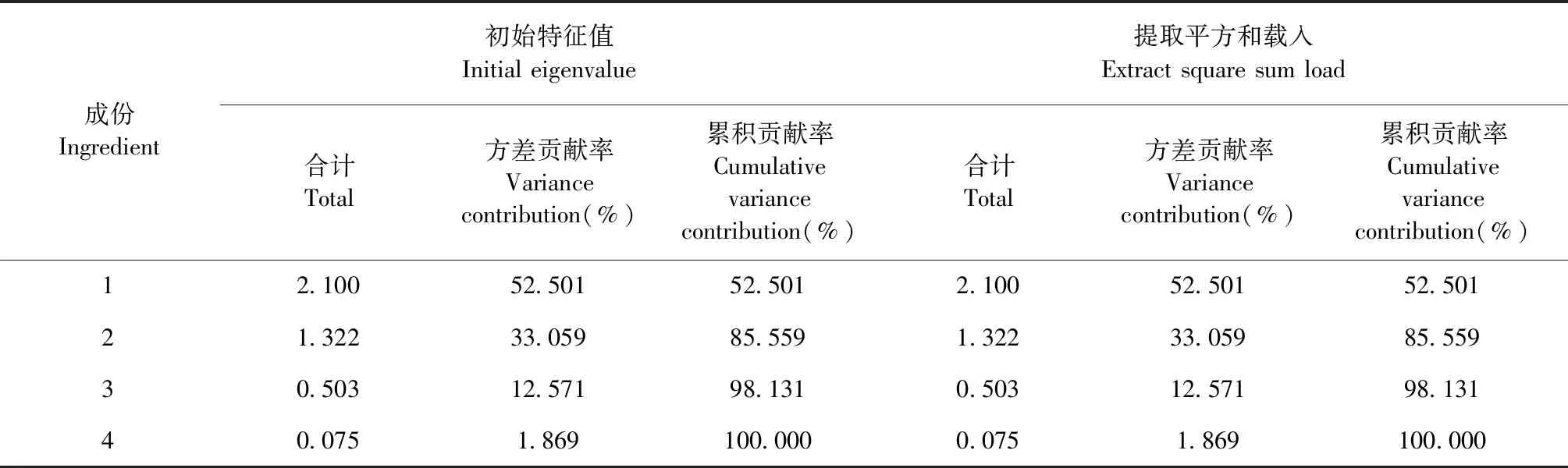
表7 主成分的方差值和贡献率Table 7 Characteristic value and variance contribution rate of principle components
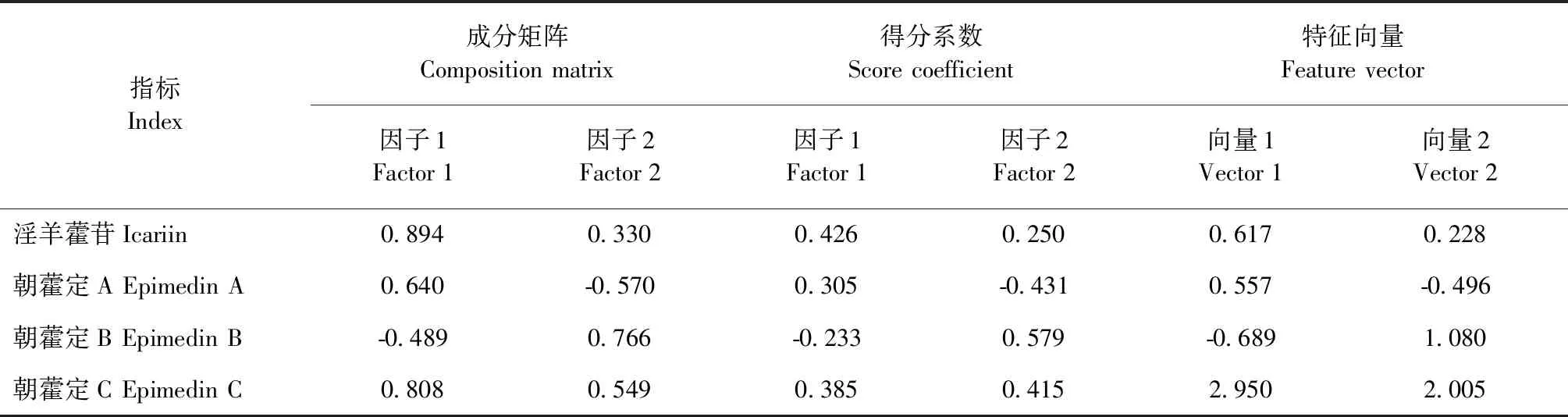
表8 主成分分析结果Table 8 Principal component analysis (PCA)
如表7所示,提取特征值大于1的成分,可提取两个主成分。第一主成分特征值为2.100,方差贡献率是52.501%;第二主成分特征值为1.322,方差贡献率是33.059%;根据特征向量矩阵,建立主成分分析模型。
F=52.501%F1+33.059%F2
F1=0.617X1+0.442X2-0.337X3+0.558X4
F2=0.287X1-0.496X2+0.666X3+0.477X4
X1、X2、X3、X4分别为淫羊藿苷、朝藿定A、朝藿定B、朝藿定C原始变量标准化后的变量。F1、F2为主成分1和主成分2得分。以主成分贡献率对主成分得分进行加权平均,得综合评分F。结果见表9,如表9所示,选择得分较高的柔毛淫羊藿,进行肾阳虚保护作用试验。
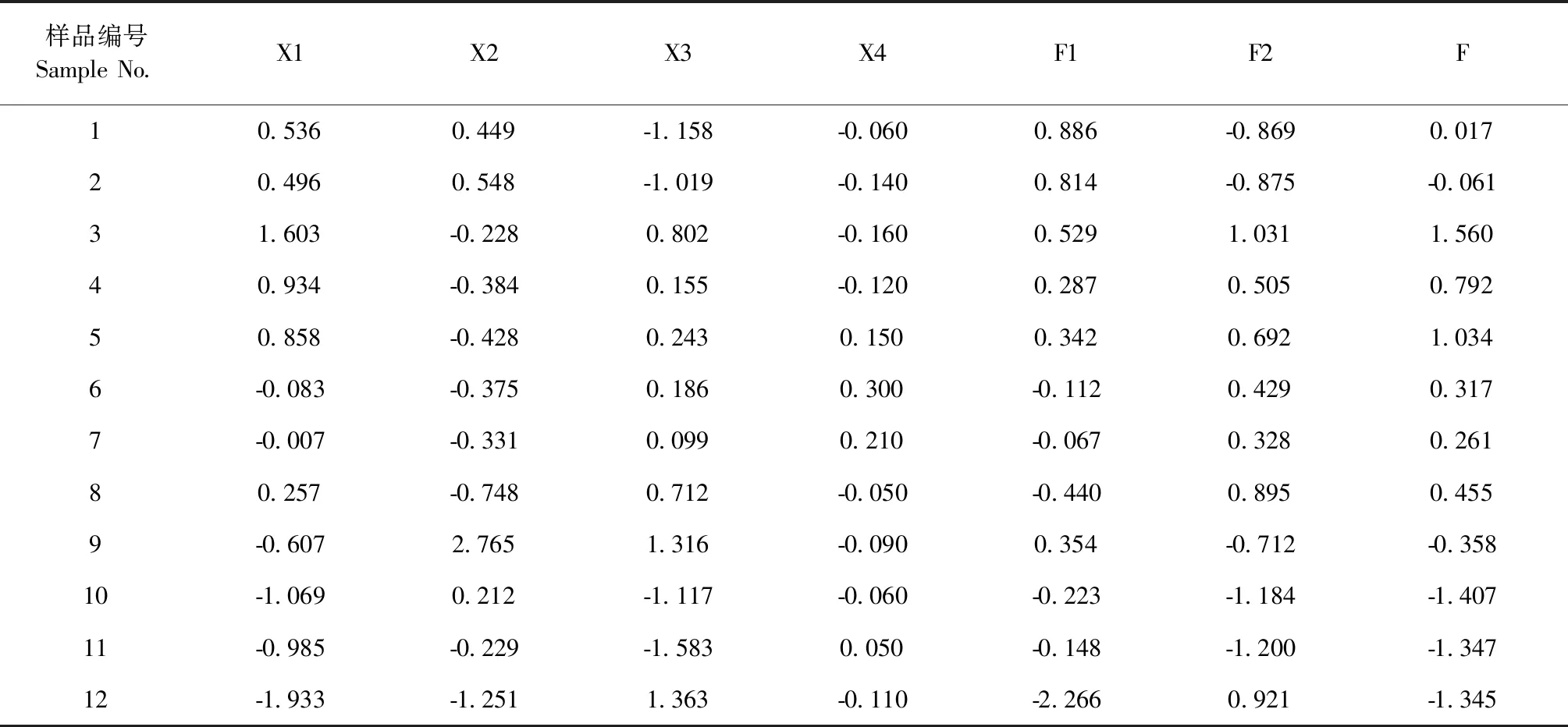
表9 12批淫羊藿药材样品得分Table 9 Score of 12 batches of Epimedium medicinal herbs samples
3.3 药理实验结果
3.3.1 全身一般情况
造模的大鼠逐渐出现活动减少、精神萎靡、背部弓起、皮毛枯燥、饮水增多等现象,随着腹腔注射天数的延长,大鼠体重逐渐下降,并伴随畏寒、毛色灰暗、背部蜷缩等现象。空白对照组大鼠均未见异常情况。经灌胃给予不同剂量淫羊藿提取物与金匮肾气丸干预后,四组大鼠活动有所增加,以上症状也均有所改善。模型组大鼠体重略有回升,但状态无明显改善。
3.3.2 脏器指数变化
肾脏指数:如表10所示,与空白组相比,模型组肾脏指数显著升高(P<0.05);经金匮肾气丸与淫羊藿提取物灌胃干预后,与模型组相比,干预组肾脏指数显著降低(P<0.01);YYH-LG组肾脏指数较低,YYH-MG组和YYH-HG组肾脏指数基本一致(P>0.05)。
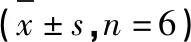
表10 肾脏指数
3.3.3 肾功能
尿酸(UA):如表11所示,与空白组相比,模型组UA显著降低(P<0.05);干预后,干预组UA含量均有上升趋势,但与模型组无显著差异(P>0.05);YYH-LG组UA含量相对较高,YYH-MG组和YYH-HG组UA含量基本一致,无显著差异(P>0.05)。
肌酐(CRE):如表11所示,与空白组相比,模型组CRE显著升高(P<0.05);干预后,干预组CRE含量均有下降趋势,与模型组相比均有显著差异(P<0.01);与YYH-MG组和YYH-HG组相比,YYH-LG组CRE下降效果较好,且与YYH-MG组有显著差异(P<0.05)。
尿素氮(BUN):如表11所示,与空白组相比,模型组BUN显著升高(P<0.05);干预后,干预组BUN含量均有下降趋势,与模型组相比均有显著差异(P<0.01);与YYH-HG组相比,组和YYH-HG组相比,YYH-LG组CRE下降效果较好,且与YYH-MG组BUN含量下降趋势明显,具有显著差异(P<0.001);与组和YYH-HG组相比,YYH-LG组CRE下降效果较好,且与YYH-MG组相比,YYH-LG组和YYH-HG组BUN含量下降趋势明显,具有显著差异(P<0.05)。
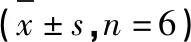
表11 UA、CRE、BUN含量变化Table 11 UA,CRE,BUN content changes
3.3.4 组织镜检
3.3.4.1 肾脏组织病理变化
如图1A、B所示,空白组大鼠肾脏组织髓质和皮质分界清晰,肾小管基底膜未见增厚,肾小球和肾间质未见异常。如图1C、D所示,模型组大鼠肾脏组织中肾小管管腔增大,基底膜增厚,肾小管数目减少;肾小球数目减少,肾小球萎缩,肾小囊腔扩大;肾间质纤维化严重。如图1E~L所示,干预后,与模型组相比,阳性组、YYH-LG组、YYH-MG组和YYH-HG组大鼠肾脏组织中均见肾小管基底膜增厚减轻,肾小管管腔缩小,肾小球萎缩减轻,肾小囊腔基本无扩大迹象,肾间质纤维化减轻。对比干预组肾脏组织,阳性组和YYH-HG组肾脏中肾小球恢复效果较好,数目增加,系膜细胞分布均匀,肾间质纤维化较轻。
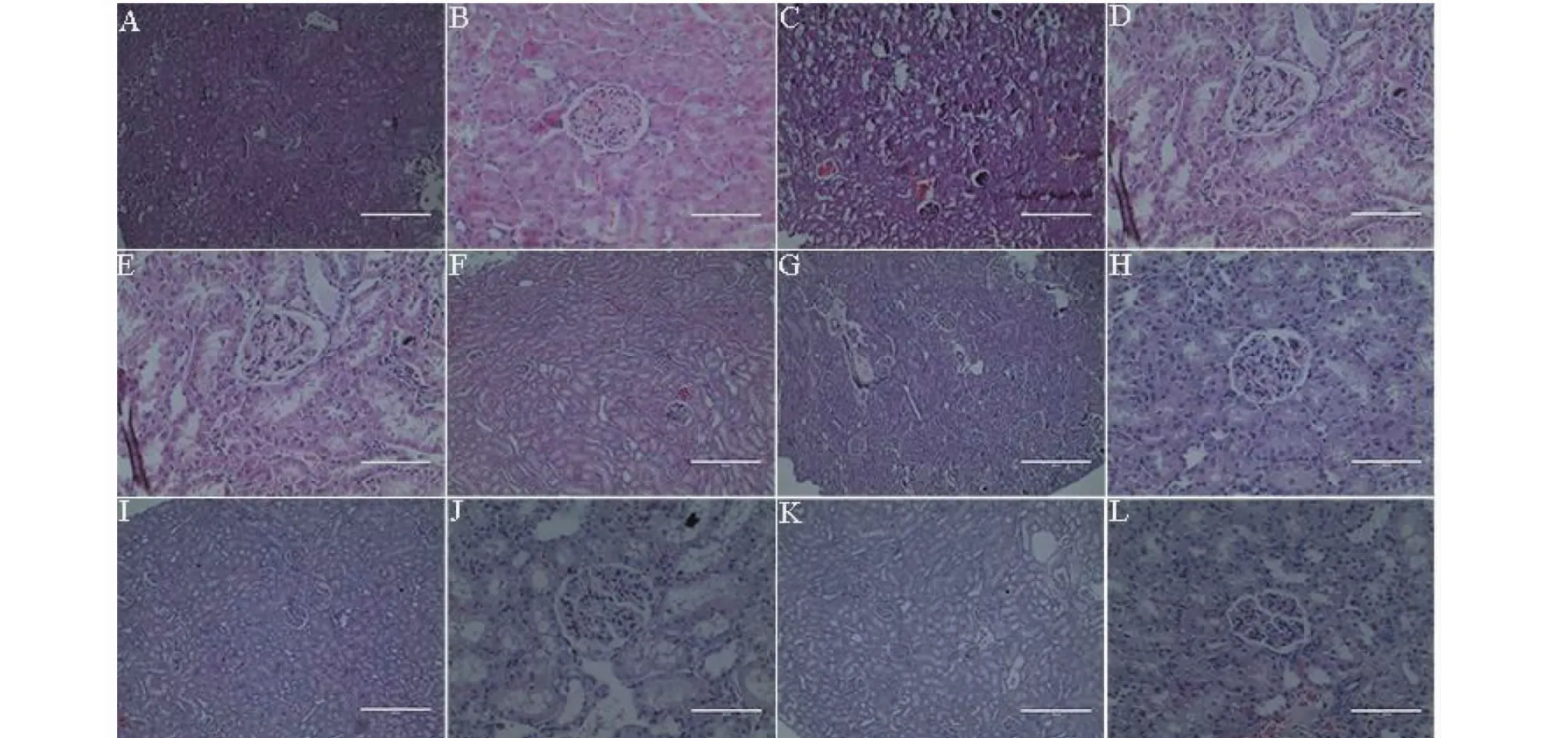
图1 柔毛淫羊藿对肾阳虚大鼠肾组织形态结构的影响Fig.1 Effects of E.pubescens on the morphological structure of kidney tissue in rats with kidney-yang deficiency注:A:空白组(×10);B:空白组(×40);C:模型组(×10);D:模型组(×40);E:阳性组(×10);F:阳性组(×40);G:YYH-LG组(×10);H:YYH-LG组(×40);I:YYH-MG组(×10);J:YYH-MG组(×40);K:YYH-HG组(×10);L:YYH-HG组(×40)Note:A:Control group (×10);B:Control group (×40);C:Model group (×10);D:Model group (×40);E:Positive group (×10);F:Positive group (×40);G:YYH-LG group (×10);H:YYH-LG group (×40);I:YYH-MG group (×10);J:YYH-MG group (×40);K:YYH-HG group (×10);L:YYH-HG group (×40).
4 讨论与结论
本研究主成分分析结果显示,将四个成分提取出两个主成分,第一主成分淫羊藿苷、朝藿定C,第二主成分为朝藿定B。利用贡献率对主成分进行加权平均,比较12批淫羊藿药材得分,发现其中有5批样品得分较低,提示12批样品质量存在差异。本研究选择得分较高的柔毛淫羊藿进行接下来的肾阳虚保护作用研究。
在临床上,肾功能损伤时,UA、CRE和BUN含量会改变[13-16]。在本研究中,以氢化可的松诱导形成的大鼠肾阳虚为实验对象,以UA、CRE和BUN为检测指标。结果显示,YYH-LG组、YYH-MG组和YYH-HG组均可以减少UA、CRE和BUN的含量。总体而言,YYH-LG组对各指标、肾脏损伤改善效果较好。因此,淫羊藿作为药品在治疗肾阳虚中具有重要意义。
