定量蛋白质组学筛选及分析山慈菇酯提物抗4T1乳腺癌的新启示
2021-03-08曹晓东杨冬冬张子英
曹晓东,张 楠,杨冬冬,刘 颖,王 赫,张子英*
1内蒙古医科大学新药安全评价研究中心;2内蒙古医科大学公共卫生学院;3内蒙古医科大学基础医学院,呼和浩特 010110;4扎兰屯职业学院,呼伦贝尔 162650
乳腺癌是女性最常见的恶性肿瘤之一,是全球第2大高发癌,死亡率在全球排第5[1]。世界范围内乳腺癌的发病率和死亡率分别占12.2%和9.6%,呈快速增长的趋势,且发病趋于年轻化,给广大女性造成了严重困扰[2]。三阴性乳腺癌(hriple-negative breast cancer,TNBC)在诊断初期就合并远处器官转移,患者的存活率仅为23%,化学治疗TNBC虽有一定的疗效,但并未延长患者的总生存期和无进展生存期。
国医大师周仲瑛教授系我国著名中医药专家,1 374诊次恶性肿瘤病案中共用药物453味,其中使用频次最高的为山慈菇,1 062次,占77.29%[3]。山慈菇为中、蒙、苗医临床常用抗癌药,蒙医常用抗癌方剂益气托毒中药汤剂、蒙药乌门-17味散中均含有山慈菇。山慈菇能明显抑制人源TNBC类细胞MDA-MB-231和ER+的T-47D细胞的增殖和转移[4,5]。4T1属于鼠源的TNBC,本课题组特在相对具有免疫功能BALB/c小鼠上复制了4T1乳腺癌模型,应用TMT标记定量蛋白质组学筛选及分析Cr Ap相关的抗乳腺癌机制。
1 材料与方法
1.1 材料
1.1.1 试剂
4T1乳腺癌细胞株(中国科学院细胞库);DMEM培养基(Gibco公司);0.25% Trypsin-EDTA(Gibco公司);FBS(ExCell Bio公司);Penicillin-Streptomycin双抗(ExCell Bio公司);DMSO(北京索莱宝科技有限公司);Trizol试剂盒(Generay公司);Prime Script@ RTMaster Mix反转录试剂盒(Vazyme公司);FastStart Universal SYBR Green Master (Rox)(Roche公司);BCA试剂盒(碧云天公司);TMT标记试剂盒(Thermo公司);三乙基碳酸氢铵(TEAB)(Sigma公司);DMEM培养基(Gibco公司);0.25% Trypsin-EDTA(Gibco公司);FBS(批号:11G313,ExCell Bio公司);DMSO(北京索莱宝科技有限公司);三氟乙酸(Sigma-Aldrich公司);乙腈(Fisher Chemical公司);二硫苏糖醇(Sigma公司);尿素(Sigma公司);甲酸(Fluka公司);碘代乙酰胺(Sigma公司);胰酶(Promega公司)。
1.1.2 动物
BALB/c小鼠(许可证号:SCXK(京)2016-0002),雌性,6~8周龄,体质量18±2 g,购自北京斯贝福生物技术有限公司。饲养于内蒙古医科大学动物实验中心,SPF级鼠房,饲养温度18~22 ℃,所有操作均符合伦理学要求。
2 方法与步骤
2.1 筛选Cr Ap抗4T1乳腺癌的作用
2.1.1 细胞生长曲线
细胞培养至细胞覆盖率达培养瓶的80%左右,加入0.25%胰酶消化。调整细胞密度至1×104/mL,接种于24孔板中,每孔1 mL,24 h后开始计数,以后每隔24 h计数一次,计数结果取四孔平均值,连续计数6天,绘制细胞生长曲线。
2.1.2 MTT法检测不同浓度的Cr Ap在不同时间对4T1乳腺癌细胞的抑制作用
4T1乳腺癌细胞用0.25%胰酶消化,加入培养基制成单细胞悬液,以每孔1×104接种于96孔板上,每孔100 μL,96孔板上设置空白对照组(含细胞的培养基)、不同浓度的Cr Ap给药组(12 500、1 250、125、12.5、1.25、0.125 μg/mL),每组设5个复孔。置入37 ℃、5% CO2培养箱中培养24~48 h,细胞贴壁后,吸除原培养液,实验组分别加入100 μL用培养基调整后的不同浓度的Cr Ap。同时使用3块96孔板进行上述步骤,放入37 ℃,5%CO2的恒温细胞培养箱中,分别培养24、48、72 h。加入5 mg/mL MTT溶液10 μL,避光,孵育4 h,小心地吸出每个孔内所有液体,加入150 μL DMSO,继续避光,将96孔板放到振荡摇床上低速震荡10 min,上机检测,在OD490 nm测量各孔的吸光值,抑制率=(对照组OD值-药物组OD值)/对照组OD值×100%,进行计算。
2.2 动物分组和造模
所有BALB/c小鼠适应性喂养7天后,进行植瘤,接种4T1前用1%戊巴比妥钠生理盐水溶液进行麻醉,腹腔注射,10 μL/g。消毒后,右腋皮下注射5×106个4T1细胞200 μL。5~7天后,小鼠肿瘤长到2~5 mm后,触摸植瘤处可发现不规则硬块,即代表植瘤成功。
2.2.1 动物分组
植瘤成功的BALB/c小鼠,分层分组法随机分成:模型组、Cr Ap高、中、低剂量组,每组8只。根据临床常用原药量换算,结合前期动物实验结果,给药浓度分别为960、96、9.6 mg/kg,每日一次,连续腹腔注射给药21天;模型组小鼠腹腔注射等量的生理盐水。
2.2.2 TMT定量蛋白质组学
2.2.2.1 蛋白提取
从-80 ℃取出6对样品,将适量的瘤组织样品称重,置于液氮预冷的研钵中,添加液氮并充分研磨至粉末。每组样品均加入4倍体积含8 mol/L尿素,1%蛋白酶抑制剂的裂解缓冲液中,超声裂解后置高速离心机中,4 ℃,12 000 g离心10 min,小心将上清液转移至新的离心管中,弃掉离心管底部细胞碎片,BCA试剂盒测定蛋白浓度。
2.2.2.2 胰酶酶解
将二硫苏糖醇添加到蛋白质溶液中至终浓度为5 mmol/L,并在56 ℃下还原30 min。 然后添加碘乙酰胺,使其浓度为11 mmol/L,并在室温避光孵育15 min。最后,将样品的尿素浓度稀释至2 mol/L以下。以1∶50(胰蛋白酶∶蛋白质)的质量比添加胰蛋白酶,并在37 ℃下消化过夜。称重后继续加入1%的胰酶,继续酶解4 h。
2.2.2.3 TMT标记
胰酶酶解后的肽段过Strata X C18(Phenomenex)色谱柱除盐,真空冷冻干燥。以0.5 mol/L TEAB溶解肽段,根据TMT试剂盒操作说明标记肽段。乙腈溶解并与肽段混合,室温孵育2 h,完成标记后的肽段混合并除盐,真空冷冻干燥待用。
2.2.2.4 HPLC分级
肽段用高pH反向HPLC分级,色谱柱为Agilent 300Extend C18(4.6 mm×250 mm,5 μm)。操作如下:肽段分级梯度为8%~32%乙腈、pH=9,60 min分离60个组分,随后肽段合并为18个组分,最后各组分真空冻干备用。
2.2.2.5 液相色谱-质谱联用分析
设置EASY-nLC 1000超高效液相系统色谱条件,流动相A:0.1%甲酸的水溶液;流动相B:0.1%甲酸的乙腈溶液。液相梯度设置:0~42 min,6%→22%B;42~54 min,22%→30%B;54~57 min,30%→80%B;57~60 min,80%B,流速:500 nL/min。 肽段用流动相A溶解进行分离, 样品首先进入trap柱富集并除盐,随后通过自填装的C18分析柱(柱子内径150 μm,柱料粒径3.6 μm,长度30 cm)进行分离。
通过超高效液相系统分离肽段后,注入NSI离子源进行电离。然后通过Orbitrap Fusion Lumos质谱分析。设置离子源电压为2.4 kV,使用高分辨率Orbitrap对肽前体离子及其二级片段进行检测和分析。一级质谱扫描范围设置为350~1 550m/z,扫描分辨率设置为60 000;二级质谱扫描范围则固定起点为100m/z,二级扫描分辨率设置为15 000。数据采集模式使用数据依赖型扫描程序,即在一级扫描后选择信号强度最高的前20肽段依次进入HCD碰撞池,使用32%的碎裂能量进行碎裂,再依次进行二级质谱分析。为了提高质谱的有效利用率,自动增益控制(AGC)设置为5E4,信号阈值设置为10 000 ions/s,最大注入时间设置为60 ms,串联质谱扫描的动态排除时间设置为30 s以避免重复扫描母离子。
2.2.2.6 数据库搜索
二级质谱数据使用Maxquant(v1.5.2.8)进行检索。检索参数设置:数据库为Mus_musculus_10090_SP_20191115(17 032条序列),添加了反库以计算随机匹配造成的假阳性率,并且在数据库中加入了常见的污染库,用于消除鉴定结果中污染蛋白的影响;酶切方式设置为Trypsin/P;漏切位点数设为2;肽段最小长度设置为7个氨基酸残基;肽段最大修饰数设为5;First search和Main search的一级母离子质量误差容忍度分别设为20 ppm和5 ppm,二级碎片离子的质量误差容忍度为0.02 Da。将半胱氨酸烷基化设置为固定修饰,可变修饰为甲硫氨酸的氧化,蛋白N端的乙酰化,脱酰胺化(NQ)。定量方法设置为TMT-6 plex,蛋白鉴定、PSM鉴定的FDR都设置为1%。
2.2.2.7 质谱质控检测
大部分肽段分布在7~20个氨基酸,符合基于trypsin酶解和HCD碎裂方式的一般规律。其中小于5个氨基酸的肽段由于产生的碎片离子过少,不能产生有效的序列鉴定。大于20个氨基酸的肽段由于质量和电荷数较高,不适合HCD的碎裂方式。质谱鉴定到的肽段长度的分布符合质控要求。
2.2.2.8 生物信息学分析软件
分析质谱数据解析,使用MaxQuant:v.1.5.2.8 http://www.maxquant.org/;分析Motif使用MoMo: V5.0.2 http://meme-suite.org/tools/momo;GO、Domain注释使用Inter ProScan :v.5.14-53.0 http://www.ebi.ac.uk/interpro/;KEGG注释使用KAAS:v.2.0 http://www.genome.jp/kaas-bin/kaas_main,KEGG Mapper:V2.5 http://www.kegg.jp/kegg/ mapper.html;亚细胞定位使用Wolfpsort:v.0.2 http://www.genscript.com/psort/wolf_psort.html,CELLO:v.2.5 http://cello.life.nctu.edu.tw/;富集分析使用Perl module:v.1.31 https://metacpan.org/pod/Text::NSP::Measures::2D::Fisher。
2.2.3 QPCR
釆用 Trizol提取乳腺癌组织总RNA,浓度调一致后,反转录得cDNA。按照说明书去基因组DNA,反应条件:42 ℃ 2 min,配制20 μL反应体系,反应条件为:50 ℃ 15 min,85 ℃ 5 s。用SYBR@PrimeExTaqTW Ⅱ检测癌组织中Ly6G、S100a8、S100a9、Tmsb4x和 GADPH的mRNA表达量,按照试剂盒说明书配制20 μL qPCR反应体系;反应过程采用两步法,即95 ℃ 10 min;95 ℃ 15 s,60 ℃退火1 min,扩增40个循环:每个样品6个重复;用相对表达量=2-ΔΔct公式计算各个基因的相对表达量,基因引物序列见表1。
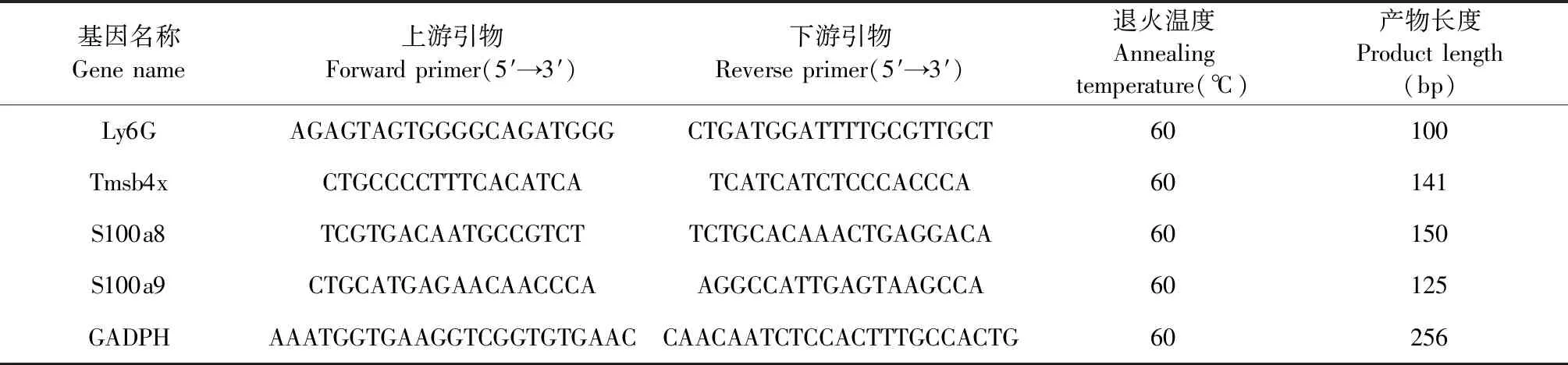
表1 靶基因的引物序列Table 1 Primer sequences of target gene
2.3 统计学方法
在ADM/CON两个样本中以1.5倍变化为差异表达变化阈值,统计学检验采用t-test,P<0.05为显著性阈值。富集检验使用Fisher’s exact test。两个样本中蛋白对应特异性肽段的定量值取log2(以使得数据符合正态分布),然后用双样本双尾T检验方法计算P。当P<0.05时,超过1.5作为显著上调的变化阈值,小于1/1.5作为显著下调的变化阈值。
3 结果
3.1 差异蛋白
图1A显示,由4T1细胞的生长曲线发现,该细胞系在铺板3天内为对数生长期,MTT给药选在对数生长期,可在铺板后的1.5天给予Cr Ap明确其药理作用。图1B显示,Cr Ap在体外有抗4T1乳腺癌的作用;图1C、D显示,造模成功,且Cr Ap能降低体内4T1乳腺癌的大小,选Cr Ap96 mg/kg作为给药样本与模型组进行蛋白质组学检测。
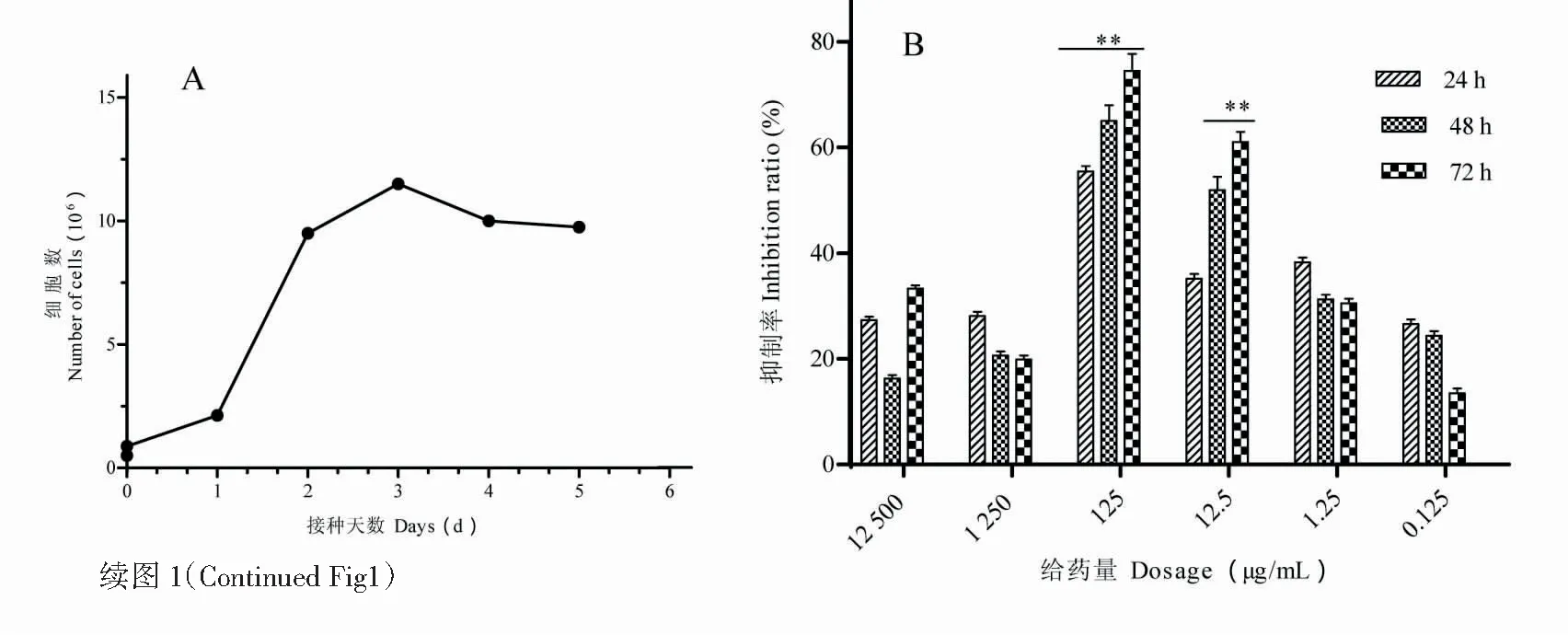
图1 Cr Ap对4T1乳腺癌细胞和荷瘤鼠乳腺癌组织的抑制作用Fig.1 Inhibitory effects of Cr Ap on 4T1 breast cancer cells and breast cancer tissues
Cr Ap/CON利用MaxQuant软件在IPI(International Protein Index)数据库中检索质谱鉴定6 162个可定量蛋白,其中有15个上调的蛋白,下调蛋白仅有胸腺素β-4。具体差异蛋白的变化见表2。
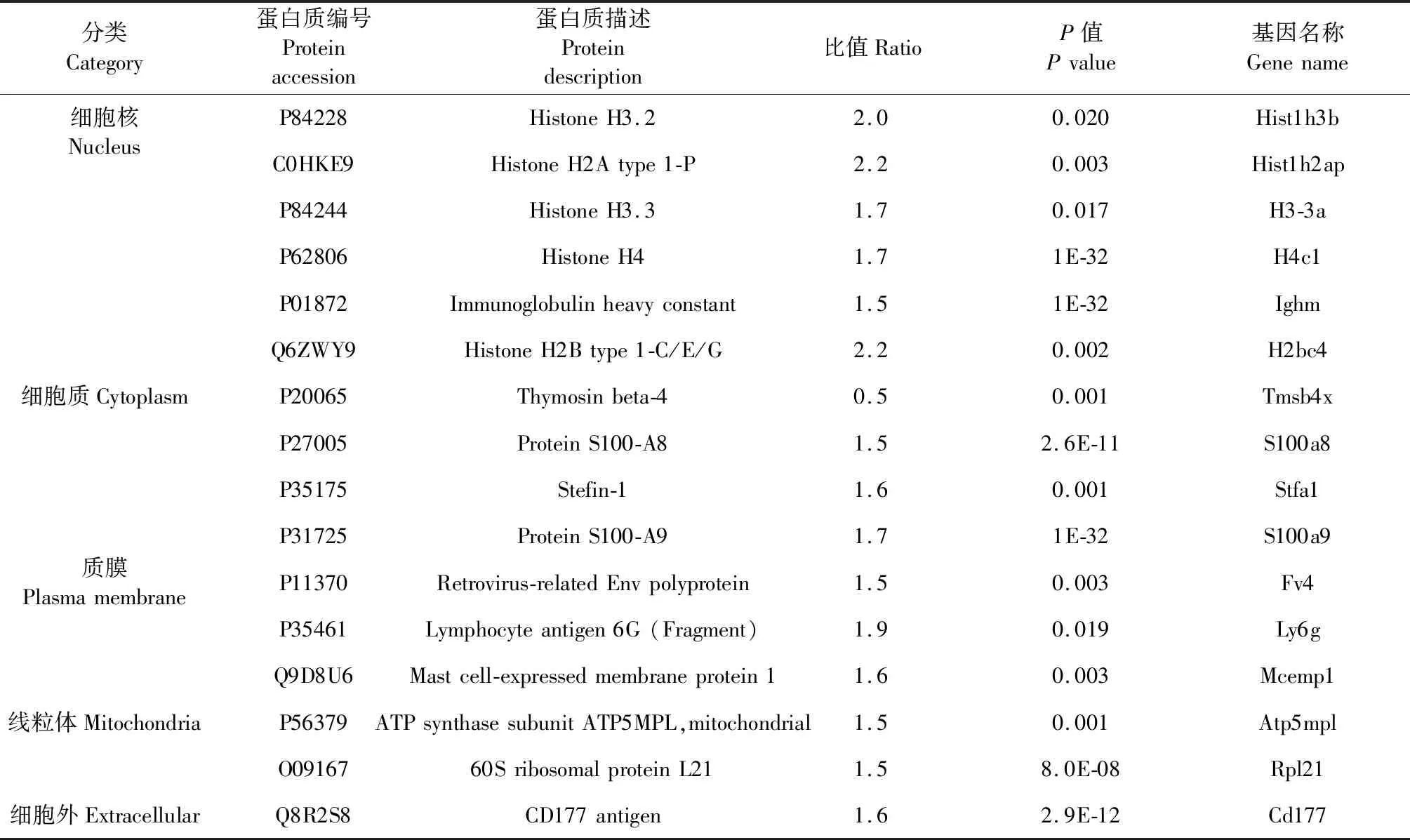
表2 4T1乳腺癌中的差异表达蛋白Table 2 Differentially expressed proteins in 4T1 breast cancer
3.2 差异表达蛋白的功能分类
3.2.1 GO二级注释分类
Cr Ap/CON的Gene Ontology(GO)分析:有7~10个差异蛋白参与调控细胞过程、单细胞生物过程、生物调节、代谢过程、对刺激的反应等生物进程(biological process),Histone参与上述生物进程;此外,有4种差异蛋白参与免疫调控,3种差异蛋白参与细胞黏附。有14种差异蛋白参与细胞组成(cellular component)的特定成分;有10种差异蛋白参与结合活性调控(见图2)。
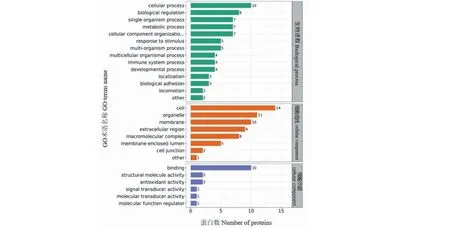
图2 差异表达蛋白在GO二级分类中统计分布图Fig.2 Statistical distribution of differentially expressed proteins in GO secondary classification
其中Histone、Protein S100分布于细胞内外,Protein S100与免疫调节和凋亡密切相关。细胞内的差异蛋白分布在细胞核、细胞质和细胞膜中,主要位于细胞核(见表3)。

表3 差异表达蛋白的亚细胞结构定位分布表Table 3 Distribution map of the subcellular structure of differentially expressed proteins
3.2.2 COG功能分类
具有诸多生物学功能的,与Histone相关的5种差异蛋白起源于染色质结构和动力学分类;而Thymosin beta-4起源于细胞运动分类(见表4)。
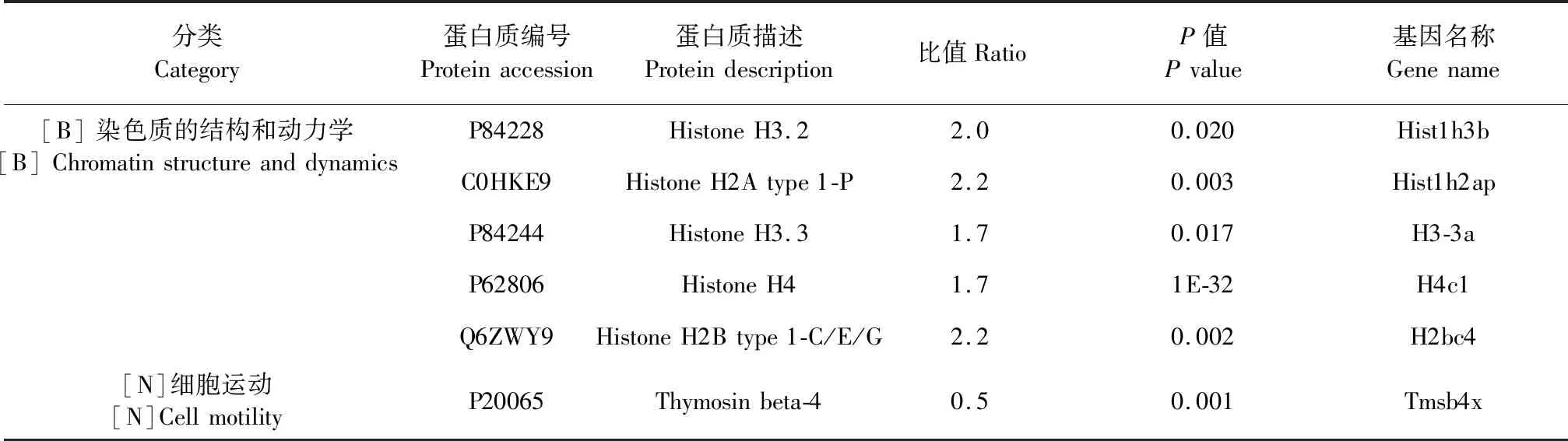
表4 差异表达蛋白的COG功能分类分布图Table 4 COG functional classification distribution map of differentially expressed proteins
3.3 差异表达蛋白功能富集分析
3.3.1 GO富集
差异蛋白Histone、Protein S100上调参与组成DNA包装复合、核小体、蛋白-DNA复合核、染色体、端粒区域染色体、端粒区域固定膜组件等;差异上调蛋白ProteinS100参与Toll 4受体结合蛋白、 花生四烯酸结合蛋白、类二十烷酸结合蛋白、脂肪酸衍生物结合蛋白、二十碳四烯酸结合蛋白、蛋白质异二聚化活性蛋白、Toll样受体结合蛋白、RAGE受体结合蛋白相关的分子功能。上调Histone、Protein S100参与Toll 4受体结合,参与蛋白质-DNA复合物组装、核小体组织、染色质组装或拆卸、DNA包装及构象变化、白细胞聚集、基因表达的调控,表观遗传、白细胞与细胞的粘附、大分子甲基化、细胞氧化剂排毒、染色质组织、细胞排毒、肽分泌的调节、细胞大分子复合物组装等生物进程(见图3)。
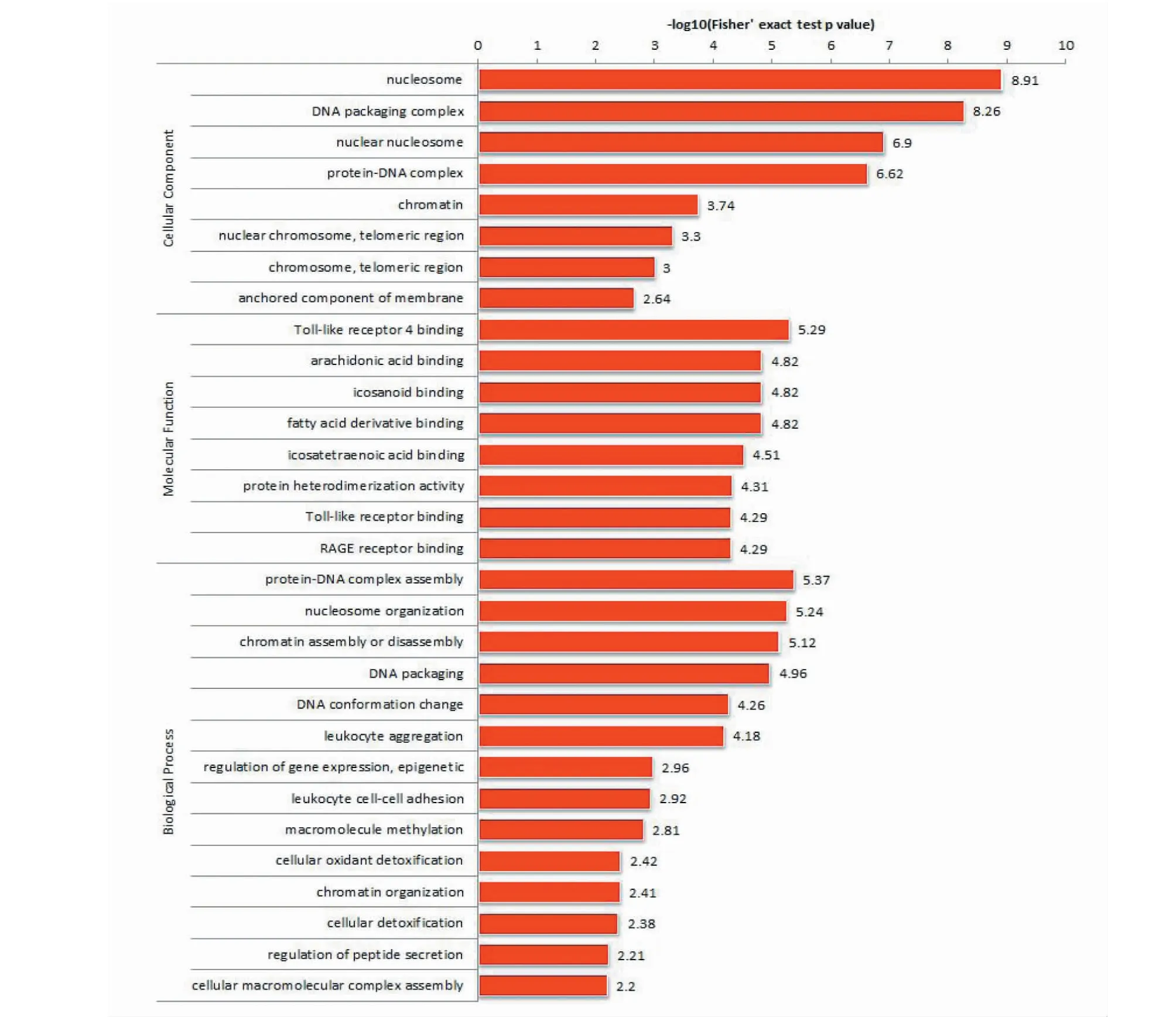
图3 Cr Ap/CON差异表达蛋白的GO富集图Fig.3 GO enrichment map of Cr Ap/CON differentially expressed proteins
3.3.2 KEGG通路富集
差异蛋白富集于癌症中的转录失调、IL-17信号通路、系统性红斑狼疮、产生IgA的肠道免疫网络、哮喘、移植物抗宿主病、病毒致癌、自身免疫性甲状腺疾病、同种异体移植排斥等通路(见图4)。
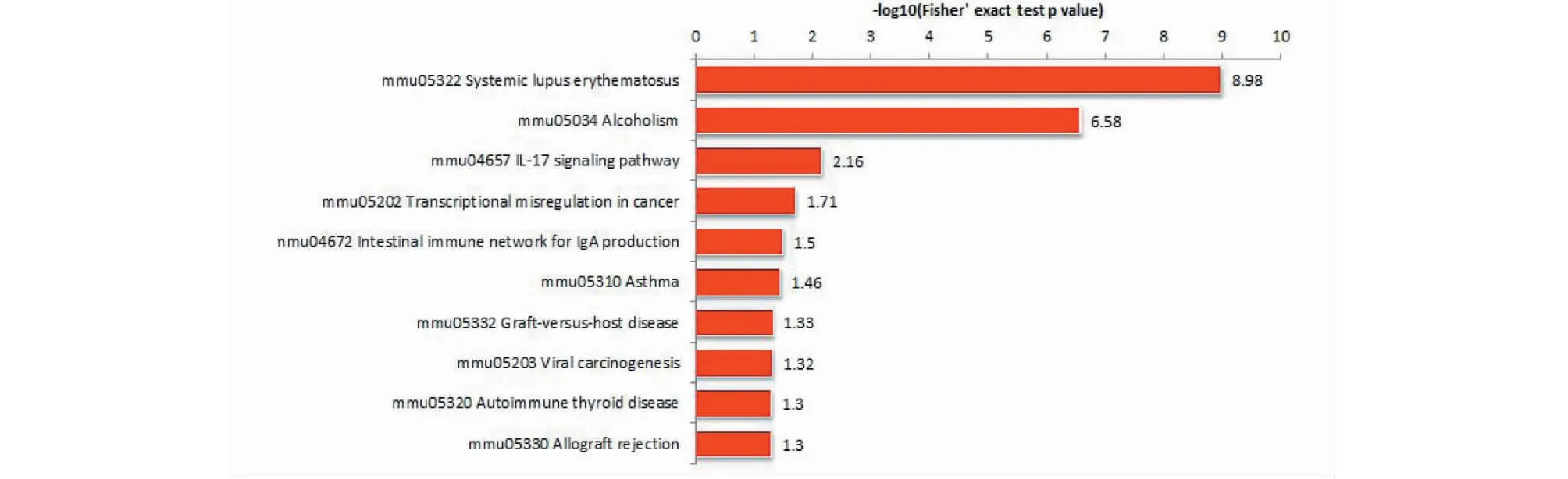
图4 Cr Ap/CON差异表达蛋白在KEGG通路图Fig.4 Cr Ap/CON differentially expressed protein in KEGG pathway
3.3.3 蛋白结构域富集
上调差异蛋白结构域富集于组蛋白折叠、组蛋白H2A/H2B/H3、Ly-6抗原/uPA受体样、S100/CaBP-9k型,钙结合亚结构域(见图5)。
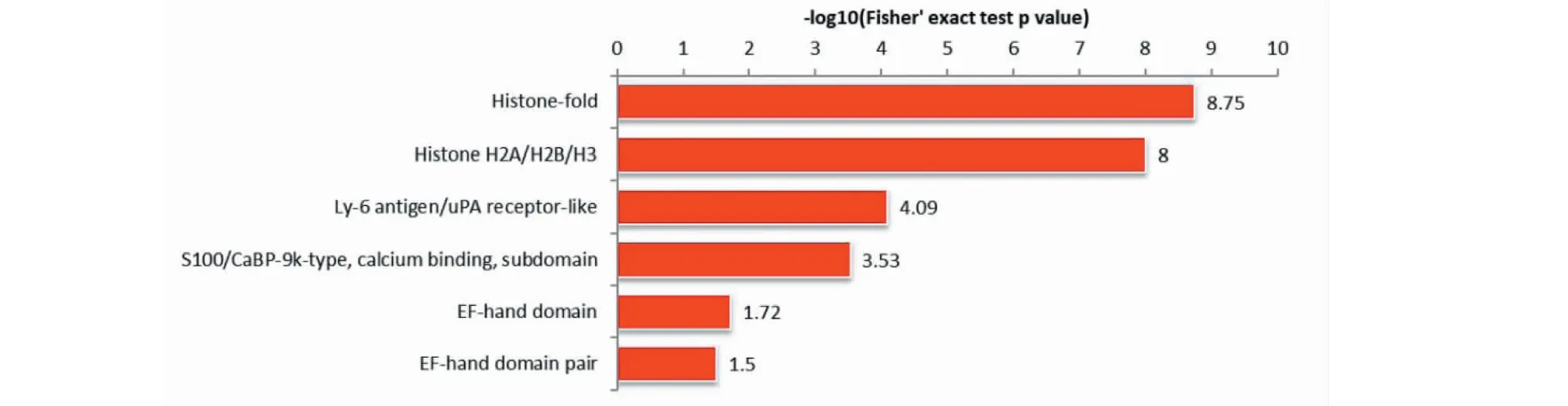
图5 差异表达蛋白富集的蛋白结构域图Fig.5 Enriched protein domains of differentially expressed proteins
3.3.4 QPCR验证结果
QPCR结果显示Cr Ap能显著提高乳腺癌组织中Ly6G、S100a8、S100a9的表达,显著降低Tmsb4x基因的表达量(见图6)。

图6 QPCR结果Fig.6 QPCR results注:与模型组相比,*P<0.05,**P<0.01。Note:Compared with the model group,*P<0.05,**P<0.01.
4 讨论与结论
本研究选用蛋白质组学筛选Cr Ap抗4T1乳腺癌的作用靶点,通过生物信息学分析了Cr Ap/CON的差异蛋白的主要功能、细胞定位、富集的信号通路和蛋白结构域,找到Cr Ap抗4T1乳腺癌的免疫调节作用靶点,并通过qPCR验证Cr Ap/CON的差异蛋白的表达情况。由于文献中选用的蛋白质组学的差异倍数为1.2倍、1.3倍、1.5倍和2倍,本实验选用1.5倍作为差异倍数,筛选出变化差异相对较大的靶蛋白,便于后期验证。由于Histone与乳腺癌的相关文献报道未检索到,因此选用除组蛋白外,差异较明显的Ly6G、S100a9、Tmsb4x、S100a8进行验证,在此实验中S100a8虽然差异表达量不算太高,但其和S100a9与癌症的发生发展密切相关。本研究发现Cr Ap在体内外均有抗4T1乳腺癌的作用,这与刘银花研究的山慈菇水提液抑制4T1细胞增殖作用一致[6]。在TCMSP数据库中检索到山慈菇的化学成分有18种,依据筛选条件(OB>30%且DL>0.18),获得山慈菇的抗乳腺癌的3种活性成分beta-sitosterol、2-methoxy-9,10-dihydrophenanthrene-4,5-diol和stigmasterol。为了明确Cr Ap作用的差异蛋白间的相关性,做了KEGG通路富集。KEGG富集通路结果显示差异蛋白富集在IL-17信号通路和癌症的转录失调信号通路。其中差异蛋白S100a8和S100a9富集于IL-17信号通路,而IL-17与Cr Ap抗乳腺癌的免疫调节作用密切相关。
文献报道山慈菇能降低乳腺癌大鼠血清及癌组织中的VEGF和基质金属蛋白酶(matrix metalloproteinase-9,MMP-9)的水平[7];而MMP-9干扰乳腺癌细胞的侵袭及迁移,IL-17可以刺激肿瘤微环境中的各种细胞产生MMPs,促进肿瘤浸润和转移。IL-17F通过募集及激活CTL,下调促血管生成因子IL-6、IL-8及VEGF的表达抑制血管生成,产生抗乳腺癌免疫调节作用,本研究也检测到山慈菇能影响癌组织中MMP含量,但差异倍数为1.2倍,因此本文中未列出。此外,IL-17F还促进肿瘤细胞分泌TNF-α,而高浓度TNF-α抑制血管形成。IL-17F募集CD8+T细胞至肿瘤组织激活NF-κB通路,从而增强抗肿瘤免疫[8]。有研究认为,IL-17F/IL-17RA缺陷小鼠,局部组织Th2淋巴细胞因子增多,通过下调Th2细胞因子抑制肿瘤进展。IL-17A募集CD4+T细胞,并促进CTL细胞的分化从而抑制肿瘤的生长[9],由此可见,IL-17与Cr Ap抗乳腺癌的免疫调节作用密切相关。本研究发现Cr Ap/CON的差异蛋白包含多种组蛋白的变化,组蛋白与肿瘤转录调控(包括修饰、染色质重塑蛋白和甲基化修饰)密切相关,如转录后调节因子Tristetraprolin(TTP)可以负调控肿瘤的发生[10]。由此可见,癌症中的转录失调通路可能是Cr Ap抗4T1乳腺癌的作用机制。已有研究发现山慈菇通过阻滞G2期细胞(与组蛋白修饰有关)而影响乳腺癌细胞生长增殖以及诱导凋亡[11]。
本研究发现Cr Ap可以降低胸腺素β-4(thymosinβ4,Tβ-4),而Tβ-4调节缺氧/复氧经历的癌细胞迁移和转移[12];且Tβ-4通过下调层粘连蛋白-5调控细胞迁移,Tβ-4可能通过诱导肿瘤血管生成,从而促进肿瘤转移。Tβ4和Tβ10均能在体外促进小鼠乳腺癌细胞的迁移,体内促进小鼠乳腺癌的转移,可能与上调MMP2,MMP9,Sdf1和Stat3mRNA水平有关[13]。由此可见Tβ4的下调可能是Cr Ap产生抗4T1乳腺癌的机制。Ly6G(淋巴细胞抗原6)蛋白由骨髓中髓样来源的细胞表达,分子量约为21~25 kDa,Ly6G基因复合体与Ly6C一起组成骨髓分化抗原Gr-1。Ly6G是检测外周中性粒细胞,单核细胞和粒细胞的标记物,Ly6G的生理作用尚不清楚,但参与抗肿瘤反应[14]。
S100-a8蛋白与ER表达水平和组织学类型有关,并与乳腺癌淋巴结转移相关[30]。S100a9表达水平在乳腺癌血清和组织中明显升高,在乳腺癌组织中表达明显高于癌旁正常组织,S100/CaBP-9k属于钙结合蛋白,提示Cr Ap可能促使细胞内钙含量增加。S100a8和S100a9均为S100钙结合蛋白家族成员,研究显示S100a8和S100a9在多种肿瘤中高表达,多种肿瘤细胞中,S100a8/a9通过双重机制诱导细胞凋亡,由此可见S100a8和S100a9的上调可能是Cr Ap促进4T1乳腺癌细胞凋亡和产生免疫调节的主要机制。目前临床治疗TNBC的效果和预后比较差,文献报道免疫调节治疗TNBC具有相对较好的预后。机体可通过调节免疫功能产生抗TNBC作用,但肿瘤细胞可以形成特殊免疫抑制微环境逃避机体免疫系统的识别和攻击,产生免疫逃逸[15],然而,打破肿瘤微环境的屏障作用,便于机体免疫系统攻击肿瘤。免疫治疗TNBC已成为国际乳腺癌研究领域的新热点[16]。也有文献表明促进CD4+T Th2亚型向Th1亚型的转变,也将是抗乳腺癌药物的新作用机制[17],本研究下一步将研究山慈菇酯提物对乳腺癌荷瘤鼠的T淋巴细胞分型和转型的影响。因此,本研究特在小鼠体内复制TNBC模型,以期揭示Cr Ap抗TNBC的免疫作用靶点。
Cr Ap抗4T1乳腺癌的免疫调节机制与增加S100-a8、S100a9的表达,降低Tβ-4的表达相关。抗TNBC的作用机制和免疫调节作用可作为研究Cr Ap的新方向。
