基于CaSR 表达及AKT 磷酸化水平的花旗泽仁改善胰岛素抵抗作用机制
2021-03-07于鹏洋郑思琦孙丽英葛鹏玲
张 义,于鹏洋,郑思琦,孙丽英,葛鹏玲
(黑龙江中医药大学基础医学院,黑龙江哈尔滨 150000)
2 型糖尿病是由高血糖引起的一种全球流行病,可影响到不同性别、年龄、种族人群,有明显的遗传基础[1],胰岛素抵抗是导致其发病的关键机制之一,表现为胰岛素生物效应的敏感性降低或丧失,它发生在病情前期,并贯穿于疾病发展全过程[2-3]。当胰岛素抵抗发生时,肝脏对葡萄糖的摄取和利用率降低,胰岛素刺激肝脏摄取利用葡萄糖是通过磷脂酰肌醇-3 激酶(PI3K)、葡萄糖转运蛋白(GLUT4)等一系列信号转导过程完成的[4-5],其主要发生机制与胰岛素信号传递受阻或减弱有关,其中PI3K 途径是胰岛素信号传导的主要通路[6]。
课题组前期研究表明[7],钙敏感受体(CaSR)拮抗剂可抑制AKT 活性,CaSR 激动剂能增强AKT活性,并在大鼠肝脏中存在CaSR 表达。通过脂肪乳灌胃加小剂量注射链脲佐菌素诱导大鼠发生的胰岛素抵抗模型,可导致CaSR 明显下调,同时可抑制与胰岛素抵抗关系密切的PI3K/AKT 信号通路中的AKT 蛋白(Ser473、Thr308 位点)磷酸化蛋白表达,从而诱发并加重胰岛素抵抗症状[8-9]。
花旗泽仁由西洋参、薏苡仁、泽泻组成,是临床治疗2 型糖尿病胰岛素抵抗的经验方。课题组前期研究表明,大鼠胰岛素抵抗模型给予该方后,可明显降低空腹血糖、空腹胰岛素水平,提高胰岛素敏感指数,上调CaSR mRNA、蛋白表达及磷酸化AKT 活性,可能是通过调节CaSR、激活PI3K/AKT 信号通路上Thr308 和Ser473 磷酸化位点、影响PI3K 通路来改善胰岛素抵抗。在此基础上,本实验应用免疫荧光法、qRT-PCR、Western blot 检测胰岛素抵抗诱导L02 肝细胞中CaSR 分布、mRNA、蛋白及磷酸化AKT(Ser473 和Thr308)蛋白表达,从而进一步在细胞水平探究花旗泽仁对2 型糖尿病胰岛素抵抗的治疗作用及其机制,为其临床应用及推广奠定基础。
1 材料
1.1 细胞 人正常肝细胞株L02,购自武汉博士德生物工程有限公司。
1.2 试剂与药物 RPMI1640 培养基、胎牛血清(美国Gibco 公司);葡萄糖检测试剂盒(美国Sigma 公司);罗格列酮(英国葛兰素史克公司);青霉素、链霉素、胰蛋白酶(北京鼎国生物科技有限公司);胰岛素注射液(徐州万邦生化制药有限公司);AccuPower RocketScript RT PreMix、AccuPower GreenStar qPCR PreMix(韩国Bioneer 公司);Trizol Reagen(英国Invitrogen 公司);CaSR抗体和β-actin(英国Abcam 公司);AKT 抗体、pAKT(S473)抗体、pAKT(T308)抗体(美国Cell signaling 公司)。
1.3 仪器 微量台式低温离心机Mircro 17R、细胞培养箱和超净工作台(美国Thermo Fisher 公司);倒置显微镜(日本奥林巴斯公司);Vortex-Genie 2 涡旋混合仪(美国Scientific Industries 公司);液闪仪(美国SIM-MAX 公司);HEV-50 高压蒸汽灭菌锅(日本Hirayama 公司);Universal HoodⅡ型凝胶成像系统、转膜仪、电泳仪、梯度单头PCR 仪、S1000 和CFX96 Real-time PCR 仪(美国Bio-Rad 公司)。
1.4 动物 清洁级SD 大鼠20 只,雌雄各半,体质量(200±20)g,由黑龙江中医药大学实验动物中心提供,动物生产许可证号SCXK2018-003,操作过程符合学术伦理要求。实验开始前大鼠适应性饲养1 周,自由摄食和饮水,房间温度在20 ℃左右,湿度50%左右。
1.5 花旗泽仁水煎液制备 花旗泽仁组方药材西洋参、泽泻、薏苡仁购于黑龙江省世一堂中药饮片厂,熬制前将3 味中药分别浸泡12 h 后加入适量水煎煮3 次,第1 次水沸后小火煎煮60 min,第2 次水沸后继续用小火煎煮45 min,第3 次水沸后小火煎煮30 min,合并水煎液,滤过,水浴浓缩,即得,生药量约为0.54 g/mL,4 ℃下保存。
1.6 10%花旗泽仁含药血清制备 取正常SD 大鼠20 只,随机分为空白组、给药组,每组10 只,雌雄各半,给药组大鼠按10 mL/kg 容量灌胃给予花旗泽仁水煎液,空白组大鼠灌胃给予等量生理盐水,每天2 次,连续7 d。课题组前期对花旗泽仁主要活性成分在大鼠血浆中药动学进行研究,发现在末次给药后1 h 其血药浓度达到峰值,故在该时间点按3.5 mL/kg 容量腹腔注射10% 水合氯醛麻醉,无菌条件下腹主动脉采血,室温下血液静置30 min,4 ℃下3 000 r/min 离心15 min,静置15 min 后取上清液,同组混匀,56 ℃下灭活30 min,0.22 μm 微孔滤膜过滤,即得含药血清,除菌分装后-80 ℃下保存备用。临用前,将其用RPMI-1640 培养基稀释成10%。
1.7 阳性对照药制备 取罗格列酮4.735 mg,溶于l mL DMSO 中,制成10 mmol/L 母液,即得,冷冻保存,实验时最终浓度为10 μmol/L。
2 方法
2.1 细胞培养 将人正常肝L02 细胞培养于含10%胎牛血清和1% 双抗(青霉素和链霉素)的RPMI1640 培养液中,置于含5% CO2的37 ℃培养箱条件中,每天换液,待细胞生长至约90% 时,用0.25%胰蛋白酶消化并传代,取对数生长期者用于实验。
2.2 模型建立 将消化好的L02 细胞悬液用PBS缓冲液洗涤2 次,按3×105细胞/孔的浓度接种于6 孔细胞培养板中,分为空白对照组、模型对照组,加入含10% 胎牛血清、5.6 mmol/L 葡萄糖的无酚红RPMI1640 培养液,在5% CO2、37 ℃饱和湿度条件下培养36 h,形成单层贴壁细胞,PBS 缓冲液洗涤2 次,再用无血清、无酚红的培养液(含1%FBS)培养24 h。模型对照组每孔加入2 mL新配制的含5×10-7mol/L 人胰岛素的无血清、无酚红培养液,空白对照组加入不含胰岛素的无血清、无酚红培养液,继续培养16 h。
2.3 葡萄糖消耗实验 将细胞用PBS 缓冲液洗涤2 次,加入含100 ng/mL 人胰岛素的培养液,于5% CO2、37 ℃饱和湿度条件下培养30 min 后加入葡萄糖继续培养24 h。取培养液上清,采用葡萄糖氧化酶-过氧化物酶(GOD-POD)法在510 nm 波长处检测光密度(OD)值,计算葡萄糖含量,公式为含量=待测液OD值/标准液OD值×5.5 mmol/L。
2.4 CaSR 表达的细胞定位检测 采用免疫荧光法。根据前期实验结果,将细胞分为常规培养的空白对照组、胰岛素抵抗L02 模型对照组(同“2.2”项)、建模后的L02 胰岛素抵抗细胞加入10%花旗泽仁含药血清RPMI-1640 培养基的花旗泽仁组,将各组细胞爬片用PBS 缓冲液浸洗后用4%多聚甲醛(100 μmol/L)固定,滴加正常山羊血清10%封闭液室温封闭30 min,将爬片转移至载玻片,吸掉封闭液,每张爬片滴加足够量稀释好的一抗(1∶500),4 ℃下孵育过夜。次日开始避光,将爬片转移至孔板中,加入PBST(PBS∶T80 =500 mL∶500 μL)缓冲液,置于摇床上浸洗,吸水纸吸干后移到载玻片上,滴加稀释好的荧光二抗(1∶200 PBST)孵育1 h,移至孔板中,PBST 缓冲液浸洗爬片,将爬片移出孔板,置于载玻片上,加入DAPI 荧光染料避光孵育后对标本进行染核,置于孔板中,PBST 缓冲液洗去多余DAPI,移至载玻片上,滴加抗荧光催灭剂进行封片,荧光显微镜下观察采集图像。
2.5CaSRmRNA 表达检测 采用qRT-PCR 法。向胰岛素抵抗L02 细胞模型中加入含1.0 ×10-5mol/L罗格列酮的RPMI-1640 培养基,作为阳性对照组,其他分组同“2.4”项,每组设置3 个复孔。造模给药24 h 后收集细胞,应用Trizol 试剂盒提取细胞总RNA,逆转录合成cDNA,以β-actin为内参进行扩增,具体操作按照试剂盒说明书进行,并检测总RNA 完整性,计算其浓度和纯度。反应体系为12.5 μL 2 ×Greenstar Master Mix +2.0 μL cDNA 样本+1.0 μL 引物 F-primer(TTCTTTGAACCTGGACGACGAGT)+8.5 μL 引物R-primer(GCGAGGAAGGATTTGTAC)1.0 μL +DEPC(焦碳酸二乙酯),反应条件为95 ℃预变性10 min;95 ℃变性10 s;47 ℃退火30 s;47 ℃延伸30 s;40 个循环。
2.6 CaSR 蛋白表达量及Akt 活性检测 采用Western blot 法。细胞分组、给药、处理同“2.5”项,药物作用24 h 后挂法收集细胞,冰上裂解30 min后4 ℃下12 000 r/min 离心10 min,吸取上清,加入蛋白上样裂解液,100 ℃下煮沸,分装,-80 ℃下保存备用。Bradford 法测定蛋白浓度,取等量蛋白,SDS-PAGE(5% 浓缩胶-12% 分离胶)分离并转移到PVDF 膜上,室温下封闭2 h,4 ℃一抗(稀释比例1∶1 000)孵育过夜,室温二抗(稀释比例1∶5 000)孵育2 h,ECL 化学发光液显色曝光。
2.7 统计学分析 通过SPSS 19.0 软件进行处理,数据以()表示,2 组比较采用t检验,多组比较采用单因素方差分析。P<0.05 表示差异具有统计学意义。
3 结果
3.1 高胰岛素诱导对L02 肝细胞葡萄糖消耗量的影响 与空白对照组比较,模型对照组葡萄糖消耗量降低(P<0.01),葡萄糖剩余量升高(P<0.01),提示细胞已处于胰岛素抵抗状态,即IR L02 肝细胞模型建立成功。见表1。
表1 高胰岛素诱导对L02 肝细胞葡萄糖消耗量的影响(, n=6)Tab.1 Effect of high-insulin induction on glucose consumption in L02 liver cells(, n=6)

表1 高胰岛素诱导对L02 肝细胞葡萄糖消耗量的影响(, n=6)Tab.1 Effect of high-insulin induction on glucose consumption in L02 liver cells(, n=6)
注:与空白对照组比较,∗∗P<0.01。
3.2 花旗泽仁对胰岛素抵抗L02 肝细胞中CaSR分布的影响 与空白对照组比较,模型对照组CaSR 分布较稀疏;与模型对照组比较,花旗泽仁组CaSR 分布较密集。见图1~3。

图1 空白对照组L02 肝细胞中CaSR 分布(×100)Fig.1 Distribution of CaSR in L02 liver cells of blank control group(×100)

图2 模型对照组L02 肝细胞中CaSR 分布(×100)Fig.2 Distribution of CaSR in L02 liver cells of model control group(×100)
3.3 花旗泽仁对胰岛素抵抗L02 肝细胞中CaSRmRNA 表达的影响 与空白对照组比较,模型对照组CaSRmRNA 表达下调(P<0.01);与模型对照组比较,花旗泽仁组、阳性对照组CaSRmRNA 表达上调(P<0.01)。见图4。

图3 花旗泽仁组L02 肝细胞中CaSR 分布(×100)Fig.3 Distribution of CaSR in L02 liver cells of Huaqizeren group(×100)
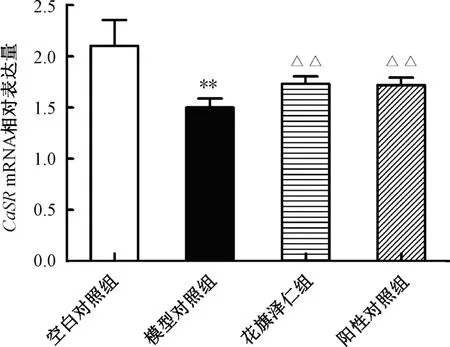
图4 花旗泽仁对L02 肝细胞中CaSR mRNA 表达的影响Fig.4 Effect of Huaqizeren on CaSR mRNA expression in L02 liver cells
3.4 花旗泽仁对胰岛素抵抗L02 肝细胞中CaSR蛋白表达的影响 药物作用24 h 后,与空白对照组比较,模型对照组CaSR 蛋白表达降低(P<0.01);与模型对照组比较,花旗泽仁组、阳性对照组CaSR 蛋白表达升高(P<0.01)。见图5。
3.5 花旗泽仁对胰岛素抵抗L02 肝细胞中磷酸化AKT 蛋白表达的影响 药物作用24 h 后,与空白对照组比较,模型对照组磷酸化AKT(Thr308、Ser473)蛋白表达降低(P<0.05,P<0.01);与模型对照组比较,花旗泽仁组、阳性对照组磷酸化AKT 蛋白表达升高(P<0.05,P<0.01)。见图6。
4 讨论
在过去几十年,2 型糖尿病的患病率显著上升,目前虽然不能根治,但可以较好地控制。胰岛素抵抗是2 型糖尿病重要病理特征,是指组织或机体靶器官对胰岛素生物效应的敏感性降低或丧失[10-12],西医治疗存在不可避免的严重问题,而中医重视辨证论治、整体调节,在治疗上有突出的优势。肝脏能摄取血液中的糖类,合成肝糖原,并降低血糖,通过分解肝糖原、肝脏糖异生途径来升高血糖[13],它作为人体重要的代谢器官,其糖代谢水平直接关系到血糖稳定[14]。因此,本实验选取L02 肝细胞,在细胞水平上探讨治疗2 型糖尿病胰岛素抵抗的分子机制。
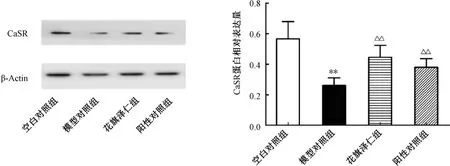
图5 花旗泽仁对L02 肝细胞中CaSR 蛋白表达的影响Fig.5 Effect of Huaqizeren on CaSR protein expression in L02 liver cells
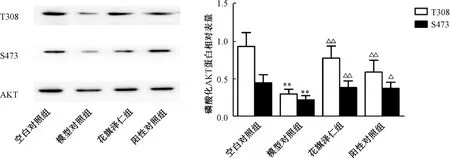
图6 花旗泽仁对L02 肝细胞中磷酸化AKT 蛋白表达的影响Fig.6 Effect of Huaqizeren on phosphorylated AKT protein expression in L02 liver cells
Leech 等[15]发现,钙敏感受体(CaSR)可能具有调节糖诱导的胰岛素分泌功能;Li 等[16]报道,CaSR 活性与蛋白激酶B(AKT)活性呈正相关,提示其作用与PI3K/AKT 信号通路有关。PI3K 信号通路的激活可提高细胞对葡萄糖的摄取能力,改善胰岛素抵抗,其机制在于激活绑定在磷脂酰肌醇-3,4,5-三磷酸上的丝氨酸或苏氨酸(Thr308,Ser473)2 个主要磷酸化位点,从而激活AKT 传导生物信号。
前期研究表明,胰岛素抵抗大鼠肝组织中CaSR 基因、蛋白表达、AKT 活性均下调。本实验中采用免疫荧光技术验证了L02 肝细胞中存在CaSR 受体分布,而且模型对照组中低于空白对照组中;采用实时荧光定量核酸扩增检测系统(qRT-PCR)发现,胰岛素抵抗L02 肝细胞模型对照组中CaSRmRNA 表达较空白对照组中有明显下降趋势;采用免疫蛋白印迹实验(Western blot)观察到,胰岛素抵抗L02 肝细胞模型对照组中CaSR 蛋白、AKT 磷酸化(Thr308,Ser473)蛋白表达较空白对照组中也呈下降趋势。
另外,结合前期实验结果,本实验在L02 肝细胞中进一步证实了胰岛素抵抗会影响CaSR 的功能性表达,降低其分布,下调CaSR 基因及蛋白表达,同时会抑制PI3K/AKT 信号通路上2 个磷酸化位点(Thr308,Ser473)活性;花旗泽仁干预后,可明显下调模型对照组大鼠血糖值,升高胰岛素敏感指数,胰岛素抵抗L02 肝细胞中CaSR 数量明显增加,CaSR 基因及蛋白表达、AKT 磷酸化(Thr308,Ser473)蛋白表达明显升高,改善胰岛素抵抗状态,并且阳性对照组也存在相同趋势。
综上所述,本实验在细胞水平探究花旗泽仁改善2 型糖尿病胰岛素抵抗的作用机制,发现花旗泽仁能使CaSR 分布、mRNA、蛋白表达量及磷酸化AKT 活性上调,可能是通过调节CaSR、激活PI3K/AKT 信号通路上AKT 的Thr308 和Ser473 磷酸化位点、影响PI3K 通路所致。
