荧光标记人透明带融合蛋白质粒的构建及其在中国仓鼠卵巢细胞内的表达
2021-03-07王明燚
王明燚,朱 燕
(1.上海交通大学附属第六人民医院生殖医学中心,上海 200233;2.中南大学湘雅三医院医学检验系,湖南 长沙 410013)
卵母细胞的透明带,是包绕在哺乳动物卵细胞以及植入前胚胎外的厚层不溶性透明丝状带基质,是卵母细胞胞外非常重要的结构[1]。哺乳类动物的透明带厚度不一,人类卵子透明带的平均厚度大约为17 μm。人透明带由4 种分泌型糖蛋白,即透明带蛋白(zona pellucida,ZP)-1(ZP1)、-2(ZP2)、-3(ZP3)和-4(ZP4)聚合成单层膜,由ZP1 连接在一起形成海绵样三维矩阵结构。4 种ZP 是由生长期卵母细胞和颗粒细胞共同分泌到卵周间隙组成[2]。
人ZP 前体的N 端信号肽在进入粗面内质网后被内质网腔面的信号肽酶切除,其C 端的尾部确保ZP 在经过卵细胞内膜系统以及在胞内囊泡运输时保持独立,不在细胞内过早发生聚合。该C 端跨膜结构域及尾部在蛋白质跨越细胞膜时被切除,ZP的主体带域则分泌到卵母细胞外,相互聚集、组装形成完整的透明带[3]。
透明带作为哺乳动物精卵结合种属特异性的结构,提供了物质支持和调节生物学功能的作用[4],在卵子发育、精卵识别及结合并诱发精子顶体反应、阻止多精受精、保护胚胎植入子宫前的发育等生殖生理过程中扮演着重要角色,对其结构和功能特征的研究是目前的研究热点[5]。
本研究采用基因重组及多种成熟的分子生物学技术,在体外构建了人透明带4 种蛋白的荧光表达质粒,可供今后进一步研究ZP 间的相互作用。用绿色荧光蛋白(ZsGreen)标记ZP1、ZP2,红色荧光蛋白(mCherry)标记ZP3、ZP4。采用RT-PCR 检测基因转录,蛋白印迹法检测目的蛋白的表达,激光共聚焦显微镜观察目的蛋白在细胞内合成及分布,结果表明,这些荧光标记融合蛋白表达载体在中国仓鼠卵巢(Chinese hamster ovary,CHO)细胞内转染成功。此实验工具,可研究ZP 的基因表达、ZP 之间相互作用的分子机制,有助于诊断卵母细胞透明带异常导致不孕的病因。
材料与方法
一、材料
1.实验材料:pENTR1A(no ccdB)中间载体和pInducer20 表达载体购自Addgene 公司,ZP 基因购自维真生物科技有限公司,感受态细胞E.Coli DH5α 购自TAKARA 公司,CHO 细胞为本实验室保存。
2.实验试剂:DMEM/F12 培养基、OptiMEM 培养基、胎牛血清、胰酶、氨苄西林、强力霉素(doxcycline,DOX)均购自Gibco 公司;T4 DNA 连接酶,限制性内切酶Bam HⅠ、Xho Ⅰ和Xba Ⅰ限制性内切酶、GAMM 试剂盒均购自美国NEB 公司;DAPI、多聚 甲 醛、Triton X-100、DEPC均购自Sigma公司;Gateway克隆试剂盒、Trizol 购自Life Technologies公司;逆转录聚合酶链式反应(reverse transcriptionpolymerase chain reaction,RT-PCR) 试剂盒购自罗氏公司;PCR 引物合成、DNA 测序由擎科生物科技有限公司提供;Taq DNA 酶购自TAKARA 公司;凝胶DNA 回收试剂盒购自PROMEGA 公司;无内毒素质粒试剂盒购自QIAGEN 公司;Lipofectamine 3000 脂质体转染试剂盒购自Invitrogen 公司;羊抗人ZP1 抗体、鼠抗人ZP2 抗体、兔抗人ZP3 抗体和ZP4 抗体均购自SANTA 公司;驴抗羊二抗、驴抗鼠二抗、驴抗兔二抗均购自Life Technologies 公司。
二、方法
1.构建含hZPN-ZsGreen/mCherry 目的基因的表达载体:参考GenBank 中各ZP 基因序列,按Gibson Assembly Master Mix 说明书的引物设计规则及实验需求设计引物(见表1),并由上海生工合成。以各ZP 基因序列为模板,PCR 扩增获得各基因片段,再使用Gibson Assembly Master Mix 试剂盒融合荧光蛋白基因序列和各ZP 基因片段,并且5’端含Bam HⅠ酶切位点、3’ 端含Xho Ⅰ酶切位点(其中ZP4 分别为Bam HⅠ和Xba Ⅰ,因为ZP4 基因序列中含有Xho Ⅰ酶切位点而不含Xba Ⅰ酶切位点)。将Gateway 克隆技术的中间载体pENTR1A(no ccdB) 和合成后的融合基因片段分别进行Bam HⅠ、Xho Ⅰ/Xba Ⅰ双酶切,使其两端含有Bam HⅠ、Xho Ⅰ/Xba Ⅰ黏性末端。酶切基因片段行琼脂糖凝胶电泳,凝胶DNA 回收试剂盒纯化回收酶切基因片段。纯化回收后的产物,用T4 DNA连接酶连接,得到含目的片段的中间载体,目的片段DNA 测序结果显示序列正确。将构建好的中间载体和含ccdB 基因的pInducer20 表达载体,用Gateway 克隆技术,得到含目的基因ZP-ZsGreen/mCherry 的表达载体以及含ccdB 基因的副产物。

表1 ZP1~ZP4 各片段引物
2.目的基因载体扩增:pInducer20 载体含抗氨苄西林抗性,而副产物含致死性的ccdB 基因。终产物转化至感受态细胞E.Coli DH5α,涂菌于含氨苄西林的固体平板培养基,37 ℃培养过夜后,观察克隆生长情况并挑取大小形态颜色均一的几个单克隆,分别在含氨苄西林的液体培养基中扩增,抽提质粒后,由生物技术公司DNA 测序验证。
3.pInducer20-ZPN-ZsGreen/mCherry 质粒转染:将CHO 细胞培养于含10%胎牛血清的DMEM/F-12 培养基中,转染前传至6 孔板。当细胞汇合度达到70%左右时,按脂质体Lipofectamine TM 3000标准操作流程将质粒转染至CHO 细胞。24 h 后更换培养基,加入DOX,诱导基因在CHO 细胞表达;48 h 后再次更换培养基并加DOX;72 h 后可收集细胞。
4.RT-PCR 检测目的基因mRNA 的表达:每组实验都分别设立空白对照组和转染后不加DOX 诱导的阴性对照组。收集转染的细胞,提取总RNA,逆转录获取cDNA。以cDNA 为模板进行PCR 扩增,凝胶电泳后,检测表达。
5.蛋白印迹法检测目的蛋白的表达:收集贴壁细胞并悬浮,洗涤加适量的裂解液(含蛋白酶抑制剂),置于冰上充分裂解。在4 ℃下,13 000 r/min 离心10 min,留取上清液。蛋白定量后,在上清中加入5×上样缓冲液,95 ℃煮沸10 min。SDS-PAGE 分离后转入聚偏氟乙烯膜,转膜后封闭1 h,一抗4 ℃孵育过夜;室温下再孵育20 min;用缓冲液洗3 次,加入相应的二抗,在37 ℃下孵育1 h;用缓冲液清洗3 次后,用化学发光检测试剂盒显色。
6.激光共聚焦显微镜观察融合蛋白的表达:转染72 h 后,弃去培养基,磷酸盐缓冲液洗2 遍后,加入6 孔板中,并加固定液1 mL,固定20 min;加2 mL 磷酸盐缓冲液,静置3 min,弃去;将盖玻片平铺在暗盒的膜上,在盖玻片上滴加100 uL 染核液染色;避光、室温孵育5 min,加磷酸盐缓冲液,静置3 min,重复2 次;加封片剂,将细胞面倒扣在载玻片上,37 ℃静置15 min;用激光共聚焦显微镜观察细胞内荧光的表达并拍照。
结果
一、RT-PCR 检测质粒转染后细胞中mRNA 的表达
凝胶电泳检测结果表明,未转染的细胞及未加入DOX 诱导的CHO 细胞无条带出现,而图1 中条带1~4 出现证实目的基因成功转染入细胞并成功表达。
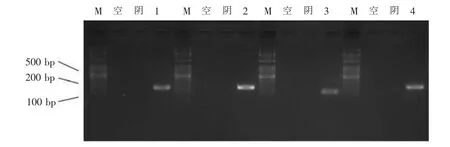
图1 CHO 细胞转染人ZP-ZsGreen/mCherry 载体后目的基因的表达(琼脂糖凝胶电泳图)
二、质粒转染细胞后蛋白的表达
用蛋白印迹法检测质粒转染细胞的ZP1~ZP4表达,结果显示,特异性条带与ZP 融合蛋白大小基本一致,为目的条带,表明ZP 融合蛋白在CHO 细胞中成功表达(见图2)。

图2 蛋白印迹法检测人ZP1~ZP4 蛋白的表达图
三、荧光蛋白的表达和分布
在激光共聚焦显微镜下观察,可见在细胞质内,转染了ZP1、ZP2 荧光融合蛋白的CHO 细胞发出绿色荧光,转染了ZP3、ZP4 荧光融合蛋白的CHO 细胞发出红色荧光(见图3)。
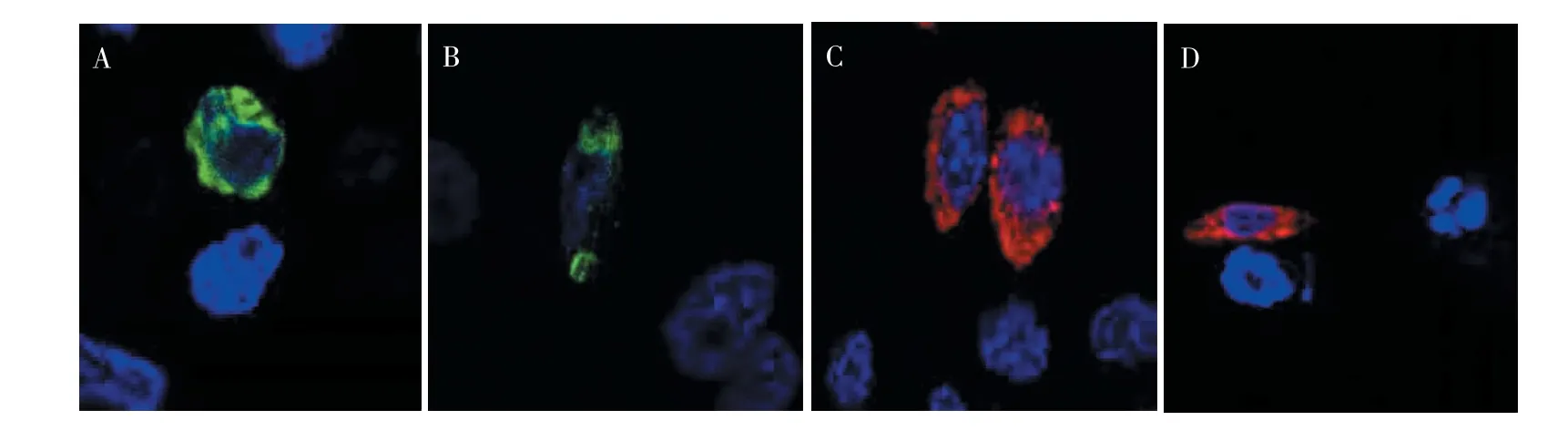
图3 激光共聚焦显微镜下CHO 细胞荧光染色和荧光蛋白表达
讨 论
近些年来,不孕症患者越来越多,对生殖生理的基础性研究也在不断深入。受精是哺乳动物自然生育的开始[6]。作为自然受精中重要的结构,透明带异常对生殖和发育的影响日益受到关注,国内外众多学者从形态学和功能学上对其进行了研究[6-7]。随着科技的进步,研究人员尝试使用纯化后的重组人ZP 和表达人ZP 的转基因动物来进行相关研究[8-9]。这些实验多为单个蛋白的研究,尚未见同时构建全部4 种人重组ZP,并研究其相互作用的报道[10]。
国外大部分关于ZP 基因突变的研究,人为设定基因敲除或过表达某一基因序列,并非自然产生的基因突变[5,11-12]。对于基因突变导致透明带形态异常的患者,少数生殖医学中心进行过卵母细胞内单精子显微注射加植入前遗传学诊断的联合治疗,但临床效果不明确,未见大规模报道[13-15]。Jimenez-Movilla 团队通过转基因小鼠,人为设定ZP2 和ZP3基因的突变,以产生有缺陷的蛋白质,实验发现,尾部缺失会导致ZP2 和ZP3 对裂解敏感以及在卵细胞质内过早地发生聚合,从而无法分泌到胞细外以参与透明带的构建,导致透明带缺失[10]。基因突变如何影响透明带的结构形成,及其如何影响受精过程,还在探索中。
不同厂家生产的ZP 蛋白抗体(山羊或兔来源的一抗或二抗)质量也参差不齐,在行免疫荧光实验时结果不理想,尤其是ZP1 和ZP4 的抗体,信号比较杂。免疫荧光实验时需要透膜封闭,加一抗和二抗,操作较繁琐,影响实验结果的不可控因素多,且实验结果不稳定。行免疫荧光实验的细胞不能继续培养,无法连续观察。当生成的ZP 可自发荧光,便于边培养边观察,可以在荧光显微镜下观察细胞的生长、荧光的强度和分布后,继续培养,是一个连续动态的过程,操作简单,干扰较少,结果可靠。
本研究采用的GAMM 一步拼接法省去了基因重组中繁杂的酶切与连接步骤,方便了操作,减少了很多不稳定因素,只需仔细设计好引物,将Zs-Green 绿色荧光基因插入ZP1、ZP2 序列的信号肽和ZP 亚结构域之间,mCherry 红色荧光基因插入ZP3、ZP4 序列的信号肽和ZP 亚结构域之间,构建出4 种人ZP 基因的荧光表达质粒。RT-PCR 和蛋白印迹法检测证明了被转基因成功的合成和表达,激光共聚焦显微镜观察了ZP 的表达和细胞内分布和定位,结果清晰直观。Gateway 克隆技术是基于E.Coli 中λ 噬菌体的位点特异性重组反应,将目的基因转至入门载体后,可以通过该技术平行转移至表达载体,还可以在后续的研究中,根据需要,转移到不同的表达载体,既高效,又便捷。而慢病毒表达载体pInducer20,因为DOX 诱导其表达,能根据实验的需要,在体细胞或卵母细胞内条件性表达,且不影响细胞的功能。
本实验成功构建了同时表达4 个ZP 基因的荧光表达质粒,成功转入CHO 细胞并表达,其条件性表达于体细胞和卵母细胞,为进一步研究ZP 间的相互作用,提供了可靠、成套的实验工具。中间载体上的目的基因可灵活转入其他表达质粒。荧光质粒也可用于构建ZP 基因突变的表达载体,进行分子机制的探索,诊断透明带异常导致的不孕。
