远东拟沙丁鱼抗氧化肽的分离纯化及结构解析
2021-03-06李亚会李积华吉宏武陆旭丽
李亚会,李积华,吉宏武,周 伟,陆旭丽
(1 中国热带农业科学院农产品加工研究所 农业农村部热带作物产品加工重点实验室 广东湛江524001 2 广东海洋大学食品科技学院 广东湛江524088)
人体与外界长期接触,如呼吸、外界污染、辐射等因素不断在体内产生自由基,过量的自由基会引起细胞内氧化还原反应失调,导致氧化应激的发生,造成生物大分子的氧化损伤。抗氧化物能缓解自由基对机体造成的损伤。近几年,人们关注更多的天然抗氧化物质,如从鸡蛋[1]、玉米[2]、大豆[3]及牛奶[4]等蛋白质酶解产物中得到的抗氧化活性肽,表现出较强的抗氧化活性。此外,水产品包括蛤[2]、鱿鱼[5]、虾[6]等蛋白酶解产物也是非常好的抗氧化活性肽的来源。
远东拟沙丁鱼属于南海低值鱼资源,具有分布广、生长快、繁殖力强的特点,其营养丰富,价格低廉[7]。前期研究结果显示远东拟沙丁鱼酶解液中的蛋白多肽具有较强的抗氧化活性[8],其氨基酸营养丰富,具有抗疲劳,抗免疫,改善皮肤等诸多优点。然而因其粗肽成分复杂,如含有未酶解的蛋白质,分子质量不同的肽段,小分子氨基酸,盐离子等成分,故影响肽的抗氧化活性。进一步分离纯化远东拟沙丁鱼蛋白粗肽,可获得纯度更高,活性强的产物。
目前最常用的分离纯化方法有凝胶过滤、离子交换层析、高效液相色谱等分离方法。本研究以分离组分的抗氧化活性及分离效果为指标,结合快流速Q 琼脂糖凝胶(Q-Sepharose Fast Flow-QFF)和反相色谱柱YMC-pack-OSD-AQ 色谱的分离方法,对远东拟沙丁鱼蛋白多肽进行逐级分离。通过微量质谱法,采用轨道阱液相质谱联用仪测定功能肽段的氨基酸序列,最后进行鉴定和解析。为探索鱼蛋白肽相关功效物质提供理论基础数据。
1 材料与方法
1.1 材料和试剂
福林酚试剂盒,美国Sigma 公司;快流速Q琼脂糖凝胶(Q-Sepharose Fast Flow),美国GE公司;乙腈、甲醇、乙醇(色谱级),美国Sigma 公司;反相C18 色谱柱(YMC-pack-OSD-AQ),美国GE 公司。
1.2 仪器与设备
AKTA-prime 蛋白质纯化仪,美国GE 公司;多功能酶标仪,美国Thermo 公司;LC1200 液相色谱仪,美国安捷伦公司;Waters e2695 高效液相,美国沃特世公司;LC-MS,美国Thermo 公司;恒温水浴振荡器(SHA-82A),深化生物技术有限公司(广州);真空冷冻干燥机(FDU-1100),理化器械株式会社(日本东京);旋锅混合器(XW-80A),上海仪器有限公司。
1.3 试验方法
1.3.1 远东拟沙丁鱼蛋白多肽的制备 工艺流程:远东拟沙丁鱼→去头去骨→酶解→灭酶(90~100 ℃)→离心→脱油→脱色、脱苦(珍珠岩)→超滤→反渗透→旋转蒸发→冷冻干燥→得到不同分子质量的多肽样品。
具体操作:将远东拟沙丁鱼(100 g)去头、皮、骨及内脏,清洗后绞碎,匀浆,在一定条件下酶解3 h(温度50 ℃,添加动物蛋白水解酶0.5%、风味酶0.1%,自然条件),之后在90~100 ℃条件下加热10 min,使蛋白质变性。4 000 r/min 离心,取上清液于管式离心机中脱油,加入珍珠岩脱色,得到的澄清液用截留分子质量为10 000 u 和3 000 u的超滤膜超滤,反渗透去除H2O 等小分子物质,得到分子质量在100~3 000 u(F1),3 000~10 000 u(F2)和大于10 000 u(F3)的多肽样品,将其在50℃条件下旋转蒸发,冷冻干燥得到干粉,备用。
1.3.2 超滤各组分的抗氧化活性
1.3.2.1 DPPH 自由基清除能力的测定 将1.5 mL 不同质量浓度样品溶液与等体积的含0.2 mmol/L DPPH 的95%乙醇置于试管中振荡,混匀。在25℃避光30 min,于波长517 nm 处测吸光度(AS)[9]。DPPH 自由基清除率以Y1(%)表示。以1.5 mL 95%乙醇加入1.5 mL 蒸馏水调零。
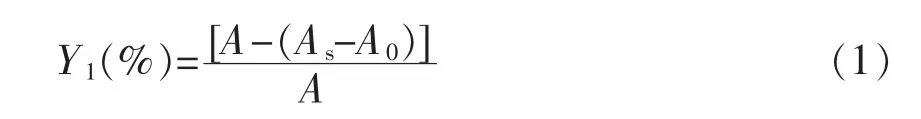
式中,As——样品与1.5 mL 含DPPH 的95%乙醇反应后的吸光度;A0——样品和1.5 mL 95%乙醇反应后的吸光度;A——蒸馏水和1.5 mL 含DPPH 的95%乙醇反应后的吸光度。
1.3.2.2 ABTS 自由基清除能力的测定 将1 mL ABTS 溶液(7.4 mmol/L)和等体积2.6 mmol/L K2S2O4混合,黑暗处静置16 h,用pH 7.4 的0.1 mol/L 磷酸缓冲液稀释40~50 倍,测定该混合液在734 nm 处的吸光度。通过稀释不同倍数来调整吸光度范围至0.7±0.02,得到ABTS+工作液。将1 980 μL ABTS+与20 μL 样品混匀,静置6 min,在波长734 nm 处测定吸光度[10]。ABTS 自由基清除率以Y2(%)表示。清除率计算公式:

式中,A0——ABTS+和蒸馏水反应后的吸光度;A——ABTS+和样品反应后的吸光度。
1.3.2.3 羟基自由基清除能力的测定 在反应体系中加入0.5 mL FeSO4溶液(9 mmol/L)和1 mL水杨酸-乙醇溶液(9 mmol/L),加样品溶液1 mL+超纯水5 mL,最后加入0.5 mL H2O2(8.8 mmol/L)启动反应,于37 ℃条件下预热30 min。对照组中以超纯水替代样品,以超纯水为参比液,在波长510 nm 处测定其吸光度,记为AS[11]。清除率以Y3(%)表示。
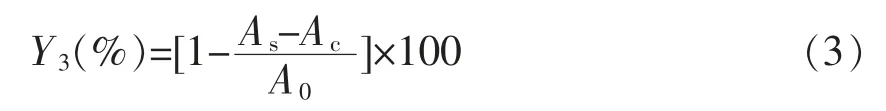
式中,As——上述所测得吸光度;A0——采用超纯水代替样品所测吸光度;AC——超纯水代替双氧水所测吸光度。
1.3.3 快流速Q 琼脂糖凝胶(Q-Sepharose Fast Flow,QFF)强阴离子交换分离纯化 采用l.6 cm×64 cm QFF 强阴离子层析柱,以0.05 mol/L Tris-HCl 作为缓冲液,对盐溶液的pH 值、洗脱方式,样品质量浓度和上样体积等进行优化[12],在波长214 nm 处检测,以提升样品的纯度和活性为最终目的,确定最佳的分离条件。
1.3.3.1 不同pH 值的流动相对QFF 分离效果的影响 在相同样品质量浓度10 mg/mL,样品体积5 mL,样品流速1 mL/min 的条件下,筛选不同pH值条件的Tris-HCl 溶液。采用线性洗脱,洗脱流速为5 mL/min,得到分离图4。
1.3.3.2 上样质量浓度对QFF 分离效果的影响由1.3.3.1 确定最适合Tris-HCl 的pH 值为9.5,洗脱速度5 mL/min,上样流速1 mL/min,上样体积5 mL,筛选上样质量浓度,得到分离图5。
1.3.3.3 上样体积对QFF 分离效果的影响 在以上确定条件下,为了增大样品得率,继续增加上样体积,根据分离效果收集浓度更高的分离组分,如图6所示。
1.3.3.4 洗脱方式对QFF 分离效果的影响 通过线性洗脱得到的分离图谱,进一步采用梯度洗脱液进行分离,选择离子强度为0.13,0.28,0.5,1 mol/L NaCl 的0.05 mol/L Tris-HCl 和离子强度为0.07,0.18,1 mol/L NaCl 进行对比,结果如图7。
1.3.4 YMC-pack-OSD-AQ 分离纯化 采用反相高效液相色谱,通过反相C18 色谱柱(YMC-pack-OSD-AQ)对QFF 强阴离子分离组分进行分离纯化。以乙腈和超纯水为流动相,通过调节流动相的流速、乙腈与水的比例,以提高分离样品的纯度和得率,最终确定最佳的分离条件。
1.3.5 氨基酸测序 将收集到的组分冷冻浓缩后冻干成粉,采用微量质谱法,利用轨道阱高分辨质谱系统,在喷雾电压3 kV、蒸发温度200 ℃和毛细管温度300 ℃、鞘气流速和辅助气流速分别为30 mL/min 和5 mL/min 的条件下,对样品进行检测[13]。通过检测得到一级质谱,筛选主要成分进行二级质谱的检测,结果见图10~13。
1.4 数据处理
所有试验均重复3 次,其结果为平均值±标准偏差。采用Origin 8.6 作图和SPSS 软件进行多重比较和方差分析。
2 结果与讨论
2.1 超滤后各组分抗氧化活性分析
肽的分子质量与其抗氧化活性有较大的相关性,一般而言,随着分子质量的减小,其对自由基清除能力逐渐增强[14]。在同一质量浓度条件下,不同分子质量区间的组分对DPPH、ABTS 自由基均有较强的清除能力(图1、2),且F1 与另外两个组分(F2、F3)相比,表现出更强的清除能力,其清除率在55%以上。图3 结果显示,各组分对羟自由基的清除能力相对较低,其中F1 比F2、F3 的清除能力要稍强,F3 的清除能力最差,说明分子质量较小的组分显示的抗氧化活性反而更强,当F1 质量浓度为10 mg/mL 时,其清除能力在40%以上。最终选择组分F1 进行分离纯化。
2.2 QFF 强阴离子色谱柱分离条件对组分分离效果的影响
2.2.1 不同pH 值的流动相对QFF 分离效果的影响 由图4 可知,以穿透峰面积占整个峰面积值的比例判断样品在色谱柱中的吸附程度,穿透峰面积比例越小,其吸附效果越好。不同pH 值的Tris-HCl 溶液对QFF 分离效果不同,其原因是流动相pH 值决定样品的离子状况,在不同的电荷条件下,样品与填料离子之间的相互作用不同,直接决定其分离状况,选择pH 值分别为8.0,8.5,9.0,9.5 的Tris-HCl 溶液,结果如图4所示。根据图4 结果分析,最后确定pH 9.5 为最佳分离条件。

图1 不同质量浓度F1、F2、F3 的DPPH 自由基清除率Fig.1 DPPH radical scavenging rates of different mass concentrations of F1,F2,F3

图2 不同质量浓度F1、F2、F3 的ABTS 自由基清除率Fig.2 ABTS radical scavenging rates of different mass concentrations of F1,F2,F3
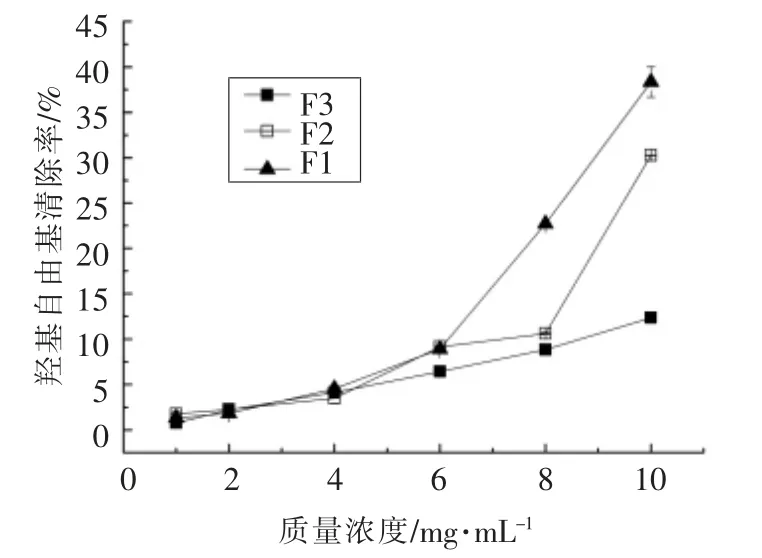
图3 不同质量浓度F1、F2、F3 的羟基自由基清除率Fig.3 Hydroxy radical scavenging rates of different mass concentrations of F1,F2,F3
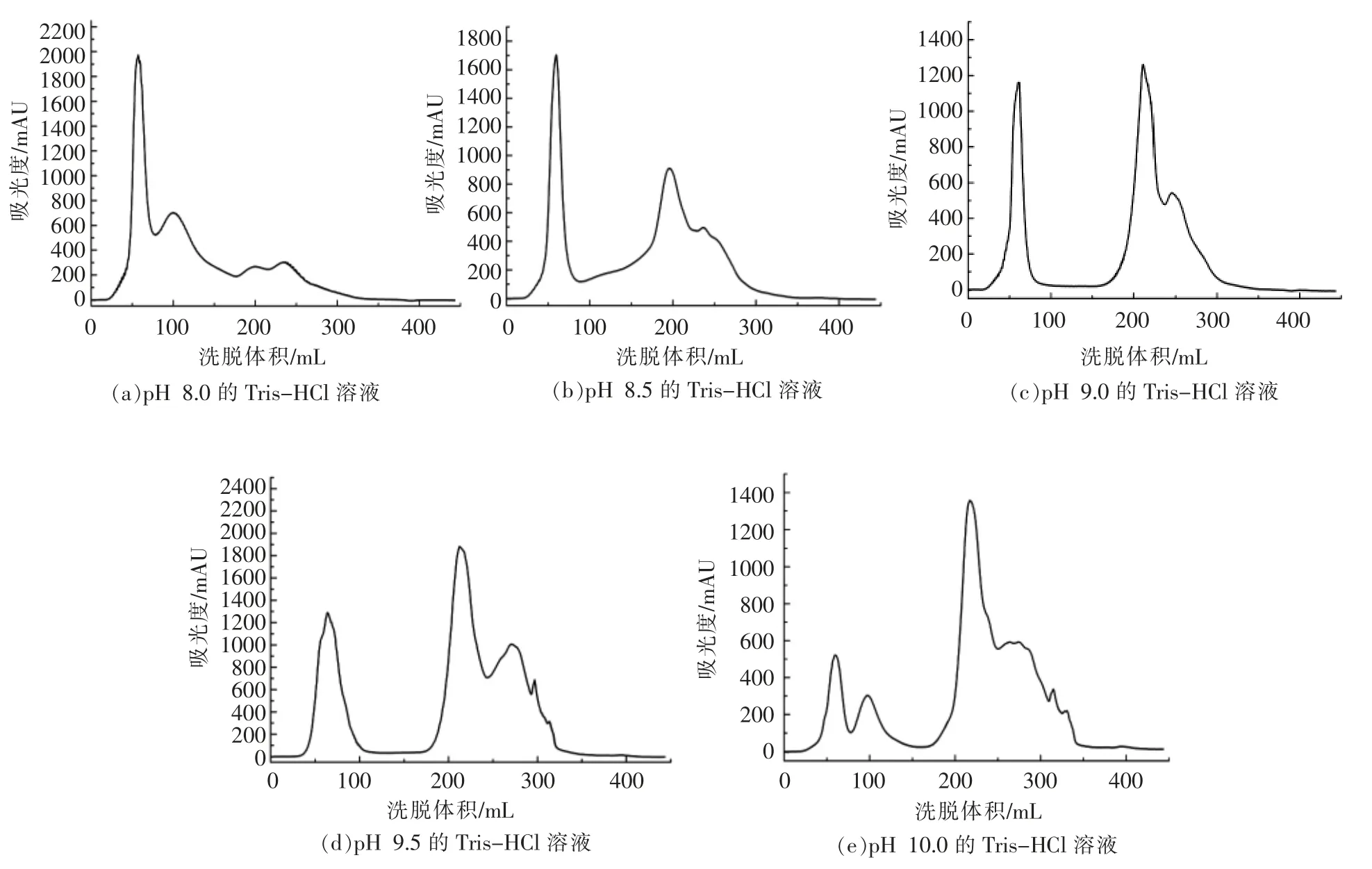
图4 不同pH 值的Tris-HCl 溶液对QFF 分离效果的影响Fig.4 Effect of Tris-HCl solutions with different pH value on QFF separation
2.2.2 上样质量浓度对QFF 分离效果的影响从图5 可知,当上样质量浓度为5,10,20 mg/mL时,其穿透峰面积较小,说明样品都能较好的吸附在色谱柱上,随着上样浓度降低,其穿透峰越小,说明分离效果越好。当上样质量浓度为5 mg/mL时,穿透峰面积最小,吸附效果最佳。最终选择上样质量浓度为5 mg/mL。
2.2.3 上样体积对QFF 分离效果的影响 由图6可知,随着上样体积的增加,穿透峰面积逐渐增大,分离效果较差。在尽可能获得最大得率条件下选择最大的上样体积。当上样体积为40 mL 时,穿透峰高于洗脱峰,说明样品吸附不好,直接被洗脱。最终选择最佳上样体积30 mL。
2.2.4 洗脱方式对QFF 离效果的影响 在前期试验的基础上,分别选择梯度洗脱为0.13,0.28,0.5,1 mol/L NaCl 和0.07,0.18,1 mol/L NaCl,结果发现梯度洗脱比之前的线性洗脱分离效果好,其可能原因是在不同浓度的氯化钠条件下,样品与填料间的相互作用有所改变,显示峰型有较大的变化。从图7 可知,分离条件T2 时,穿透峰面积小于分离条件T1 时的,说明样品吸附能力较好,得率较高,最终选择最佳梯度洗脱条件为0.07,0.18,1 mol/L NaCl。


图5 不同上样质量浓度对QFF 分离效果的影响Fig.5 Effect of different sample mass concentration on QFF separation

图6 不同上样体积对QFF 分离效果的影响Fig.6 Effect of different volume of simple on QFF separation

图7 不同NaCl 浓度对QFF 分离效果的影响Fig.7 Effect of different elution concentration of simple on QFF
最终确定QFF 的分离条件为:pH 9.5 的Tris-HCl 溶液,上样质量浓度5 mg/mL,上样体积30 mL,上样流速1 mL/min。采用浓度为0.07,0.18,1 mol/L NaCl,洗脱流速5 mL/min。在相同条件下集中收集峰a、峰b 后测定其抗氧化活性,结果见图8。
由图8 可知,将收集得到的峰a,峰b 进行浓缩,在一定条件下测定其对DPPH 自由基、羟自由基及ABTS 自由基清除能力,结果显示:峰b 对3种自由基的清除能力都比峰a 强。最终选择峰b进行下一步分离纯化。
2.3 反相色谱柱YMC-pack-OSD-AQ 分离纯化
将收集得到的峰b 采用反相色谱柱YMCpack-OSD-AQ 分离纯化。通过不同体积分数(7%,11%,20%)的乙腈为流动相进行分离,结果发现以11%的乙腈作为流动相,其分离效果最佳,结果如图9。
从图9 可看出,由YMC-pack-OSD-AQ 分离得到的6 个峰,收集2 个主要峰(1 和6),在相同蛋白含量条件下,检测其对ABTS 自由基的清除能力。结果显示:b-f1 和b-f6 对ABTS 自由基清除能力分别为(81.22±4.12)%,(76.35±3.32)%,2个峰的活性没有太大的差异,说明这2 个主要峰中都含有起抗氧化作用的成分。将这2 个峰收集、浓缩后进一步测定其氨基酸序列。
2.4 氨基酸测序
采用轨道阱-液相质谱联用测定,将得到的b-f1 和b-f6 干粉溶解,用微量进样品器进样,雾化处理形成气体,进入检测器,检测得到一级质谱。根据样品的特性及分离效果,筛选主要的离子峰作为母离子,进入二级质谱检测。经惰性气体碰撞,分子间相互碰撞的程度不同,其肽段沿肽链断裂方式也不同。研究表明,可通过二级质谱所得碎片离子峰之间的质量差值推断其可能的肽序列[15]。以Fohlman 和Roepstorff 提出的命名方式[16-17],N端用字母a、b、c 等表示,C 端用x、y、z 等表示。碎片离子可能发生脱水、脱氨,形成非常规的离子峰,还会形成支链丢失或者两端断裂等离子,产生多组不同类型的碎片离子峰[18],使分析氨基酸序列更具难度。对于CID 质谱,利用从头测序法[19],根据肽键的断裂方式,一般会形成完整的b/y 系列离子,也会有些碎片离子丢失。同一邻近元素之间的相对分子质量之差为一个氨基酸残基相对分子质量,根据上述2 个信息推断整个多肽序列。
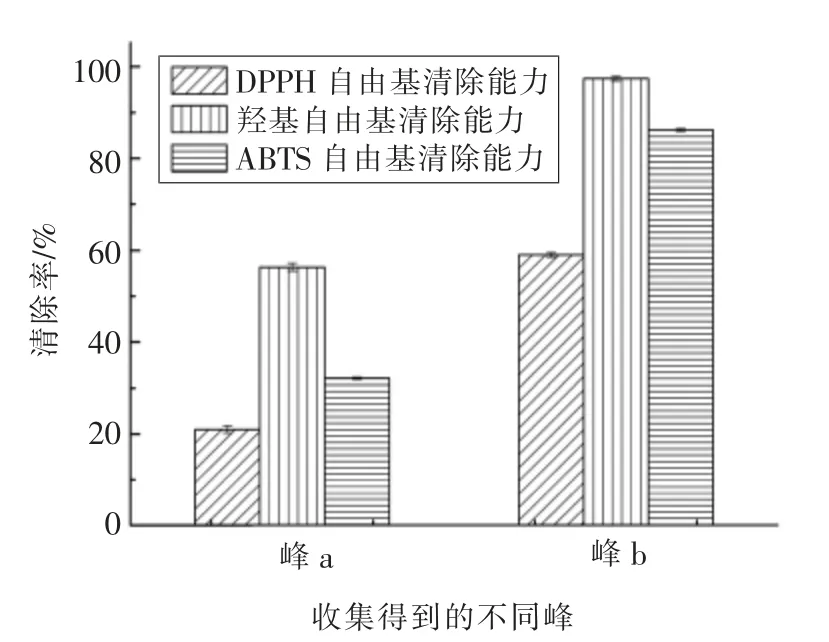
图8 QFF 分离组分的自由基清除能力Fig.8 Free radical scavenging capacity of QFF fractions
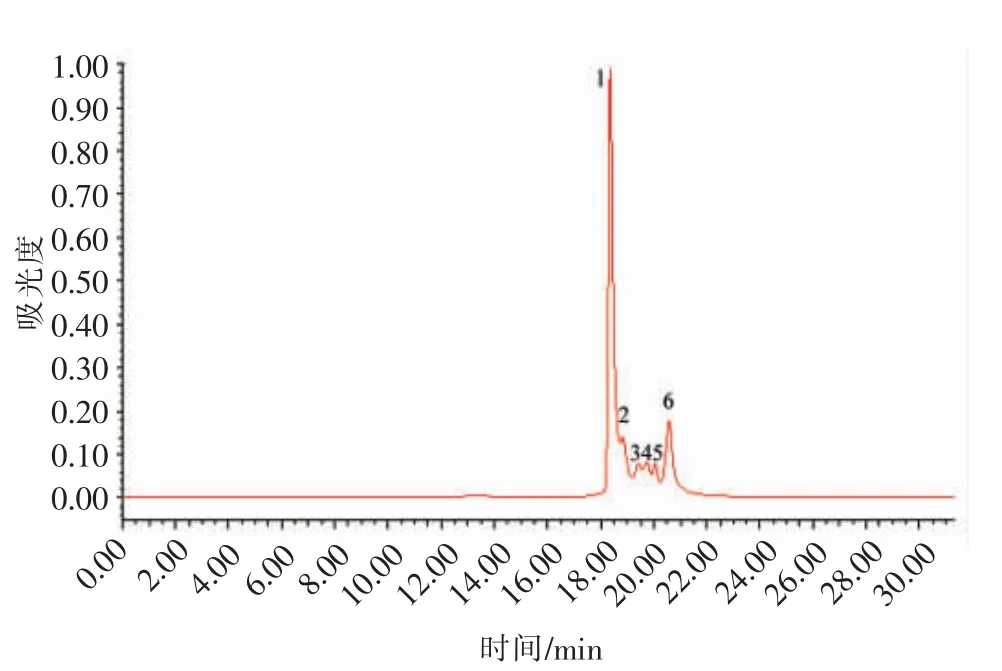
图9 YMC-pack-OSD-AQ 的分离图谱Fig.9 Separation chromatogram of YMC-pack-OSD-AQ
根据图10、11,初步推断得到b-f1(437.2)的氨基酸序列可能是Arg-Phe-Asp(RFD)或者Trp-Thr-Met(WTM)。其母离子(M+H)+=437.1,说明其氨基酸序列的分子质量约437 u。
根据图谱碎片分析,若命名b1=159.1,b2=303.1,则其中可能含有氨基酸残基Phe(b2-b1+20=164 与Phe=165 相近),y1=133(Asp)和y2=279(缺失),能够找到y2-H2O=261 的相关离子碎片,此时推测其可能的氨基酸序列为Arg-Phe-Asp,分子质量为436 u,与母离子的m/z=437 u 基本吻合。
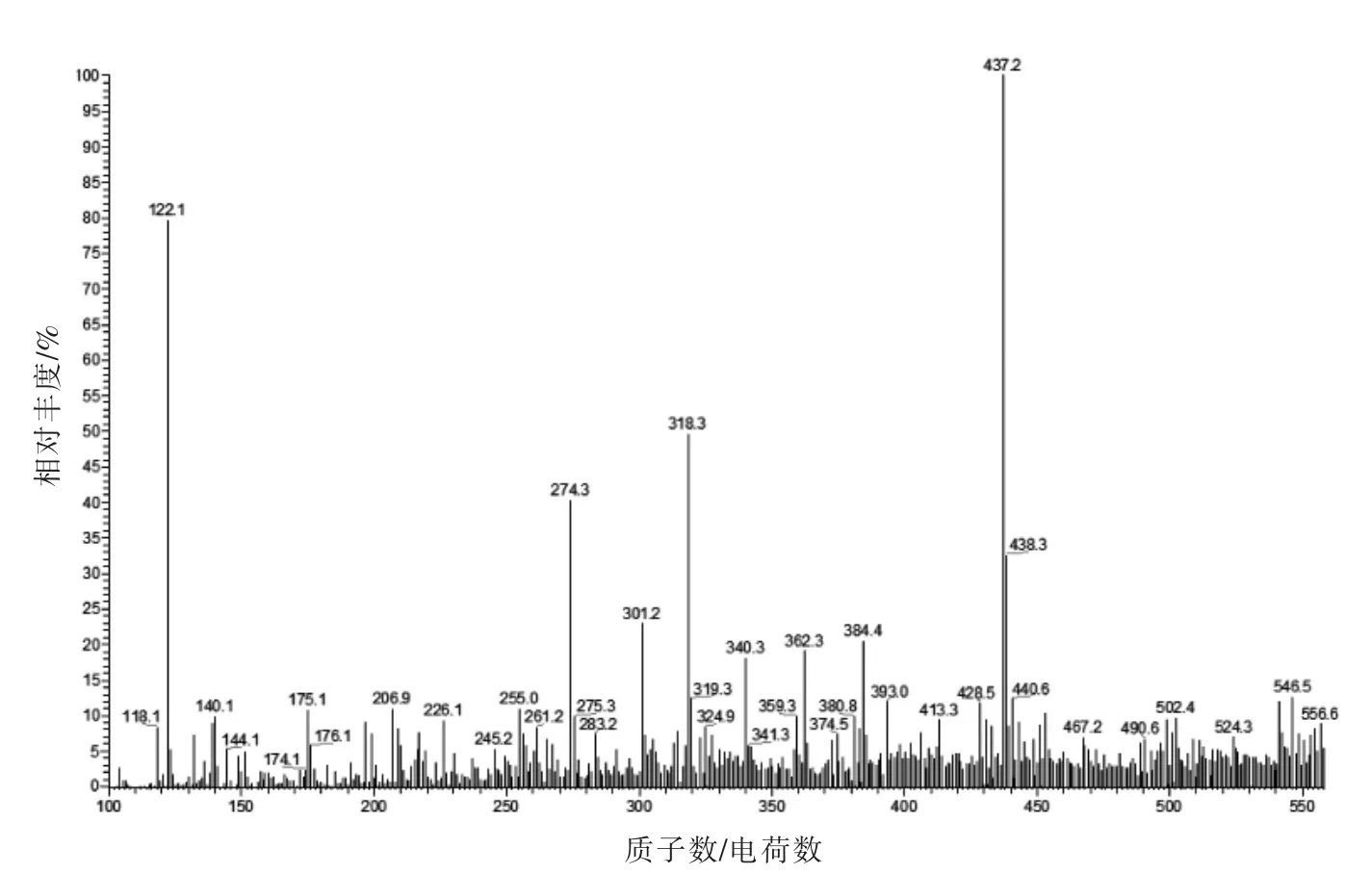
图10 ESI-MS(b-f1)的一级质谱图Fig.10 The primary mass spectrogram of ESI-MS(b-f1)

图11 ESI-MS-MS(b-f1-437.2)的二级质谱图Fig.11 The secondary mass spectrogram of ESI-MS(b-f1-437.2)
若命名y2=303.1,y1-COOH=159.1,则y1=203.1与碎片离子为202.9 相近,可能存在的氨基酸残基为y2-y1=100,还可能存在氨基酸Thr(y2-y1+20=120 与氨基酸Thr=119 相近)。根据y 型离子质谱和b 型离子质谱相互转换公式 m(y)+ m(b)=m(s)+ m(H),m(s)为母离子的相对分子质量;计算b1=132,b2=233 缺失,然而可以找到a2=b2-CO=205 与离子碎片202.9 相近,最终推断其可能氨基酸序列为Trp-Thr-Met(WTM),其分子质量为436,与母离子的m/z=437.2 基本吻合。
根据图12 和图13 初步推断b-f6(701.7)可能的氨基酸序列为Phe-Ala-His-Asp-Asp-Pro。其母离子(M+H)+=701.7,说明其分子质量在701.7左右。根据主要离子碎片的分子质量683.5,588.4,475.3,362.3,推算其可能含有氨基酸残基Pro(683.5-588.4+20)、Asp(588.4-475.3+20=133.1与Asp 相近)、Asp(475.3-362.3+20=133)。最后推断其中的离子碎片对应的b,y 离子,b5=570.4,b4=493.4,b3=362.3;y5-NH=588.4;y4-NH=475.3;x3=y3+28=344.3,其它碎片离子均缺失,最后推断其可能的氨基酸序列为Phe-Ala-His-Asp-Asp-Pro,分子质量为700 u,与主离子701.5 基本吻合。
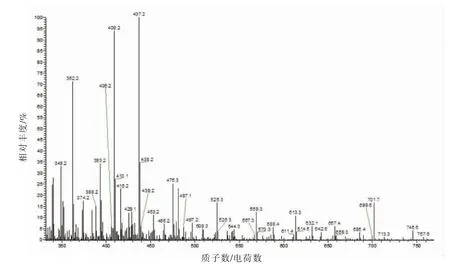
图12 ESI-MS(b-f6)的一级质谱图Fig.12 The primary mass spectrogram of ESI-MS(b-f6)
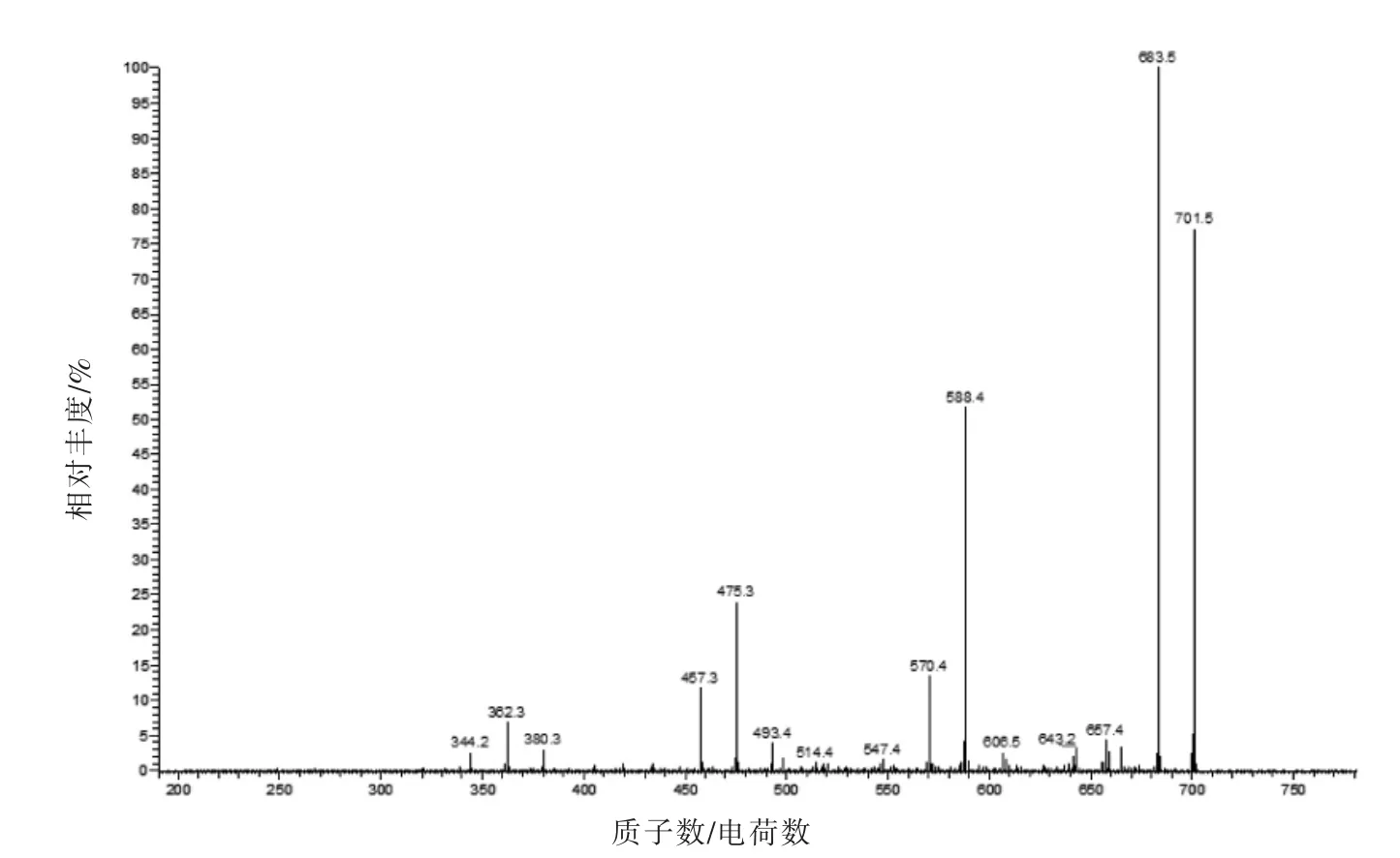
图13 ESI-MS-MS(b-f6-701.7)的二级质谱图Fig.13 The secondary mass spectrogram of ESI-MS(b-f6-701.7)
3 结论
选用离子色谱和凝胶色谱对超滤后的组分F1(100~3 000 u)进行分离纯化,用轨道阱液质联用对收集组分进行氨基酸结构测序,得到以下结论:逐级分离后获得2 个活性较强、纯度较高的组分b-f1 和b-f6。b-f1 分子质量为436 u,其氨基酸序列是Arg-Phe-Asp(RFD)或Trp-Thr-Met(WTM);b-f6 的分子质量为700 u,其氨基酸序列为Phe-Ala-His-Asp-Asp-Pro。
