成熟时间对羊肉发酵香肠品质及风味的影响
2021-03-06胡冠华王德宝赵丽华田建军
胡冠华,王德宝,赵丽华,苏 琳,田建军,靳 烨
(内蒙古农业大学食品科学与工程学院 呼和浩特010018)
发酵香肠是将绞碎的瘦肉与丁状脂肪按一定比例与辅料均匀混合后灌入肠衣,在自然或微生物发酵作用下生产的具有特殊风味、色泽和质地及较长保质期的一类肉制品[1]。发酵香肠成熟过程中,会发生一系列的理化、生化及微生物反应,这类反应主要是蛋白质和脂质的分解氧化,它们既可提供丰富的营养因子,又可通过Strecker 反应及美拉德等反应生成决定香肠品质的重要风味物质[2]。发酵香肠中大多数风味物质在成熟阶段产生。Meyniera A 等[3]研究表明香肠干燥成熟是游离脂肪酸释放的关键时期,饱和脂肪酸含量降低,不饱和脂肪酸含量增加,且游离脂肪酸进一步被氧化分解为醇、醛、酮等,形成香肠特有风味,如3-甲基丁醛、二烯醛、葵酸乙酯等。韦友兵等[4]通过研究萨拉米香肠发酵成熟过程中蛋白质水解及脂质氧化规律,发现香肠成熟过程是蛋白质水解和游离氨基酸总量累积的主要阶段。Casquete 等[5]、Salazar 等[6]和朱迎春等[7]研究发现香肠成熟阶段对发酵肉制品的色泽、pH 值、aw及微生物数量等均有影响。目前成熟周期对发酵香肠的品质和风味研究报道较少。
本文以羊肉为原料,添加木糖葡萄球菌、清酒乳杆菌作为发酵剂,制作羊肉发酵香肠,探究不同成熟时间对羊肉发酵香肠食用品质及风味累积的影响,以期为香肠规模化生产加工提供理论依据。
1 材料与方法
1.1 材料与试剂
原料肉:羊肉(肥瘦比为1∶4),源自内蒙古巴彦淖尔乌拉特中旗苏尼特羊后腿及羊尾。肠衣:20~25mm 胶原蛋白肠衣。
发酵剂:清酒乳杆菌(Lactobacillus sake)、木糖葡萄球菌(Staphylococcus xylosus),由内蒙古农业大学肉品微生物实验室提供。
主要试剂:蔗糖、葡萄糖、抗坏血酸钠(分析纯),上海国药集团有限公司;37 种游离脂肪酸标准品、甲醇、正己烷及丙酮(色谱级),美国Sigma公司。
仪器与设备:高效液相色谱仪(1260),美国安捷伦公司;岛津气相色谱仪(GC2014),日本岛津公司;全自动测色色差计(TCP2),北京奥依克光电仪器;智能水分活度测量仪(HD-3A),上海精密仪器仪表公司;恒温恒湿培养箱(LRH-250-HS),天津市福元铭仪器设备有限公司。
1.2 试验方法
1.2.1 发酵香肠制作 参照ZHAO 等[8]方法,试验配方:羊后腿肉80%、羊尾肥膘20%、蔗糖0.5%、食盐2.5%、亚硝酸钠70 mg/kg、葡萄糖0.5%、硝酸钠100 mg/kg、抗坏血酸钠0.05%、发酵剂107CFU/g。
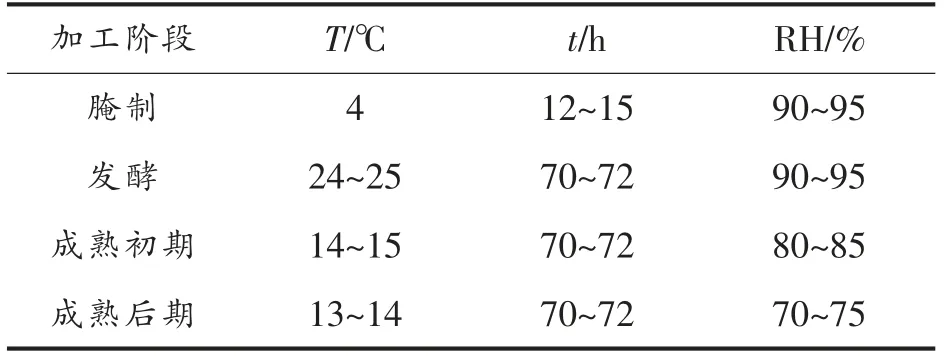
表1 发酵香肠加工工艺条件Table 1 Fermented sausage processing conditions
1.2.2 试验设计 在原有发酵羊肉香肠研究基础上,对直径20~25 cm 的胶原蛋白肠衣灌装的羊肉香肠的最佳成熟周期进行确定。本试验将成熟期分为5 d,分别对不同成熟时间(0,3,4,5,6 d)的羊肉香肠食用品质及风味感官进行比较,以确定该直径下羊肉香肠的最佳成熟周期。
1.2.3 理化品质测定 参照GB 5009.237-2016《食品pH 值的测定》[9]、GB 4789.35-2016《食品微生物学检验 乳酸菌检验》[10]及GB4789.38-2016《食品微生物学检验 大肠菌群计数》测定香肠pH值、乳酸菌及大肠菌数[11]。MSA 琼脂培养基,根据平板菌落计数的方法测定葡萄球菌数;使用HD-3A 型智能水分活度仪及TCP2 型色差计测定香肠aw、色泽亮度(L)和红度(a*)。
失重率测定:将灌装后香肠质量记为m,其它成熟阶段香肠质量记为m1,不同成熟阶段的失重率记为W(%),则W(%)=(m-m1)×100/m,重复测定3 次,取平均值。
1.2.4 游离脂肪酸的测定 脂肪酸提取:参照Folch 等[12]的方法提取香肠中脂肪,称取5 g 肉样匀浆,加入5 mL 0.5 mol/L NaOH-CH3OH 溶液,70 ℃回流5min,加入BF3-CH3OH(1∶3,V/V)溶液5 mL,70℃回流2 min,最后加入3 mL C6H14溶液萃取(70 ℃,1 min),加入5 mL 饱和NaCl 溶液,静置10 min,分层后吸1 mL 上层液体于进样瓶中做气相色谱分析。
气相色谱条件:升温程序:初温120 ℃,保持5 min,以4 ℃/min 速率升至250 ℃,持续28 min。进样口温度250 ℃,检测器温度280 ℃。载气为高纯氮气(99.99%)。氢气流速40 mL/min,恒定柱流速1.1 mL/min,分流比20∶1。进样量1.0 μL。
1.2.5 风味的测定 参照罗玉龙等[13]方法并略作修改。将4 g 切碎的香肠样加入20 mL 样品瓶中,将萃取头插入样品瓶,在60 ℃下吸附40 min 后拔出,在GC 进样口(250 ℃)解吸附3 min。
挥发性风味成分的GC-MS(气相色谱-质谱)测定条件:GC 条件:TR-5 型毛细色谱柱(30 m×0.25 mm×0.25 μm),载气为He,载气流速1.0 mL/min,传输线温度250 ℃,进样时间1 min;升温程序:40 ℃保持3 min,以4 ℃/min 升温到150 ℃,保持1 min,再以5 ℃/min 升温到200 ℃,最后以20℃/min 升至230 ℃,保持5 min。MS 条件:离子源温度250 ℃,进样口温度250 ℃,质量扫描范围30~400(质荷比)。
质谱数据与MEANLIB、NISTDEMO 和Wiley Library 检索定性,将匹配度大于800 作为鉴定依据。
1.3 数据处理
采用Excel 和SPSS 19.0 统计软件对数据进行统计处理和显著性分析。
2 结果与分析
2.1 成熟时间对羊肉发酵香肠理化品质的影响
由表2 可知,随着发酵成熟时间的延长,香肠pH 值呈现下降,其中前4 d pH 值由5.70 快速降至4.81,下降率16.93%,主要是由于微生物分解碳水化合物生成乳酸等有机酸所致[14]。成熟第4~5 天香肠pH 值趋于稳定,成熟第6 天pH 值虽稍有下降,但与成熟第4~5 天相比差异不显著(P>0.05)。香肠成熟结束时pH 值降至4.75,显著低于(P<0.05)发酵肉制品安全酸度5.3。有研究表明低酸度有利于抑制病原菌的生长,可促使亚硝酸盐分解,减少残留的NO2-与二级胺反应生成N-亚硝胺的可能,从而提高产品食用的安全性[15]。
水分活度是影响发酵肉制品货架期和食用安全性能的重要因素[16]。表2 表明香肠aw呈现快速下降趋势,失重率与aw变化趋势恰相反,表明两者变化呈显著负相关,这可能是由于成熟前期香肠pH 值大幅降低,接近蛋白质等电点,改变了肌球重链蛋白与水分结合能力所致[17]。香肠成熟0~3 d,aw下降速率最快,可能与成熟初期温度和湿度大幅下调有关,香肠内部湿度与外部环境形成较大湿度差,使香肠中水分大量向外扩散和蒸发,这与王德宝等[18]研究结果一致。成熟结束时香肠的aw和失重率分别达到0.75,53.60%。Talon 等[19]研究表明aw低于0.90 时可有效抑制腐败菌、致病菌生长繁殖。综上,成熟时间的延长可显著降低香肠的aw,低aw有助于提高香肠食用品质和安全性能,延长产品货架期。
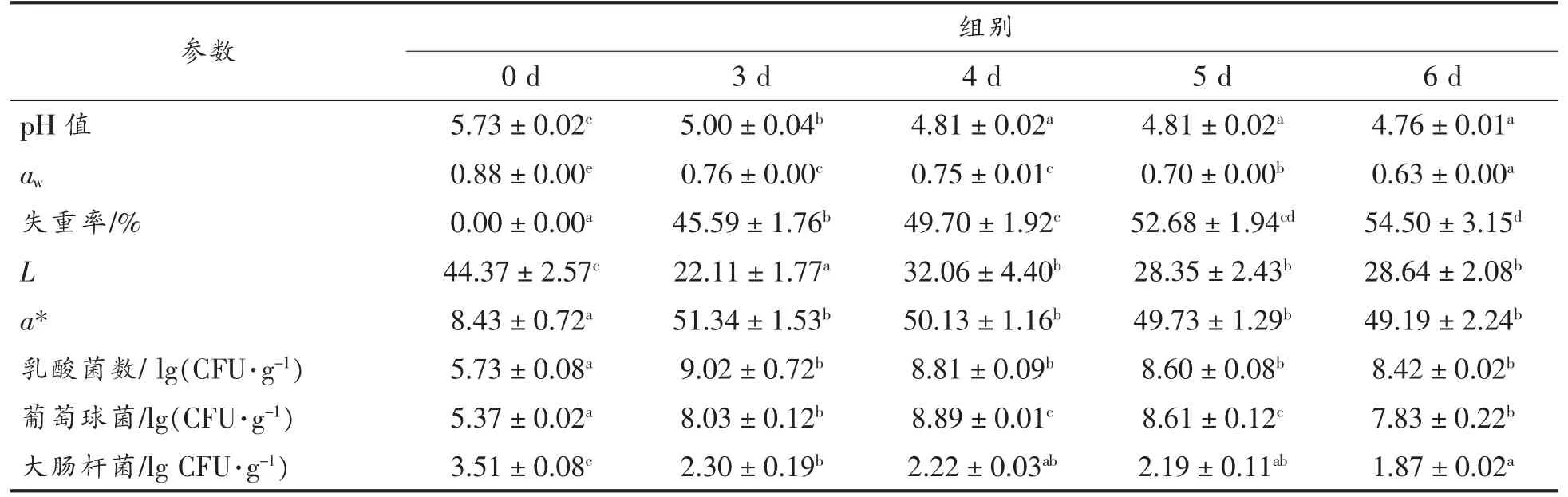
表2 不同成熟时间对羊肉香肠理化品质的影响Table 2 Effects of different ripening time on physico-chemical quality of fermented mutton sausages
发酵香肠的色泽直接影响消费者对产品购买欲望。从表2 可看出,香肠亮度L 呈下降趋势,成熟3~6 d 显著低于成熟第0 天(P<0.05),这可能是与成熟过程中香肠水分不断蒸发,减弱香肠表面对光的反射作用所致,因而随着水分活度下降香肠亮度值降低。此结果与Johansson 等[17]研究结果一致。成熟过程中香肠的红度值显著高于成熟初期(P<0.05),这可能与低pH 值促使亚硝酸盐与肌红蛋白结合形成亚硝基肌红蛋白有关,从而提高了香肠红度色泽(a*)[19]。José 等[20]研究结果表明:不同成熟时间对发酵香肠红度值有重要影响,且Essid 等[21]和Casquete 等[22]研究发现羊肉发酵香肠的色泽与成熟时间呈正相关关系。
由表2 可知,发酵香肠成熟过程中乳酸菌和葡萄球菌均呈先上升后缓慢下降的变化趋势,分析原因可能是随着成熟时间的延长,aw、失重率不断下降,水分含量不断降低,抑制微生物菌株的生长繁殖,从而导致乳酸菌和葡萄球菌数量下降。成熟过程中肠杆菌不断下降,其中0~3 d 下降速率最快,4~6 d 肠杆菌下降速率变缓,仍显著高于(P<0.05)成熟初期,说明成熟时间的延长有效控制大肠杆菌的生长,此研究结果与朱迎春等[7]的研究结果一致。在成熟结束时,大肠杆菌数为1.87 lg(CFU/g)<3.01 lg(CFU/g),确保证了发酵香肠的微生物安全性。
2.2 成熟时间对发酵羊肉香肠脂肪酸组成的影响
游离脂肪酸是发酵香肠中风味物质或其重要的前体物,在成熟过程中一定量游离脂肪酸的释放对发酵香肠特有风味的形成起到非常重要的作用[23]。发酵香肠中添加的发酵剂与内源脂酶可将香肠中脂质分解为短链挥发性脂肪酸、醛、酯等物质,赋予发酵肉制品独特风味[9],还可促进饱和脂肪降解,加速单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA)的释放[24]。
羊肉发酵香肠游离脂肪酸含量变化见表3。在成熟过程中饱和脂肪酸、单不饱和脂肪酸、多不饱和脂肪酸含量均呈上升趋势,说明脂肪酸的生成速度大于分解速度。饱和脂肪酸含量(SFA)>单不饱和脂肪酸含量(MUFA)>多不饱和脂肪酸含量(PUFA),与Essid 等[21]研究结果一致。在成熟初期,游离脂肪酸的含量非常低,仅495.86 mg/100 g,主要是饱和脂肪酸,占总量的53.95%。成熟结束时,游离脂肪酸含量达到1 312.82 mg/100 g,显著高于成熟初期(P<0.05)。对比各脂肪酸占总脂肪酸含量,发现饱和脂肪酸(SFA)从53.95%降到49.06%,单不饱和脂肪酸(MUFA)从24.53%升到33.56%,有较大的提高,表明单不饱和脂肪酸含量所占总脂肪酸的比例随着成熟时间的延长呈现增加趋势。多不饱和脂肪酸的含量(PUFA)从21.51%降到17.38%,说明成熟过程中主要是多不饱和脂肪酸(PUFA)发生氧化降解,生成如烯醛、二烯醛及酮类等羰基类特色风味物质[25]。
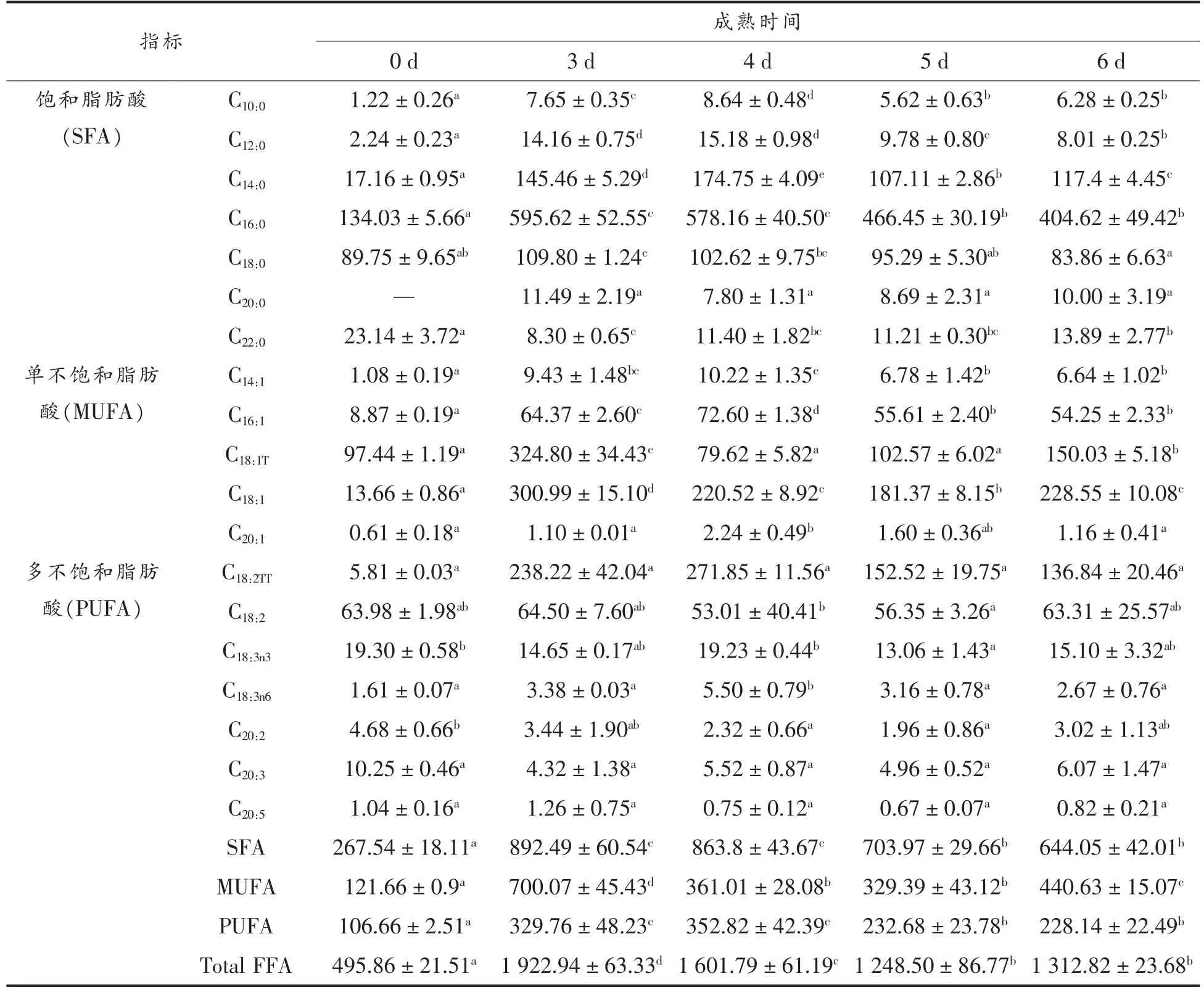
表3 不同成熟时间对羊肉香肠游离脂肪酸组成的影响Table 3 Effects of different ripening time on the composition of free fatty acids in the fermented mutton sausages
观察表3 中发酵香肠游离脂肪酸的种类,可以看出肉豆蔻酸、油酸、棕榈酸、硬脂酸、亚油酸和亚麻酸6 种脂肪酸总和占总脂肪酸的85.80%,是羊肉发酵香肠中游离脂肪酸的主要成分。SFA 上升趋势显著,在成熟第3 天达到最高(892.49 mg/100 g),成熟干燥结束时增加了376.51 mg/100 g,其中棕榈酸和肉豆蔻酸增加最多,分别增加了274.59 mg/100 g 和100.24 mg/100 g,是影响SFA的主要脂肪酸;MUFA 在成熟第3 天达到最高(700.07 mg/100 g),干燥成熟结束时增加了318.97 mg/100 g,其中油酸增加最多,为214.89 mg/100 g,可能是由于油酸主要位于甘油三酯的sn-1 和sn-3 位置有关,易被发酵剂及内源脂肪酶水解而释放[26]。PUFA 在成熟第4 天达到最高值(329.76 mg/100 g)后呈缓慢下降趋势,成熟结束时增加了121.48 mg/100 g。综上所述,成熟3~4 d 是香肠各脂肪酸积累的重要阶段。

表4 不同成熟时间对羊肉香肠风味物质的影响(峰面积×107/g)Table 4 Effects of different ripening time on the flavor composition(expressed as AU×107/g)in fermented mutton sausages

(续表4)
2.3 成熟时间对发酵羊肉香肠风味物质的影响
风味是发酵香肠重要属性之一。不同成熟时间香肠挥发性物质的变化情况见表4,共鉴定出6 类53 种挥发性风味化合物,包括醛类17 种、酯类12 种、醇类10 种、酸类7 种、酮类5 种、烷类1 种。这些风味物质主要是由脂质氧化分解、蛋白质降解代谢以及碳水化合物的分解,如Strecker降解,美拉德反应等途径所形成[27]。
有较低阈值的醛类风味物质对肉制品具有重要贡献作用[28]。由表4 可知,香肠中检出醛类化合物种类及含量最多,从成熟初期7 种增到成熟结束时的16 种,相对含量从3.65%增至14.40%。香肠中含量最高的3 种醛是己醛、庚醛、壬醛,是香肠主要的挥发性风味化合物。其中己醛具有青草味,在成熟3 d 时相对含量最高,达16.42%;庚醛、壬醛呈脂香气味和花香,在成熟4 d 时相对含量最高分别达33.74%,23.89%,且随着成熟时间的延长,三者含量呈递减趋势(P<0.05)。香肠中主要芳香醛为苯甲醛,在成熟3 d 时含量达到最大值,且在成熟过程中检出的具有水果香味的3-甲基丁醛,也在成熟3 d 时含量达到最大值。从总含量上看,醛类物质呈先上升后下降趋势,成熟3 d 时含量达到最高值,显著高于其它时间的(P<0.05)。综上得出成熟3 d 是醛类风味物质积累的最佳时期。
醇类相比醛类,阈值较高,对香肠风味影响较小,然而作为醛酮类化合物的前体物质,对风味形成具有加和作用[29]。对风味贡献较大的醇类主要是戊醇具有油脂气味,辛醇带有柑橘气味,苯乙醇具有清甜的玫瑰样花香,1-辛烯-3-醇具有浓郁蘑菇香味[30]。在成熟4 d 醇类物质种类最多12 种,相对含量最高达39.71%,显著高于其它各成熟时间的(P<0.05)。这说明成熟4 d 是醇类风味物质积累的最佳时期。
酯类物质是发酵香肠风味形成所必需的物质,在成熟初期检出5 种,成熟结束时检出11 种,相对含量从13.56%增到25.28%,其中成熟4 d 的相对含量最高达32.28%,显著高于其它各成熟时间的(P<0.05)。这说明成熟时间的延长有助于酯类物质的积累,且成熟第4 天酯类物质积累最多。对风味贡献较大的是具有果香味和奶油香味乙酯类物质,例如己酸乙酯及辛酸乙酯,它们构成了发酵香肠特有的酯香味[31]。
酮类化合物是脂肪氧化的另一产物,阈值低可赋予香肠干酪水果香味、花香味。成熟0 d 仅检出2-甲基-3-庚酮,成熟结束时检出4 种酮类。在成熟第3 天酮类物质相对含量最高达33.78%,与其它各组差异显著(P<0.05),其中含量最高的是3-羟基-2-丁酮,赋予香肠清香奶香味[32]。这说明成熟第3 天是酮类物积累的关键时间。
酸类化合物主要来自脂肪水解氧化过程中产生的小分子脂肪酸,从成熟初期3 种增到成熟结束时的6 种,在成熟第3 天含量达到最高值。其中乙酸含量最高,赋予香肠酸醋味;异戊酸次之赋予香肠橘样的香味[33]。烷烃类阈值较高,仅检出十九烷1 种,对香肠整体风味影响较小。
延长成熟时间,可使碳水化合物、蛋白质和脂肪充分降解氧化,累积更多的重要风味物质,而过度氧化分解,会产生不良滋味与气味。选择合适的成熟时间对香肠风味和口感起决定性作用。综合考虑,成熟3~4 d 为发酵香肠风味积累的最佳时间。
3 结论
研究了不同成熟时间对羊肉发酵香肠食用品质及风味的影响,结果表明:随着成熟时间的延长发酵香肠的pH 值不断降低,成熟0~4 d 内下降速率最快,成熟结束时pH 降到4.75<5.3(处于安全食用范围)。aw急剧下降,成熟结束时达到0.75<0.9,能有效抑制杂菌的生长,提高产品的食用安全性。成熟3~4 d 香肠的红度值达到最大值,改善了香肠色泽。香肠较低的pH 和aw使得大肠杆菌的生长受到抑制,在成熟过程中不断下降,确保了香肠微生物的安全性。成熟过程中游离脂肪酸的含量显著增加(P<0.05),成熟3~4 d 时含量达到最高值;同时风味物质含量也显著增加(P<0.05),成熟3~4 d 风味物质种类及含量达到最高值,说明此时是发酵香肠最佳成熟时间。
