基于网络药理学当归黄柏治疗慢性前列腺炎的作用机制研究❋
2021-03-06刘胜京张继伟杜冠潮高庆和
刘胜京,郭 军,王 福,张继伟,晏 斌,杜冠潮,高庆和△
(1. 中国中医科学院西苑医院,北京 100091; 2. 北京中医药大学,北京 100029)
慢性前列腺炎(chronic prostatitis,CP)是临床常见病、多发病。据报道,35%~50%的男性曾受到CP症状的影响[1]。国外1项10600人的调查显示,CP的发病率为8.2%[2]。国内关于CP的流行病学研究因调查方法及调查人群的不同,发病率差异较大,处于6%~-32.9%之间,高于国外的文献报道[3]。随着环境、社会及生活方式的改变,CP发病率有逐年增高趋势[2]。目前西医治疗CP主要以抗生素、α受体阻滞剂、非甾体抗炎药为主,多为经验性治疗,治疗效果不佳,尚无治疗CP的有效药物[4]。CP属于中医学“精浊”“淋浊”“白淫”等范畴,临床实践证明中医药是治疗CP的重要方法之一。
本研究前期通过临床经验总结及数据挖掘中国中医科学院首席研究员、中国中医科学院西苑医院男科主任郭军教授治疗CP的用药处方规律,发现当归-黄柏为治疗CP的核心药对,且郭军教授基于“疮疡内消法”以当归和黄柏为君药,拟定方剂归黄方,临床多获良效[5]。郭军教授认为,当归质润性动,活血行滞止痛;黄柏性寒润降,清热泻火燥湿,此药对活血、清湿热之功著,清热而不伤阴,活血以消瘀滞,对湿热瘀滞型CP有较好效果。现代药理学研究表明,当归提取物具有镇痛、抗炎、抗凝作用,并可提高热刺激致痛的痛阈[6]。黄柏抑制金黄色葡萄球菌效果较强,有抗炎、免疫调节、抗氧化作用[7]。目前关于CP的机制研究主要集中在炎症免疫应答调节机制,其中对于导致炎症反应的基因及作用机制研究日益受到重视[8]。
网络药理学是一种基于系统生物学理论,对药物有效成分进行多靶点、多途径生物系统网络分析的方法[9]。本研究通过网络药理学探讨当归-黄柏多成分、多靶点、多途径的作用特点,预测当归-黄柏治疗CP的可能作用机制,为进一步分析其活性成分和作用机制提供理论依据。
1 材料与方法
1.1 当归-黄柏活性成分及靶点的筛选
应用中药系统药理学分析平台(TCMSP)(http://tcmspw.com/)检索当归、黄柏的所有活性成分,以口服生物利用度(oral bioavailability,OB)≥30%且类药性(drug-likeness,DL)≥0.18作为筛选条件,并在中国知网及PubMed数据库中查阅当归、黄柏目前已研究的主要相关活性成分进行补充。
根据已经得到的化合物,通过TCMSP数据库对其成分进行打靶提取,对于补充得到的化合物,首先在PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)中获取化合物对应的SMILES结构,并录入pharmmapper数据库(http://www.lilab-ecust.cn/pharmmapper/)进行靶点垂钓,汇总去重后得到当归-黄柏的最终预测靶点,并在Uniprot数据库(https://www.uniprot.org/)中将种属选择“Homo sapiens”对靶点进行标准化处理。
1.2 CP的疾病靶点
通过Genecards数据库(http://www.genecards.org/)、OMIM数据库(https://www.omim.org/)检索CP的疾病靶点,检索词为“chronic prostatitis”,汇总整理后去重得到CP对应靶点。
1.3 药物与疾病共同靶点筛选
应用R语言软件(https://www.r-project.org/)对校正后的药物靶点及疾病靶点进行取交集处理,得到药物与疾病的共同靶点。
1.4 可视化网络图构建
将药物活性成分、药物和疾病共同靶点的节点文件等导入Cytoscape 3.5.1软件,构建药物-活性成分-靶点-疾病的可视化网络图。通过拓扑网络展示当归-黄柏活性成分与CP间相互作用的关系。
1.5 蛋白互作网络构建
应用STRING平台(https://string-db.org/)构建(protein-protein interaction,PPI)网络,将最低相互阈值设为0.95。应用R语言软件将出现频次前20的基因绘制条形图。
1.6 GO分析和KEGG通路富集分析
利用David网站(https://david.ncifcrf.gov/),将中药调控网络中的基因symbol转换为基因ID。利用R语言软件通过基因功能注释(gene ontology,GO) 和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)对核心靶标进行基因功能及通路的注释分析,并将结果以条形图或气泡图形式呈现,根据核心通路富集程度探究当归、黄柏治疗CP可能的作用机制。以上R包的下载通过R3.6.1以及Bioconductor(https://www.bioconductor.org/)。
2 结果
2.1 当归、黄柏活性成分及靶点
通过TCMSP数据库以OB≥30%且DL≥0.18为标准筛选当归、黄柏的活性成分,去重后共得到38个活性成分。通过检索当归与黄柏药理学研究的相关文献对所得成分进行分析,发现当归中的Ligustilide、Butylidenephthalide、glucuronic acid、galacturonic acid、Ferulic Acid、senkyunolide、vanillic acid、neocnidilide,经多篇文献研究发现具有较高的生物学活性,故将其纳入潜在活性成分进行分析[6, 10]。通过TCMSP及pharmmapper数据库对所得活性成分进行靶点预测,去重后通过Uniprot数据库进行校正。
最终筛选后共得到当归-黄柏的46个活性成分、212个校正靶点,其中当归主要包括挥发油类、有机酸类、甾醇类、内酯类等共10个活性成分,作用靶点140个;黄柏主要包括生物碱类、甾醇类、黄酮类等共37个活性成分,作用靶点98个;共同活性成分1个,为β-谷甾醇(beta-sitosterol)。
2.2 CP的疾病靶点筛选
通过检索GeneCards、OMIM数据库得到CP的疾病靶点,分别筛选到7376个和23个靶点,经过去重共得到7397个CP的疾病治疗靶点。
2.3 药物与疾病共同靶点筛选
应用R语言软件对校正后的药物靶点及疾病靶点取并集获得共同靶点,共同靶点数为159个。
2.4 可视化网络图构建
将药物活性成分、药物和疾病共同靶点等导入Cytoscape 3.5.1软件,构建药物-活性成分-靶点-疾病的可视化网络图共包括191个节点,其中靶点159个,活性成分30个,疾病和药物各1个。图中橙色代表药物,绿色代表活性成分,蓝色代表药物与疾病相互作用靶点,墨绿色代表疾病,相连的边表示药物、成分与疾病靶点的互相作用关系(见图1)。

图1 药物-活性成分-靶点-疾病互作网络
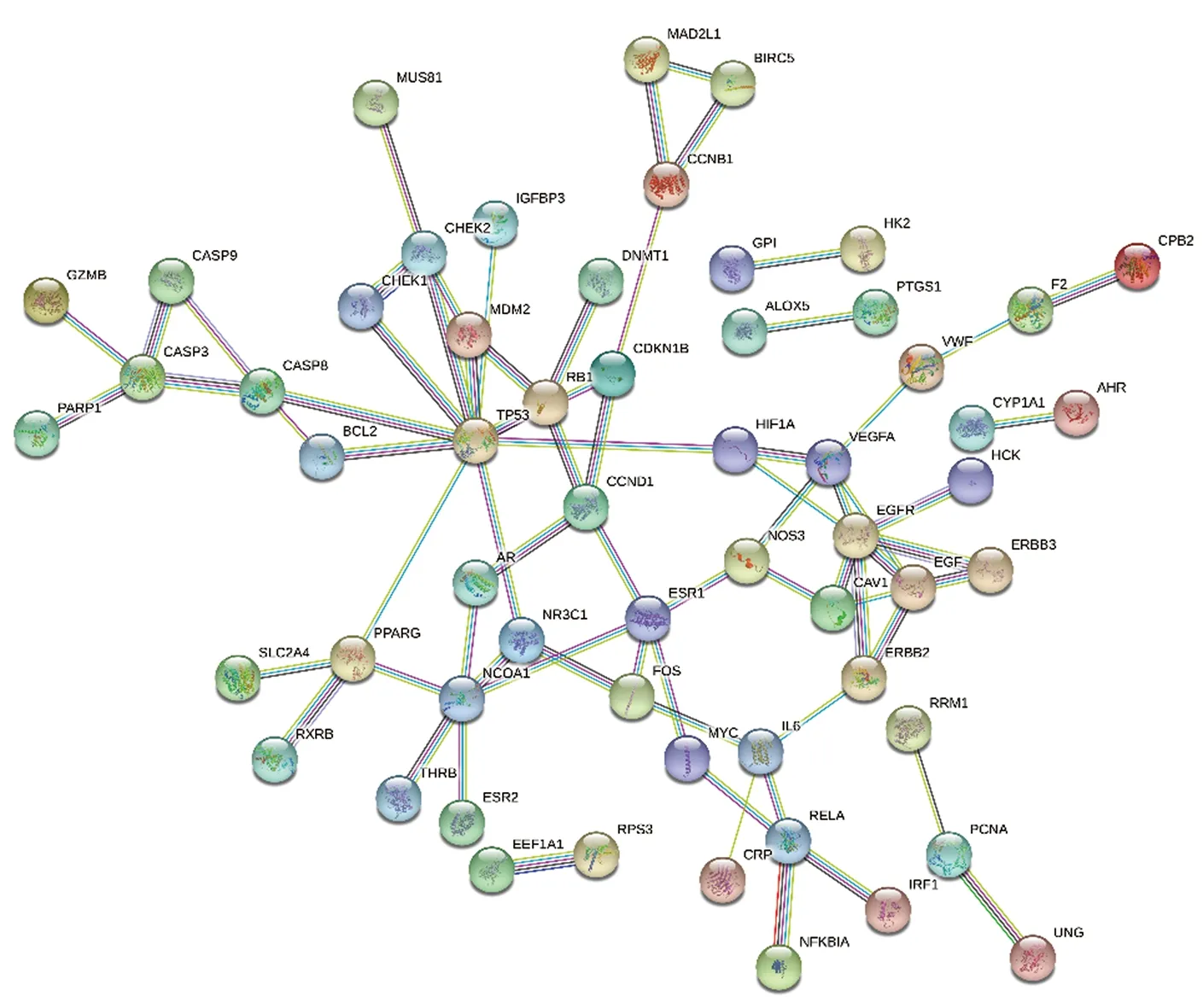
图2 共同靶点蛋白互作网络
2.5 PPI互作网络构建
将共同靶点输入STRING平台,构建共同靶点PPI互作网络,选取置信度高于0.95的数据得到PPI网络图(见图2)。应用R语言软件统计出现频次前20的靶点并绘制条形图(见图3)。通过PPI互作网络分析可见蛋白互作频次较高的有肿瘤抑制基因(TP53)、表皮生长因子受体(EGFR、ESR1、EGF)、核受体辅激活蛋白1(NCOA1)、特异性周期蛋白D1(CCND1)、白介素6(IL6)、凋亡信号分子(CASP3,CASP8)等,是整个网络的节点蛋白。

图3 当归-黄柏治疗CP核心基因
2.6 GO分析和KEGG通路富集分析
对所获得的当归-黄柏差异基因进行富集分析,从生物途径(biology process,BP)、细胞定位(cellular component,CC)及分子功能(molecular function,MF)对基因进行注释和分类,得到基因富集情况的柱状图(见图4)。对共同靶点进行KEGG通路富集分析,得到通路富集的气泡图(见图5)。在柱状图及气泡图中,柱状图高度/圆圈的大小代表富集的数目,颜色代表富集的显著程度,P值越小显著程度越高、颜色越红。排除广泛通路后,选出排名前10的信号通路进行分析(见表1)。经文献检索结合前期研究,最终选出3条与当归-黄柏治疗CP最可能相关的核心信号通路,分析其核心基因数目、名称及来源(见表2)。
3 讨论
本研究经初步筛选得到当归-黄柏46个活性成分,其中当归的主要活性成分为藁本内酯(ligustilide)。药理学研究证实,其能抑制多种炎性因子表达抗炎作用,实验证明藁本内酯对CP模型大鼠的前列腺病理和痛觉敏感性有改善作用[11-12]。黄柏活性成分中口服利用度最高的化合物为盐酸巴马汀(palmatine,OB=64.6%),药理学研究证实,具有抗细菌、病毒、真菌感染以及抗癌作用[13]。活性成分中类药性较高的化合物为甲基黄连碱(Worenine,DL=0.87)和黄连碱(coptisine,DL=0.86),具有抗炎、抗氧化的作用[14]。《神农本草经》谓当归“诸恶疮疡,金创,煮饮之”[15],《本草纲目》谓黄柏“口舌生疮,用黄柏含之良”“两股生疮,其汁淋沥,用黄柏末掺之,立愈”[16]。本草古籍所载与实验结果在一定程度上有吻合之处,具有一定参考价值。除度值较高的靶点,当归-黄柏药对还有许多成分、靶点与其他疾病有关,值得进一步挖掘。

表1 当归-黄柏靶点通路富集结果比较(前10)
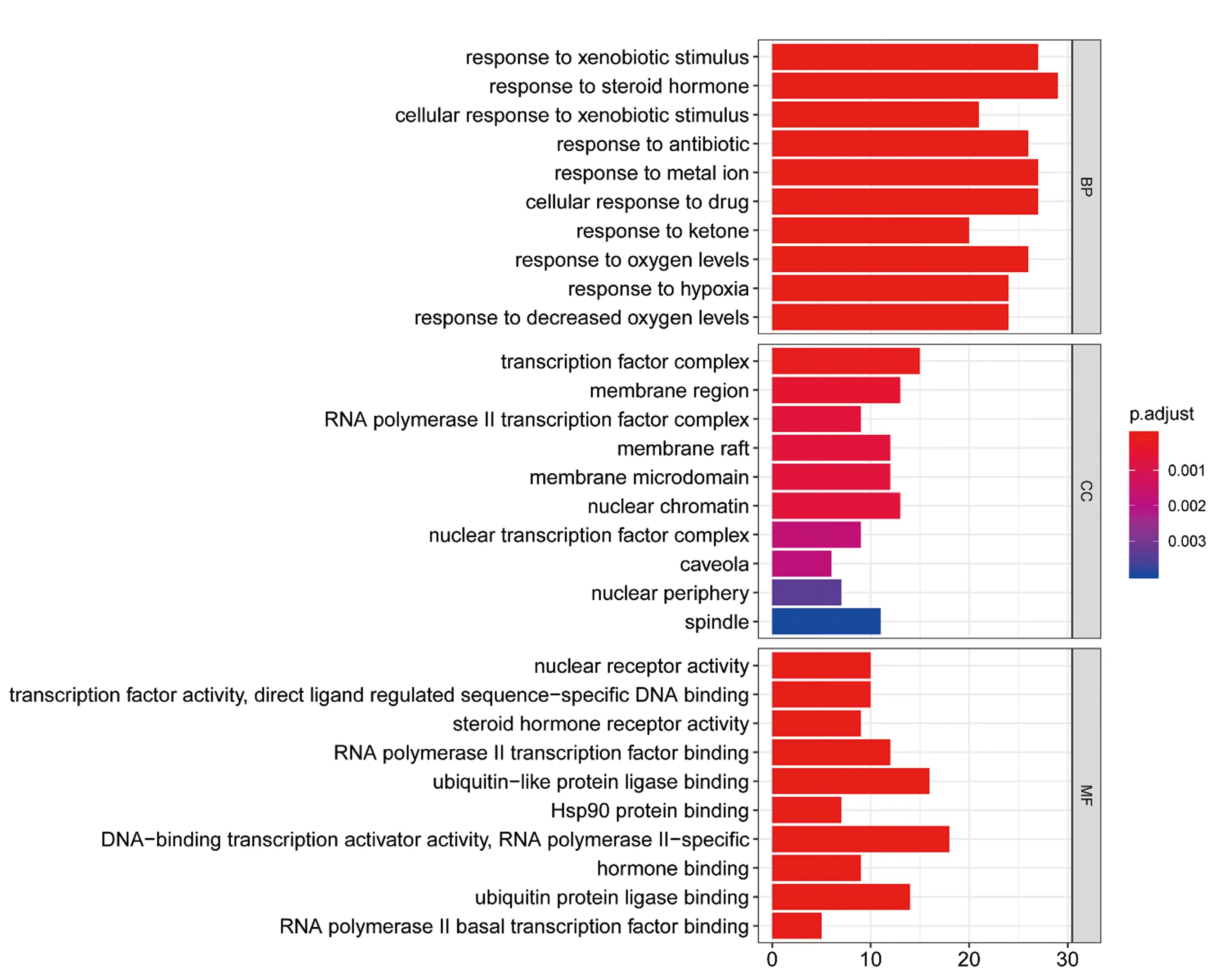
图4 当归-黄柏活性成分治疗CP的关键靶点GO富集分析柱状图

图5 KEGG 通路富集气泡图

表2 核心信号通路靶点富集比较
根据筛选出的46个活性成分,预测相关靶点212个,通过与疾病靶点取交集处理发现,两者的共同靶点有159个,说明当归-黄柏治疗CP的覆盖范围较广,药物靶向性较好。通过PPI网络分析,得到蛋白互作频次较高的基因,主要包括癌症相关基因(TP53)、表皮生长因子(EGFR,ESR1,EGF)、炎症基因(IL-6)、凋亡信号分子(CASP3,CASP8)等。目前研究表明,CP中表皮生长因子EGFR、EGF表达情况明显高于正常前列腺组织,与CP的发病呈正相关[17-18]。细胞因子IL-6能够激活淋巴细胞分化,增强自然杀伤细胞的作用,且CP患者精浆中IL-6变化水平可作为CP的1项预测指标,对CP的诊断具有一定价值[19]。
基因功能注释分析结果显示,差异基因最可能相关的生物途径主要涉及异源生物刺激反应、类固醇激素反应、抗生素反应、氧化相关反应等;分子功能主要涉及膜筏、膜区、膜微区、突触前膜和突触后膜成分、转录因子复合体、核染色质等,细胞定位主要涉及DNA结合转录激活、泛素样蛋白连接酶结合、转录因子活性、类固醇激素受体活性等。
通路富集分析结果提示,当归-黄柏可能涉及表1中多条信号通路,其中与表2中的PI3K-Akt信号通路(22个靶点)、MAPK信号通路(15个靶点)、HIF-1信号通路(13个靶点)作用关系相对更为密切。对此3条信号通路分析显示,在与治疗CP相关的机制中,当归-黄柏的多成分均参与作用,体现了中药多途径的治疗特点,也体现了当归-黄柏药对治疗的协同作用。PI3K-Akt信号通路参与调控细胞的增殖、分化凋亡等,与炎症、肿瘤和生殖系统疾病密切相关。通过抑制PI3K-Akt信号传导通路的活化以及上下游调质的释放,可减轻炎症痛及神经病理性疼痛[20-21]。MAPK信号通路是介导细胞内外信号传导的重要系统,其家族信号通路包括P38MAPK、ERKs、JNK/SAPK、ERK5/BMK1,参与细胞的增殖、分化、凋亡等过程,并与炎症、肿瘤等密切相关[22-23]。其中p38 MAPK信号通路与炎症、应激反应的调控更为密切,被认为是细胞信息传递的交汇点和共同通路[24]。目前有实验及研究表明,p38MAPK通路抑制会使大鼠机械和热痛的痛阈下降,并能调控IL-6、TNF-α等多种细胞因子抑制炎症细胞的聚集或活化[25-26]。当归-黄柏可能涉及调控PI3K-Akt、MAPK、HIF-1等信号通路,通过调控细胞增殖与凋亡、氧化与抗氧化等生物学过程治疗CP。
本研究通过网络药理学的分析方法,筛选当归-黄柏药对的活性成分及作用靶点,构建网络图进行分析,并进一步预测当归-黄柏治疗CP的关键调控靶点与相关通路,体现当归-黄柏对CP多成分、多靶点、多途径的治疗特点,为CP的治疗提供思路借鉴,为进一步实验验证其作用机制提供理论依据。
