Ang-1/Tie-2信号通路与缺血性脑卒中的相关性研究述评❋
2021-03-06钱海兵
王 延,钱海兵
(贵州中医药大学,贵阳 550025)
脑卒中(Stroke)也称“中风”,其中超过80%的患者为缺血性脑卒中(cerebral ischemic stroke, CIS)[1]。CIS又称为“脑梗死”,是指颅内血流障碍导致局限性脑组织损害进而出现相应神经功能缺损的疾病,是我国第一大致死性、国外第二大致死性疾病[2]。目前治疗急性CIS的有效治疗措施是采用rt-PA静脉溶栓,但治疗时间窗仅4.5 h且费用高昂,因此能通过其获益者小于3%[3-4]。即使rt-PA溶栓成功, 也导致患者出现颅内出血等治疗风险,并且CIS中有2/3患者会遗留不同程度的残疾[4],严重影响患者的愈后生活,也给家庭和社会带来难以承受的经济负担。因此, 探索多途径、多靶点的新治疗方案或研发安全有效的药物迫在眉睫。
在缺血早期刺激血管新生和抑制神经损伤,从而改善脑卒中后的功能恢复,是治疗CIS的重要措施。血管生成素-1和酪氨酸激酶受体-2(Angiopoietin-1/Tyrosine Kinase Receptor-2,Ang-1/Tie-2)通路是近年来新发现的一种除血管内皮生长因子(vascular endothelial growth factor,VEGF)以外的可用于介导血管生成的信号传导通路,广泛参与内皮细胞的活化、迁移、增殖和分化等过程,与血管生成、调控炎症及神经元保护和再生等生理病理过程密切相关[5-7]。近年来,关于Ang-1/Tie-2与CIS的相关研究逐渐丰富,因此本文就Ang-1/Tie-2与CIS相关性进行综述。
1 Ang-1/Tie-2的生物学特征
1.1 Ang-1的生物学特性
血管生成素(Angs)由分子量约为14.4 kD的123个氨基酸构成,包括Ang-1、Ang-2、Ang-3和Ang-4,且均作用于其特异性受体Tie-2[8],近年来对Ang-1和Ang-2的研究较多。Ang家族主要在肝脏中合成,于上个世纪90年代被成功鉴定,是RNase超家族中惟一具有促血管生成能力的成员,也是目前已知的所有血管生成因子中独具核糖核酸酶活性的因子,广泛分布于正常血浆及实体肿瘤组织中[8-9]。Ang-1是一种分泌蛋白、基因定位于8q22.3~q23,相对分子质量约75×103,全长498个氨基酸,含3个结构域,血管平滑肌细胞、管周细胞和肿瘤细胞是人Ang-1的主要来源[7,10]。
1.2 Tie-2的生物学特性
酪氨酸激酶受体-2(Tie-2)为跨膜蛋白质,由细胞外区、跨膜区、细胞内区组成,其配体是Ang,主要表达于内皮细胞和一些造血细胞[11]。Tie-2基因定位于9p21,全长约109×103bp,编码1124个氨基酸[11-12]。
2 Ang-1/Tie-2信号通路传导途径
Ang-1和Ang-2具有高度同源性,都可以结合受体Tie-2,但是只有Ang-1可以触发受体Tie-2的自磷酸化,进而激活受体。Ang-2并不触发Tie-2受体的自磷酸化,而是与Ang-1竞争,并作为Ang-1/Tie-2信号传导系统的抑制剂[13-17]。
Ang-1利用羧基端纤维蛋白原样结构域与Tie-2上细胞外的3个免疫球蛋白结构域中的第2个结合[18],“聚集”Tie-2单体使之发生二聚化,促进Tie-2细胞内区域的交叉磷酸化(如图1)。被激活的Tie-2继续诱导激活磷脂酰肌醇-3-激酶/丝氨酸-苏氨酸蛋白激酶B(phosphatidylinositol 3-kinase microtubule/serine/threonine kinase,PI3K/Akt)信号通路,即Tie-2通过PI3K的p85亚基诱发PI3K磷酸化,PI3K再激活Akt从而磷酸化能抑制Ang-2释放的FOXO-1;激活的Akt也可以上调生存素(Survivin)的表达,增加细胞生存力;Akt激活后还可以抑制凋亡蛋白的前体,如BAD、caspse-9。通过以上各方面的作用,从而抑制血管内皮细胞凋亡,参与血管生成的调节[7-9](如图2)。

图1 Ang-1激活Tie-2示意图

图2 Ang-1/Tie-2信号通路传导示意图
3 Ang-1/Tie-2信号通路在CIS中的作用
3.1 促使血管再生、重塑及成熟
血管生成失败和侧枝血管生长不足是CIS等血管性疾病愈后不佳的主要问题,挽救大脑内皮细胞免于细胞凋亡和刺激血管增殖,降低脑梗死面积是脑缺血性疾病的治疗思路。血管生成与神经发生有直接关系,也是新生神经元生存的必须条件[19],有助于改善CIS的愈后。调节血管再生的关键信号主要有血管内皮生长因子及其受体VEGF/VEGFR信号和Ang/Tie-2信号。在脑缺血后的血管再生过程中,Ang-2会破坏血管稳定性,促使血管内皮细胞迁移,诱导血管生成;Ang-1则通过与受体Tie-2结合,使Tie-2发生磷酸化,激活其下游的PI3K/Akt信号通路。一方面促使内皮细胞形成血管样结构,另一方面聚集内皮周围支持细胞,两者共同完成血管的重塑和成熟。有研究发现[20],大鼠在脑缺血再灌注损伤后其脑微血管生成可能与Ang/Tie-2系统的表达密切相关。Meng等[21]实验证明,在缺血脑组织中,Ang-1能通过内皮细胞的増殖促进微血管生成。Gandin等[22]在研究MLC901时发现,其可以通过调节Ang-1、Ang-2来刺激血管的生成与重塑。
3.2 抑制外周血管及脑血管的通透性
CIS常伴有血脑屏障(blood-brain barrier,BBB)的破坏:基质金属蛋白酶-2(matrix metalloprotein-2, MMP-2)在脑组织缺血早期表达增多,促使闭合蛋白和咬合蛋白的降解;而后MMP-9在脑组织缺血后期表达上调,使闭锁小带蛋白-1(zonulaoccluden-1, ZO-1)表达减少、肌动蛋白重组,共同导致内皮细胞间的连接性被破坏[23]。内皮细胞完整性的破坏,导致血管通透性增加,会进一步引起脑部水肿和出血,加重缺血状况。然而,Ang-1/Tie-2信号可抑制外周血管及脑血管的血管通透性,其机制是Ang-1激活Tie-2,活化的Tie-2迁移到细胞连接处,通过肌动蛋白细胞骨架的重组和内皮间连接处的血管内皮钙黏蛋白(VE-cadherin)的积累来实现细胞骨架的重建。Ang-1/Tie-2信号通过PI3K和NADPH氧化酶亚基p47phox来激活Rac1,Rac1通过骨架蛋白IQGAP1以活性GTP结合的形式(GTP-Rac1)稳定下来进而发挥作用,同时GTP-Rac1再通过GTP酶信号传感器p190RhoGAP对RhoA发出抑制信号[15]。其中,Rac1是肌动蛋白细胞骨架重组的信号,降低血管通透性;RhoA可调节微丝细胞骨架,破坏血管稳定性,增加血管通透性[24]。因此,Ang-1/Tie-2信号通过激活Rac1,抑制RhoA实现VE-cadherin的聚集,促使微血管床形成有效屏障(如图3)。Zhang等[25]研究也发现,Ang-1可降低小鼠脑卒中后脑血管的渗漏和缺血损伤体积。Poornima等[26]实验证明,在糖尿病小鼠中,Ang-1的降低使脑血管的通透性增加,与脑卒中后BBB的破坏及脑出血增加有关。
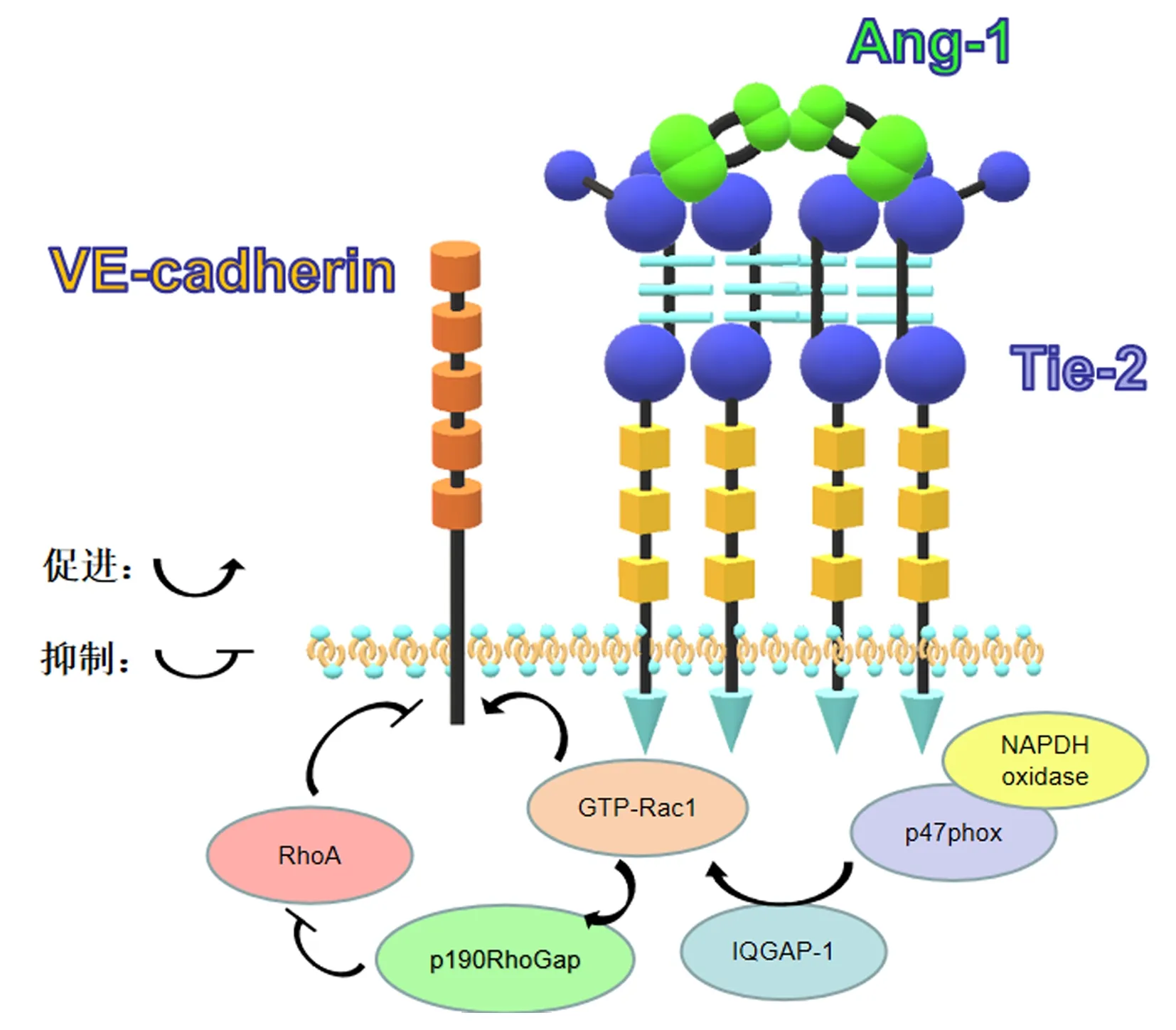
图3 Ang-1/Tie-2信号激活VE-cadherin过程示意图
3.3 减轻炎症介导的神经损伤
脑缺血发生后,内源小胶质细胞的激活以及外周血白细胞浸润脑内实质等因素会产生明显的炎性反应,加重血管和神经的损伤。其中,胶质细胞、神经元、大脑内皮细胞等细胞内的炎症转录因子NF-κB被激活后,会调控肿瘤坏死因子-α(TNF-α)、细胞间黏附分子-1(ICAM-1)、白细胞介素-1β(IL-1β)等炎症因子的大量释放[23]。研究证明[27],体内存在的Ang-1能诱导Tie-2自磷酸化,从而抑制NF-κB,表现出抗炎的特点。加之Ang-1/Tie-2信号通路还能通过稳定细胞骨架来抑制血管通透性,减少渗出,可协同达到抑制炎症的效果。但在炎症应激期间,细胞表面的Tie-2或细胞外Ang-1数量减少、细胞外Ang-2数量增加等各种因素共同作用导致Tie-2信号减弱,未磷酸化的Tie-2无法对转录因子Foxo1产生有效抑制,过量的Foxo1诱导Ang-2迅速释放,从而加重血管炎症的同时也增加血管渗漏,形成炎症的有害循环[15,28]。Yan等[29]证明,Ang-1可显著降低体外培养脑内皮细胞炎症因子RAGE的表达,起到抗炎作用。
3.4 抑制神经细胞损伤坏死及促进神经元新生
CIS发生后,缺血脑组织中的葡萄糖供给严重减少,自由基产生增多,因此无法产生足够的ATP用于神经细胞的正常活动,神经细胞发生损伤坏死。研究证明[30],CIS下诱导的血管生成能促进脑卒中后神经的发生并增强其功能。Ang-1/Tie-2信号通路则参与CIS中微血管及神经的形成。Ang-1能通过内皮细胞的増殖促进微血管生成,同时能维持BBB的完整性,挽救缺血半暗带濒死细胞,修复缺血区神经元损伤,提升神经元的功能保护、抑制神经细胞的凋亡[30]。半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)被认为是细胞凋亡的核心因素[31],在CIS情况下,Ang-1/Tie-2信号通路能抑制Caspase-3的活化,避免神经细胞在缺血缺氧环境下发生损伤坏死,保护缺血半暗带的濒死神经元。研究显示[26],在T1DM大鼠脑卒中后,通过Ang-1/Tie-2的表达可减少神经炎症和抑制BBB渗漏,在一定程度上抑制炎症介导的神经细胞损伤。对他汀类药物如辛伐他汀的研究也证明,其可以通过诱导Ang-1/Tie-2表达,增加磷酸化Tie-2的活性,而在CIS发生后具有神经保护作用[32]。
4 中药通过干预Ang-1/Tie-2信号通路对CIS的影响
传统中医药疗法治疗CIS疾病在我国已有悠久的历史,充分利用中药资源研制以Ang-1/Tie-2信号通路为靶点的CIS药物有着巨大的应用前景和重要临床意义。临床治疗CIS常用经方补阳还五汤,可增加并维持内源性Ang-1的表达,促进缺血区脑组织的微血管生成[33]。丹龙醒脑方、通心络保护大脑缺血的作用机制,亦与上调Ang-1的表达进而促进血管新生有关[34-35]。源于中药的活性单体三七三醇皂苷可上调Ang-1/Tie-2的表达,促进内皮细胞增殖,使MCAO大鼠脑缺血侧的微血管密度增加,从而减轻缺血脑组织的损伤[8]。Zhou[36]等实验数据显示,电针刺激足三里诱导的Ang-1上调而发挥的血管生成作用是脑卒中神经保护的机制之一。
5 结语
Ang-1/Tie-2信号通路在CIS后促进脑血管生成、抑制炎症反应、保护神经元等方面发挥着积极作用,Ang-1/Tie-2是否能延长CIS的治疗时间窗虽有待实验证明,但其对CIS多方面的积极作用可发挥协同效应,从而达到更好的治疗效果已得到部分证实。探讨Ang-1/Tie-2信号通路在CIS中的相关机制,深入了解Ang-1/Tie-2信号通路在CIS发展过程中的重要性,可为治疗CIS新策略的提出及以Ang-1/Tie-2信号通路为靶点的药物研发提供研究思路。我国中医药是一个巨大宝库,中药化学成分复杂,具有多层次、多靶点、多成分协同作用的特点和多途径治疗疾病的优势。中医药基于Ang-1/Tie-2信号通路干预CIS的治疗策略,势必会成为未来研究的新方向。
