基于中药整合药理学平台的参桃软肝方抗癌分子机制研究❋
2021-03-06刘展华庄振杰林丽珠黄慈辉孙治中李佳容
刘展华,庄振杰,林丽珠△,黄慈辉,孙治中,李佳容
(1. 广州中医药大学第一附属医院,广州 510405; 2. 广州中医药大学,广州 510405)
癌症已经成为严重影响人类生命健康的常见疾病,近年来其发病率和死亡率不断呈现出上升趋势。美国癌症学会发布的癌症全球流行病学报告[1]显示,2018年全球癌症发病例数1810万,其中有960万人因癌症疾病而死亡。在中国,癌症的发病形势同样严峻。国家癌症中心发布的《全国癌症统计报告2018版》[2]显示,2014年全国恶性肿瘤估计新发病例数380.4万例(男性211.4万例,女性169.0万例),平均每天超过1万人被确诊为癌症,每分钟有7个人被确诊为癌症,癌症日益严峻的发病形势给抗癌的治疗和预防带来了巨大的社会医疗压力。中医学源远流长,在长期的防治肿瘤疾病的实践中形成了基于中医理论指导的具有鲜明特色的中医肿瘤学科体系。中医在预防肿瘤发生以及抗癌治疗减毒增效、抗耐药、抑制复发转移等方面具有明显优势,已成为防治肿瘤疾病不可或缺的重要医疗措施[3]。
参桃软肝方是国医大师周岱翰教授治疗肝癌常用经验方,主方由山慈菇、桃仁、半枝莲、当归、人参、白术、甘草、仙鹤草8味药组成。本方以“健脾祛瘀法”组方,针对于癌邪“虚”与“瘀”的病理特点,功能健脾养肝、软坚消癥,其在培补脾气、滋养肝阴的同时,兼顾活血化瘀、软坚消癥,常用于肝癌的不同临床阶段,具有改善肝功能、缓解黄疸、腹水等临床症状等疗效。研究证实,本方联合肝癌的常规治疗,可提高中晚期原发性肝癌患者的疾病控制率,延长患者生存时间,同时保护患者肝功能,提高患者生存质量[4]。鉴于其良好的临床疗效,目前以本方为基础研制而成的参桃软肝胶囊[5-8]、参桃软肝丸[9-15]、参桃软肝片[16-17]等口服制剂已逐渐运用于临床及相关研究。但参桃软肝方抗癌分子机制尚未完全阐明,同时其治疗肝癌外适应证仍有待进一步探索。
中药方剂治疗疾病的过程中涉及多成分、多靶点的协同作用,单一的“药物-靶点-基因”的研究模式难以对中药方剂作用过程及机制形成系统正确的认识。针对目前存在研究模式的不足,相关学者借助中医药大数据联合计算机平台提出“整合药理学”的研究新模式。该模式立足于药物靶点预测、网络构建及功能分析等不同分析模块,是探索中药方剂化学物质实体与机体生命活动交互规律的一种新模式[18-19]。中药整合药理学计算平台(http: / /www.Tcmip.cn /) 是这一模式下的研究实践平台,该平台是以中医药大数据为基础,以人工智能、数据建模和数据挖掘、网络科学等学科方法和技术为支撑,构建的用于中药整合药理学分析的计算机平台[19]。该平台可运用于中药药效物质基础分析、中药有效成分分子机制探讨、中药质量控制、中药新药研发以及中药临床精准用药等方面,同时也可为揭示中医原创思维的科学价值和传承名医经验提供一定的技术支撑[20-21]。
本研究旨在基于中药整合药理学计算平台及相关数据库,运用整合药理学方法对参桃软肝方中潜在的抗癌主要成分、作用靶点以及信号通路进行分析,为进一步借助实验探究其确切的抗癌机制以及临床新药研发提供依据。
1 数据来源与方法
1.1 参桃软肝方的活性成分来源
在整合药理学平台(http:∥www.tcmip.cn /) 的中药成分数据库中,收集“山慈菇”“桃仁”“半枝莲”“当归”“人参”“白术”“甘草”“仙鹤草”8味中药的活性成分,建立参桃软肝方的化学成分数据库。
1.2 药物及疾病靶点预测与获取
整合药理学平台通过Open Babel提取参桃软肝方药物成分的化学分子指纹,并将其与Drug Bank中获FDA批准的抗癌药物指纹进行比对,平台利用Tanimoto系数对结果进行评分,选定评分>0.8的为相似性药物,将相似性药物靶点作为参桃软肝方的潜在作用靶点[22]。以“cancer”及“tumour”为疾病关键字在整合药理学平台的疾病靶点数据库中进行检索,检索结果为治疗“cancer”及“tumour”的疾病靶点,建立癌症靶点数据库,将数据库中的靶点结果作为参桃软肝方的候选靶点来源。
1.3 蛋白质-蛋白质相互作用网络构建与分析
整合药理学平台整合了In Act、DIP、MINT、HA蛋白互相作用、OPHID、PDZBase、Reactome、HPRD等8个现有蛋白相互作用网络数据库的信息,通过整合药物学平台的蛋白相互作用网络,构建参桃软肝方药物的潜在作用靶点-癌症疾病靶点的蛋白相互作用网络[22]。通过整合药理学平台的网络分析模块蛋白互相作用网络进行拓扑分析,以“节点连接度”的2倍中位数为卡值,选取中药靶点-疾病基因的关键节点(hubs);在此基础上,以“节点连接度”(degree)“节点紧密度”(closeness)“节点介度”(betweenness)的中位数为cutoff值,选取同时满足3个卡值的节点为参桃软肝方潜在靶点-癌症疾病靶点互作网络的关键靶点。
1.4 基因功能和通路分析
中药整合药理学平台整合了GO(Gene Ontology)(http: / /www. geneontology.org)和KEEG(Kyoto Encyclopedia of Genes and Genomes)(http: / /www.genome.jp /kegg) 两大基因组信息数据库,可对筛选出的作用靶点直接进行功能分析和通路富集分析。使用整合药理学平台中这2个模块分别对参桃软肝方潜在作用靶点、参桃软肝方抗癌治疗的关键靶点进行GO及KEGG分析[22],按P值大小分别获取具有明确条目ID的前20个GO及KEGG分析结果。
1.5 共同关键靶点通路分析
将获取的参桃软肝方与癌症疾病共同靶点,使用DAVID数据库(Version 6.8 https:∥david.ncifcrf.gov/)[23]进行KEGG通路分析,将获得结果中P值有统计学意义的前20个通路与参桃软肝方抗癌治疗的关键靶点KEGG通路分析结果进行匹配,并使用R软件(version 3.5.1)绘制维恩图。
2 结果
2.1 参桃软肝方化学成分靶标预测及分析
通过对参桃软肝方成分靶点预测及分析,共收集参桃软肝方化学成分 437个,其中白术成分32个,其主要成分为多糖、白术三醇等;半枝莲8个,其主要成分为内脂类、黄芩苷等;当归65个,其主要成分为多糖、阿魏酸等;甘草133个,人参158个,其主要成分为人参皂苷、人参多糖等;桃仁3个,其主要成分为苦杏仁甙、糖类等;仙鹤草22个,主要成分为三萜及其苷类、黄酮类化合物;山慈菇16个,其主要成分为糖苷类化合物及萜类化合物等。收集药物靶点共计3236个,其中山慈菇 108个,桃仁35个,半枝莲62个,当归370个,人参2013个,白术210个,甘草360个,仙鹤草78个。
表1、2示,对参桃软肝方潜在靶点进行GO分析,结果显示潜在靶点基因涉及的生物学功能包括细胞溶质、外泌体、ATP结合、线粒体基质、线粒体电子转运等条目,根据 P值大小排序,筛选具有明确ID的条目共计20 条。KEGG通路富集结果显示,参桃软肝方潜在靶点作用的通路条目包括氧化磷酸化、碳代谢、糖酵解和糖质生成等,其涉及病种包括阿尔兹海默病、 帕金森病、非酒精性脂肪性肝病等。根据 P 值大小排序,筛选具有明确ID的条目共计13条。
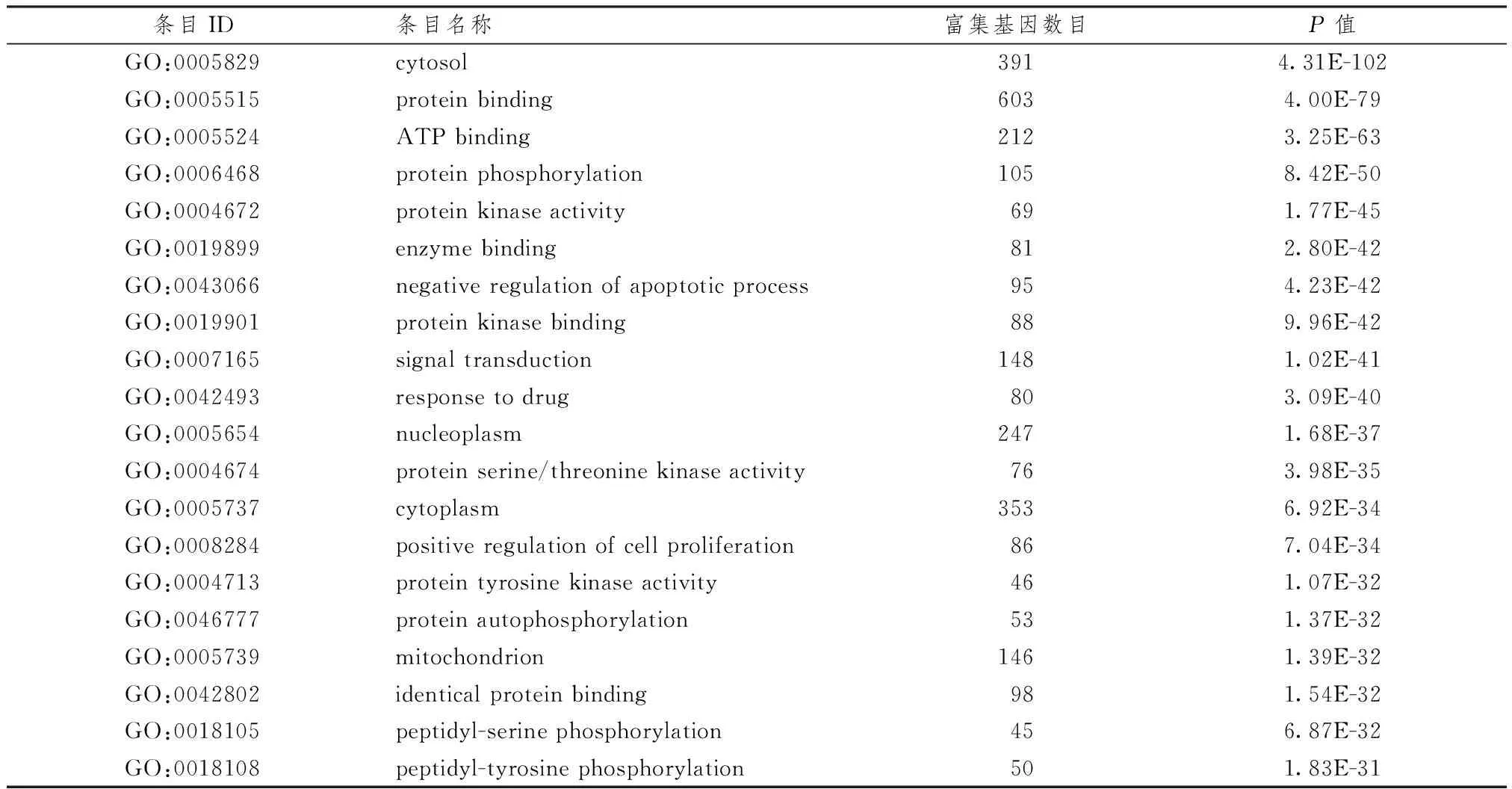
表1 参桃软肝方潜在靶点具有的功能信息
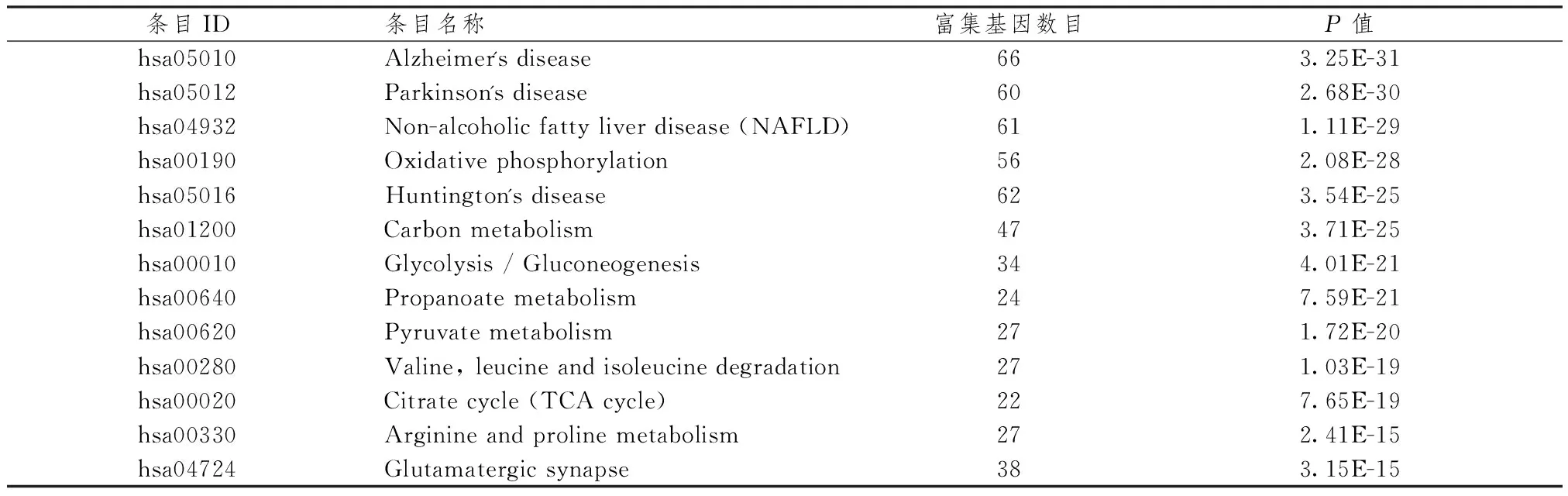
表2 参桃软肝方潜在靶点参与的通路信息
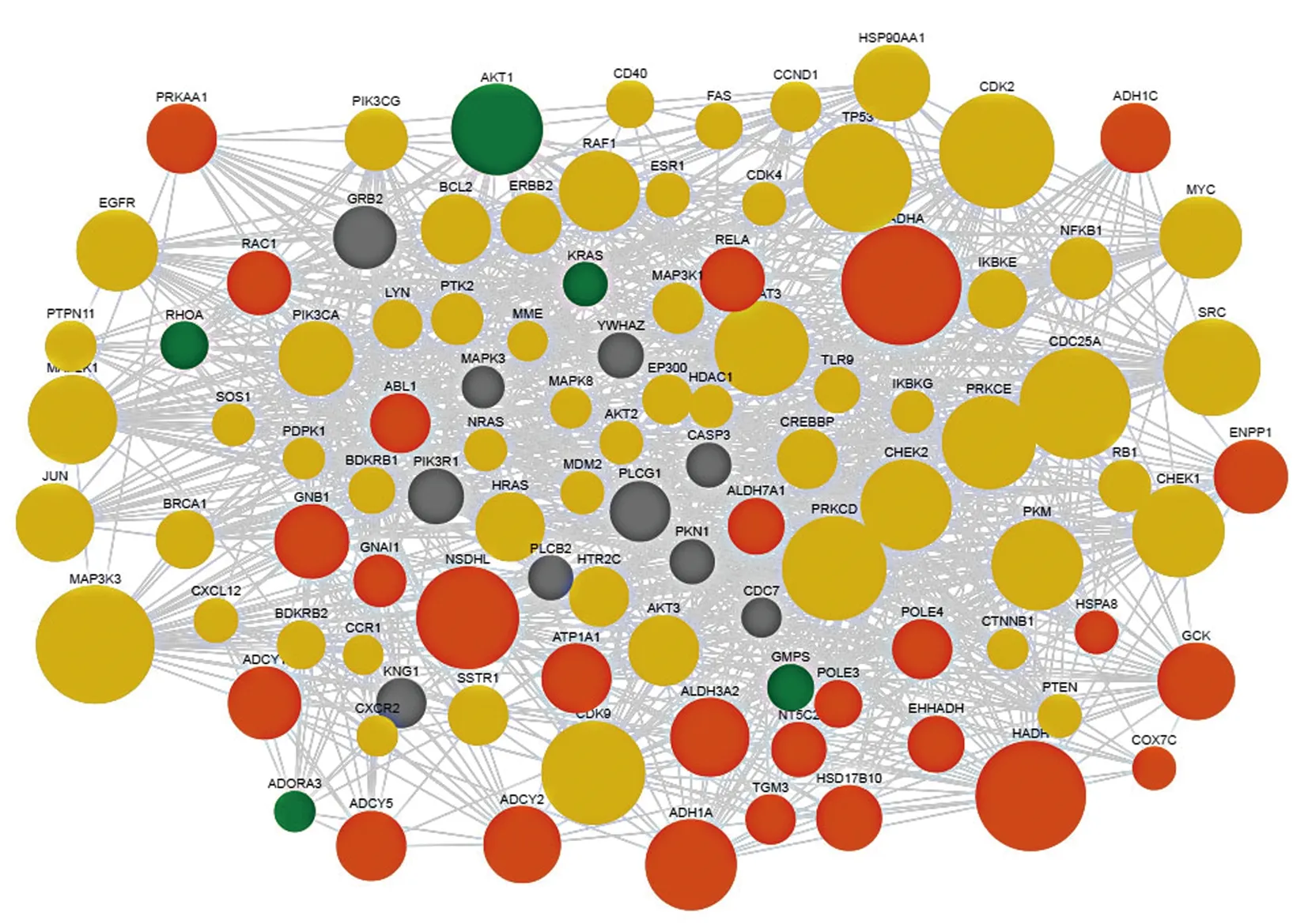
图1 参桃软肝方抗肿瘤的关键靶点网络
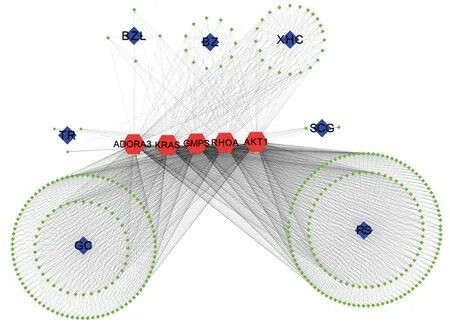
注:RS代表人参,GC代表甘草,TR代表桃仁,BZL代表半枝莲,XHC代表仙鹤草图2 参桃软肝方药物-成分-关键靶点网络
2.2 参桃软肝方抗肿瘤的关键靶点网络构建
图1、2表3示,经过整合药理学平台的筛选,得到参桃软肝方及“cancer”&“tumor”关键靶点共计780个,其中药物直接作用靶点152个,已知疾病靶点268个,药物与疾病共同靶点29个,其他靶点331个。将以上靶点汇总并构建“参桃软肝方潜在作用靶点肿瘤疾病靶点”的蛋白互作网络。蛋白互作网络中,根据节点连接度仅显示前100个靶点,连接度越大说明节点越大。通过该网络共确定参桃软肝方与癌症共同靶点5个,分别为ADORA3(Adenosine receptor A3)、RHOA(Transforming protein RhoA)、AKT1(RAC-alpha serine)、KRAS(KRAS proto-oncogene)、GMPS(Guanine monophosphate synthase)。将参桃软肝方中靶点为包含上述5个靶点药物及其成分进行确认并进行数据整理,使用Cytoscape软件(version 3.7)构建药物-成分-关键靶点网络图,其中参桃软肝方中有上述关键靶点且存在作用关系的成分数量为322个,通过该网络体现了参桃软肝方多成分-多靶点的药物作用关系,表明参桃软肝方可通过多成分、多靶点治疗癌症疾病。参桃软肝方中与上述5个靶点均存在相互作用关系的药物成分及数量、主要药物成分分类。
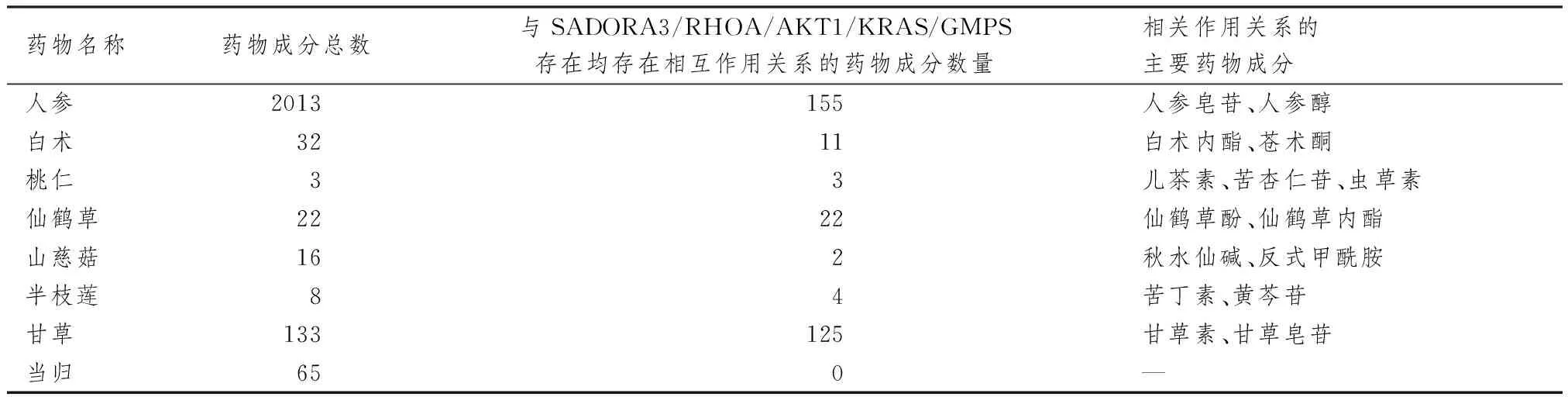
表3 参桃软肝方中与关键靶点有相互作用的成分及药物分类比较
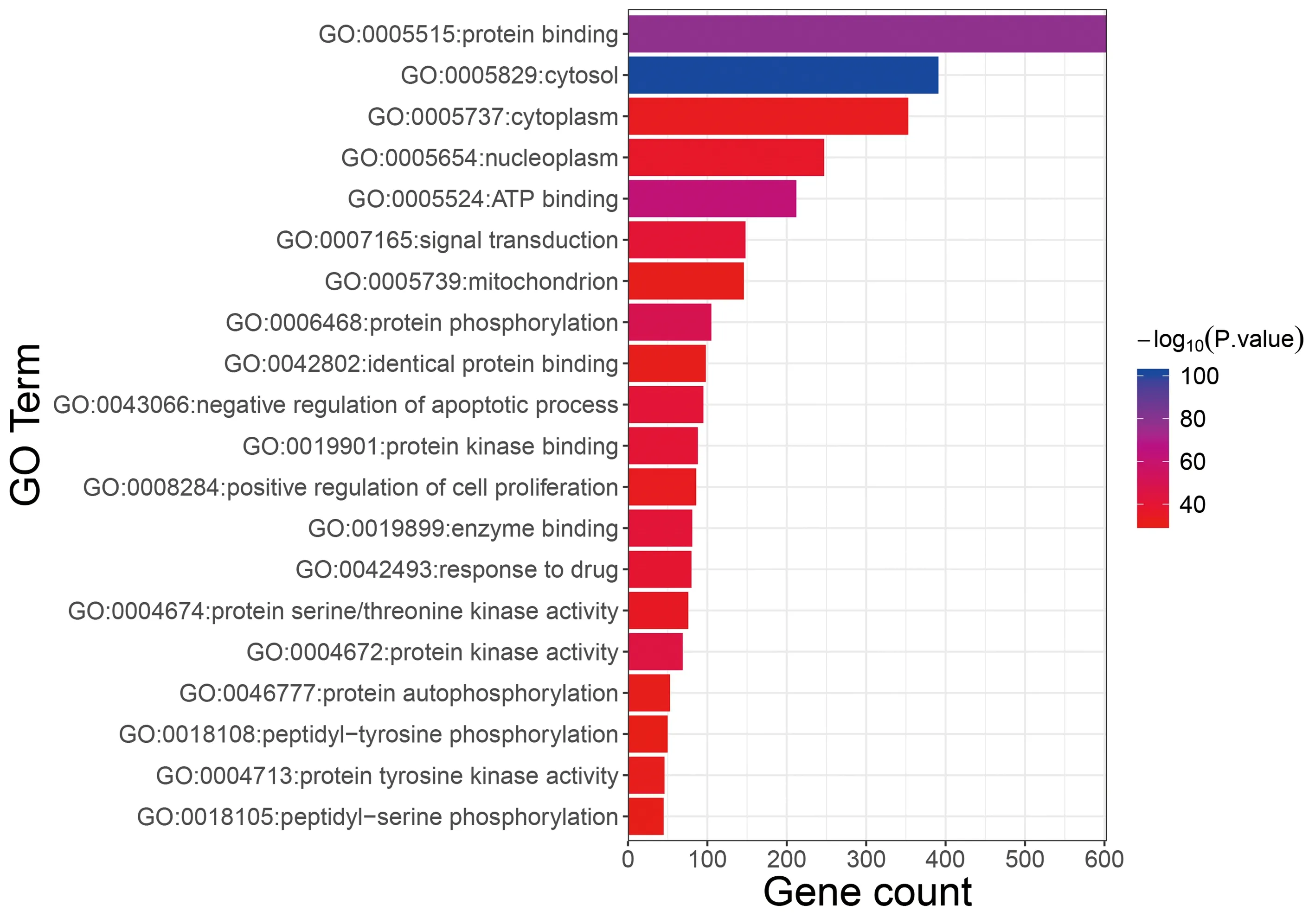
注:条形图中按 -log10(P.value) 值大小颜色从红色向紫色渐变,-log10(P.value) 值越大则P值越小,条目相关性越强图3 参桃软肝方抗肿瘤关键靶点具有功能信息
BZ代表白术,SCG代表山慈菇,蓝色节点代表药物,绿色节点代表成分,红色节点代表关键靶点。
2.3 参桃软肝方化学成分靶标预测及分析
图3、4示,参桃软肝方抗癌关键靶点的GO功能分析显示,参桃软肝方药物靶点与疾病关键靶点基因功能涉及蛋白结合、细胞质、核原生质、ATP结合、信号传导、蛋白质磷酸化多个条目,根据P值大小进行排序,筛选具有明确ID的条目共计20条。通过整合药理学平台进行参桃软肝方靶点通路富集分析显示,参桃软肝方抗癌关键靶点主要涉及的通路有T细胞信号通路、ERBB信号通路、FoxO信号通路、趋化因子信号通路、细胞凋亡等,涉及病种为乙型肝炎、慢性髓性白血病、结直肠癌、前列腺癌、胰腺癌等。根据 P值大小,筛选出具有明确ID的条目共计14 条。结果提示,参桃软肝方的抗癌关键靶点在上述信号通路及病种中具有重要作用。
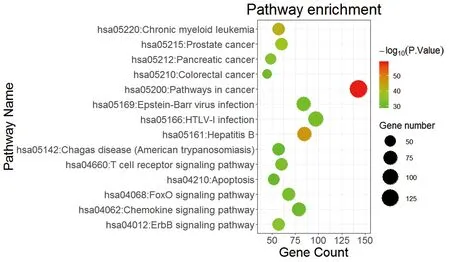
注:气泡图中气泡按P值大小、颜色从绿色向红色渐变,点的大小与富集的基因数量成正比图4 参桃软肝方抗肿瘤关键靶点所参与的通路信息
2.4 共同靶点分析
表4图5示,将参桃软肝方关键抗癌靶点ADORA3、RHOA、AKT1、KRAS及GMPS 使用DAVID 数据库(Version 6.8 https:∥DAVID. ncifcrf.gov/)进行基因注释。其中ADORA3、RHOA、AKT1、KRAS 4个基因呈现具有统计学意义的注释结果,将其所涉及的通路按P值大小选取前20个条目,将所得条目与参桃软肝方抗癌关键靶点所涉及的通路进行匹配,并使用R软件绘制维恩图,最终得到3条共同通路及2个涉及的共同病种。3条通路分别为T细胞受体信号通路(T cell receptor signaling pathway)、癌症通路(Pathways in cancer)和趋化因子信号通路(Chemokine signaling pathway),2个共同癌种为胰腺癌(Pancreatic cancer)和结直肠癌(Colorectal cancer)。结果表明,上述涉及的基因、通路及病种在参桃软肝方抗癌治疗中具有重要的作用,值得在今后的研究中进行深入探索。
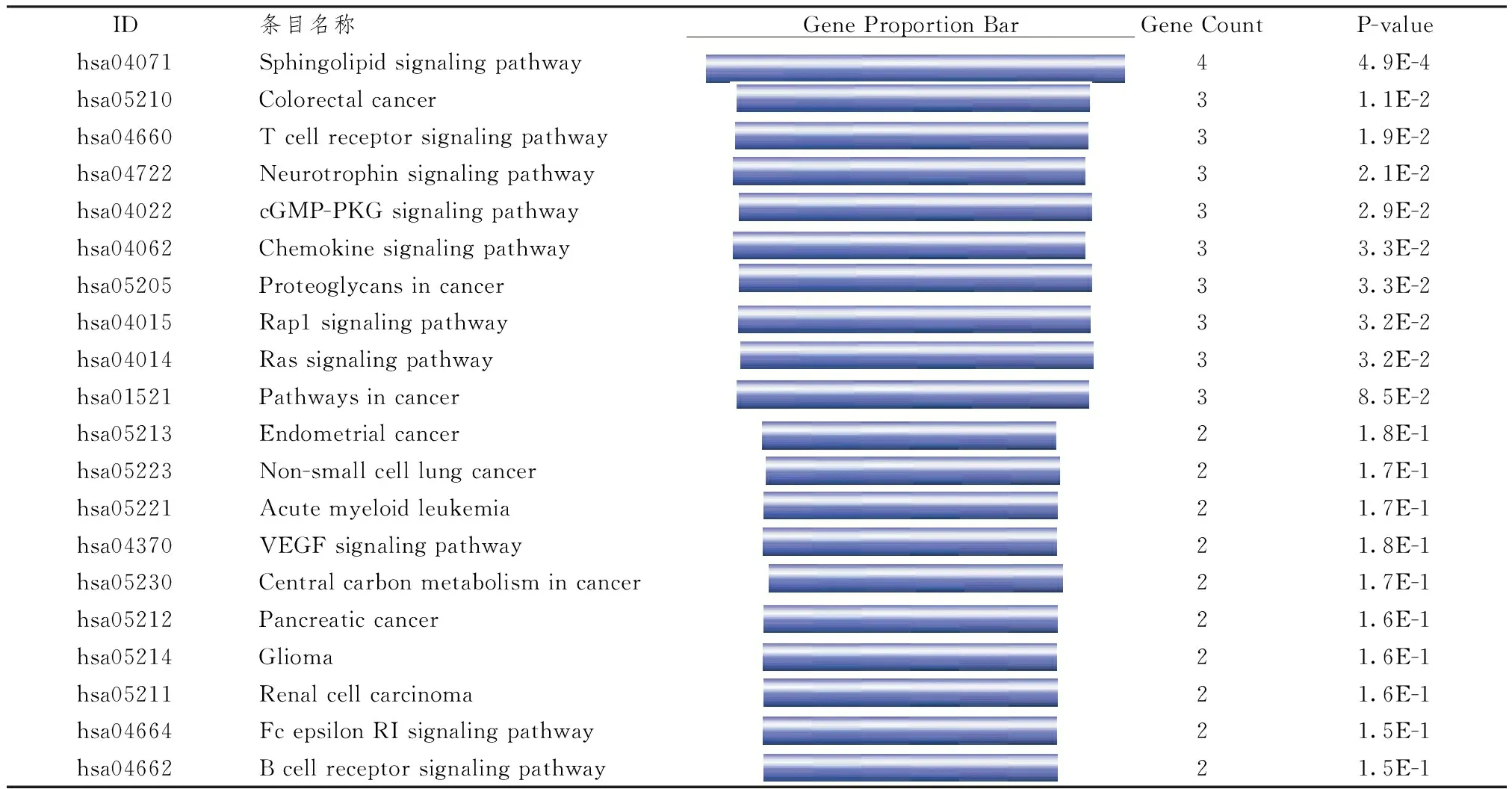
表4 参桃软肝方抗癌治疗关键靶点的KEGG分析
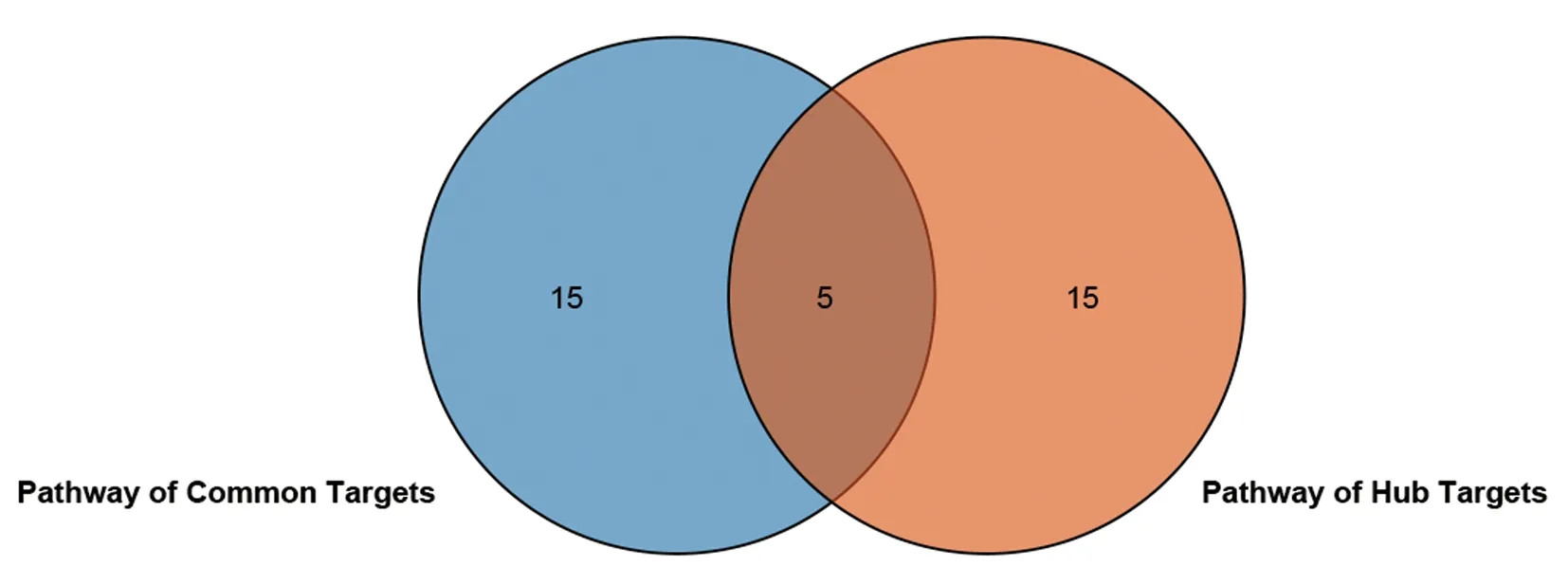
图5 共同靶点涉及通路与关键靶点涉及通路维恩图
3 讨论
本研究基于整合药理学方法对参桃软肝方抗癌治疗的有效成分、关键靶点、涉及通路及潜在治疗癌种进行分析,研究结果表明参桃软肝方在治疗癌症方面具有多成分、多靶点的协同作用特点。参桃软肝方是肿瘤名医周岱翰教授的经验方,方中人参为君药大补元气,补脾益肺;白术能健脾益气;桃仁善泄血滞、祛瘀力强,可治疗血闭癥瘤等多种瘀血阻滞的病证;当归可活血通经,当归、人参合用可补气生血,活血祛瘀;仙鹤草补虚;山慈菇清热解毒化痰散结;半枝莲清热解毒化瘀;甘草调和诸药,诸药合用共奏补气健脾、活血祛瘀、清解热毒之功,是治疗肝癌的临床有效方剂[24]。本研究立足其良好的治疗肝癌的研究背景,通过整合药理学分析,旨在预测其具有广谱抗肿瘤作用的成分及靶点,为参桃软肝方未来新药开发及适应症扩展提供理论基础。
本研究中人参筛选出的抗癌关键成分为人参皂苷Rg3、Rg1、Rb1、Rh1、Rh2及多种人参醇等;白术为白术内酯Ⅰ、苍术酮等;桃仁为儿茶素、苦杏仁苷、虫草素;仙鹤草为仙鹤草酚、仙鹤草内酯等;山慈菇为秋水仙碱、反式甲酰胺;半枝莲为汉黄芩苷、野黄芩苷、5-半乳糖苷黄芩苷、苦丁素。结合目前文献报道,上述药物抗癌作用研究表明,人参皂苷 Rg3、Rg1、Rb1、Rh1、Rh 2等均具有显著的抗肿瘤活性,该类成分具有促进肿瘤细胞凋亡、抑制肿瘤生长、抑制肿瘤血管生成及调节免疫功能等多方面作用[25]。体外实验表明,以20(s)-原人参二醇为代表的人参醇类化合物同样具有良好的抑制肝癌细胞、黑色素瘤细胞及Lewis 肺癌细胞生长的作用[26];白术提取物白术内酯Ⅰ可通过增强超氧化物歧化酶(SOD) 活性,下调肿瘤细胞CDK1,抑制 Notch 信号通路,从而发挥对肿瘤细胞的毒性作用[27-29]。白术提取物苍术酮属于倍半萜类合物,具有抗炎、抗肿瘤和免疫调节等多种药理作用[30],研究表明,苍术酮可通过降低 CCDC12、PI3K、p-AKT 和 mTOR基因的表达,从而抑制结直肠癌HT29细胞的增殖并介导其凋亡,同时对HepG2肝癌细胞的增殖也具有良好的抑制作用[31];桃仁成分儿茶素可通过抑制细胞增殖,诱导细胞凋亡、抗氧化、抑制血管生成而发挥抗癌作用[32];苦杏仁苷则可通过调控 Akt 和RICTOR等相关信号通路,下调细胞周期相关因子,诱导膀胱癌、肺癌、结肠癌等肿瘤细胞凋亡[33];虫草素可通过阻滞肿瘤细胞RNA转录而治疗多发性骨髓瘤[34],诱导DNA损伤而杀伤乳腺癌细胞[35];研究表明,仙鹤草主要成分仙鹤草酚能抑制和诱导白血病细胞(K562)凋亡,并存在剂量依赖性[36],其成分仙鹤草内脂进一步的分离提取物具有较好的保肝药理活性[37]及抗炎[38]作用,同时体外实验表明,其可以诱导人源胃腺癌AGS 细胞凋亡[39];山慈菇成分秋水仙碱作为微管解聚剂,具有良好的抗炎、抗纤维化和免疫调节作用,同时也是一种广谱抗癌药物。秋水水碱可通过阻断微管蛋白形成,从而抑制肿瘤细胞分裂,诱导肿瘤细胞死亡[31];半枝莲成分汉黄芩苷可以通过影响B 细胞淋巴瘤-2(Bcl-2) 和凋亡蛋白 Bax 蛋白的表达水平,调节信号MAPK-mTOR等信号通路以抑制肿瘤细胞增殖,同时对正常上皮及外周血及骨髓几乎没有毒性[40]。而野黄芩苷对舌鳞癌、结肠癌、肝癌、乳腺癌等多种肿瘤细胞均有毒性作用,其抗肿癌机制包括诱导细胞凋亡、阻遏细胞周期、增强黏附力、抗侵袭等[41];甘草成分甘草素同样具有良好的促肿瘤细胞凋亡作用,其机制涉及促进细胞内活性氧(ROS) 产生,上调 p53和 Bax基因表达,下调 Bcl-2基因表达,激活线粒体凋亡途径等[42]。
上述研究结果表明,本研究所分析预测的成分是参桃软肝方发挥抗肝癌及其他类型癌肿作用的重要物质基础,同时也表明参桃软肝方在抗癌治疗中涉及多成分协同作用的药代动力学过程。同时笔者也注意到,参桃软肝方与关键靶点均存在相互作用,但目前文献对其抗癌药效仍鲜有报道的成分有山慈菇成分反式甲酰胺,半枝莲成分5-半乳糖苷黄芩苷、苦丁素, 甘草成分甘草皂苷(如甘草皂苷C2、甘草皂苷A3、甘草皂苷G2等),此类成分的抗癌作用及价值值得在未来进一步的研究。
本研究中筛选出的参桃软肝方抗癌治疗的关键作用靶点种ADORA3、RHOA、AKT1、KRAS在网络中具有重要意义。目前研究也表明,这些靶点在癌症发生发展中具有重要作用。腺苷受体(ADORA3)高度表达于小细胞肺癌、前列腺癌、乳腺癌、卵巢癌等实体瘤中,而在相应的正常组织和癌旁组织中低表达,其活化可抑制多种肿瘤细胞增生,延缓肿瘤生长,促进细胞凋亡[43-44];RHOA基因具有调节细胞骨架及增殖作用,可促进肿瘤发生发展,在睾丸精原细胞瘤、肺癌、结肠癌、乳腺癌等多种肿瘤中表达增加,其上调和或过表达与癌症不良预后相关[45];丝苏氨酸蛋白激酶-1(AKT1)异常表达于肺癌、乳腺癌、胃癌、胰腺癌、结肠癌等癌肿,其异常可以抑制细胞凋亡,与癌症的发生发展密切相关[46-47];KRAS基因是原癌基因RAS家族的成员之一,其突变主要与结直肠癌的发病有关,可通过使 RAS-AF-MAPK 信号传导通路持续激活,引起细胞的恶性增殖从而发生癌变[48]。本研究分析结果表明,参桃软肝方中抗癌治疗关键靶点的抗癌作用与蛋白结合、核原生质、ATP结合有关,涉及通路为T细胞信号通路、ERBB信号通路、FoxO信号通路和趋化因子信号通路等。因此笔者认为,未来研究可设计实验验证参桃软肝方的有效成分对上述关键靶点的作用效果,探索其对上述特定生物学过程及通路的影响,进一步阐明参桃软肝方抗癌治疗的科学内涵。
此外本研究发现,参桃软肝方药物关键靶点通路富集分析涉及结直肠癌、胰腺癌、慢性髓性白血病及前列腺癌等癌症,这也提示参桃软肝方及其方中的药物可在结直肠癌、胰腺癌、慢性髓性白血病、前列腺癌等癌症中进行临床运用及开展相关基础研究,在一定程度上与中医“异病同治”思想相契合。
综上所述,本研究借助整合药理学这一新兴学科理念及技术,对参桃软肝方抗癌作用机制及药效物质基础进行分析,既为参桃软肝方复方未来的进一步研究提供理论依据,也为其应用于肿瘤疾病的临床治疗提供更加开阔的思路。
