宫颈癌患者PICC导管多重耐药菌感染的危险因素及病原学特征
2021-03-06何多姣史九波荆菁华安淑霞
何多姣 史九波 荆菁华 安淑霞
宫颈癌作为女性生殖系统中发病率较高的疾病之一,是导致女性死亡的主要因素,尤其近年来随着不良生活习惯增多及性观念开放,宫颈癌发病率日益升高且呈现低龄化趋势[1-2]。由于该病发病早期症状不典型,加之部分地区筛查技术落后,多数女性确诊时往往已处于中晚期阶段,丧失了最佳手术根治时机而不得不选取化疗手段干预[3]。而化疗常需静脉给药且周期长、药物副作用大,化疗过程中易出现药物外渗诱发静脉炎、感染等诸多并发症,不利于提高患者治疗依从性,因此合理选取静脉通道至关重要[4-5]。经外周静脉穿刺中心静脉置管(PICC)具有留置时间长、可降低反复穿刺频繁及静脉炎等并发症优势,被临床广泛使用[6]。但PICC终究属于侵入性操作,尤其近年来随着抗菌药物大量使用,PICC导管多重耐药菌感染日益显现,增加了患者死亡风险。近3年来相关研究仅集中于未耐药病原菌研究及危险因素筛查,涉及宫颈癌患者PICC导管多重耐药菌感染方面的分析寥寥无几[7],不利于宫颈癌PICC导管多重耐药感染防控。本研究通过筛查宫颈癌患者PICC导管多重耐药菌感染危险因素及监测其病原学,旨在降低PICC导管多重耐药感染率、提高感染控制效果,现报告如下。
1 资料与方法
1.1 临床资料
选取2017年10月至2019年9月医院宫颈癌PICC导管患者589例,纳入标准:①首次诊断为宫颈癌且初次接受化疗。②具备PICC指征[8]。③导管留置时间>72 h且留置前48 h无明确潜伏期感染。④各项检查和病历资料完整且患者自愿参加。排除标准:①精神疾病及认知、语言交流功能障碍。②合并其他恶性肿瘤和感染类型。③血液、免疫疾病。④中途病情变化或外院转入。纳入的589例患者年龄38~76岁,鳞癌415例、腺癌174例,分期:Ⅱ期112例、Ⅲ期447例、Ⅳ期30例,PICC导管部位:贵要静脉375例、肘正中静脉144例、头静脉70例,留置1~171 d。符合医学伦理学要求,经委员会允准。
1.2 方法
回顾性观察纳入的589例宫颈癌PICC导管患者相关资料,对PICC导管多重感染者加强监测,着重分析、归纳感染危险因素;同时监测和记录感染者病原学特征。
样本来源、采集与病原菌培养鉴定:无菌条件下拔除导管,距导管尖端5 cm部位剪断导管,留取导管尖端置于无菌培养试管中,即刻送检。样本病原学鉴定流程严格遵循《全国临床检验操作规程》[9],连续两次以上培养出同一病原菌即可确认为病原菌,或同一培养皿培养出2种以上病原菌且属于优势生长也可作为病原菌;且采用美国临床试验室标准化协会(CLSI)推荐的表型确证试验进行超广谱β-内酰胺酶(ESBLs)表型检测。结果评定参考2013年CLSI/美国临床实验室标准化委员会(NCCLS)标准[10]和《医疗机构耐药菌MDR、XDR、PDR的国际标准化定义专家建议》[11]。菌株质量控制采用金黄色葡萄球菌ATCC25923、表皮葡萄糖球菌ATCC12228、铜绿假单胞菌ATCC27853、大肠埃希菌ATCC25922等,所有菌株购自河南省卫健委检测中心。
1.3 统计处理
2 结果
2.1 宫颈癌PICC导管患者感染率及感染类型
PICC导管相关性感染94例、感染率15.96%;多重耐药菌感染38例、感染率6.45%。多重耐药菌感染类型中,局部感染21例(55.26%),导管内定植感染13例(34.21%),导管相关性血流感染4例(10.53%)。
2.2 宫颈癌PICC导管多重耐药菌感染者病原菌检出率及病原菌分布
多重耐药菌感染的38例患者中共检出多重耐药菌株38株,其中:耐甲氧西林金黄色葡萄球菌10株,占26.32%;耐甲氧西林表皮葡萄球菌12株,占31.58%;产超广谱β-内酰胺酶(ESBLs)肠杆菌科病原菌9株,占23.68%;耐碳青霉烯类抗菌药物鲍曼不动杆菌4株,占10.53%;多重耐药/泛耐药铜绿假单胞菌3株,占7.89%。
2.3 宫颈癌PICC导管多重耐药菌感染单因素分析
单因素中糖尿病、置管穿刺数量>3次、导管滑动/滑出、置管时间>5个月、化疗周期>5次、敷料更换>7天、中性粒细胞水平下降、CD4+/CD8+<1、抗菌药物使用种类>3种、抗菌药物使用时间>25 d与感染的发生相关,差异有统计学意义(P<0.05),见表1。
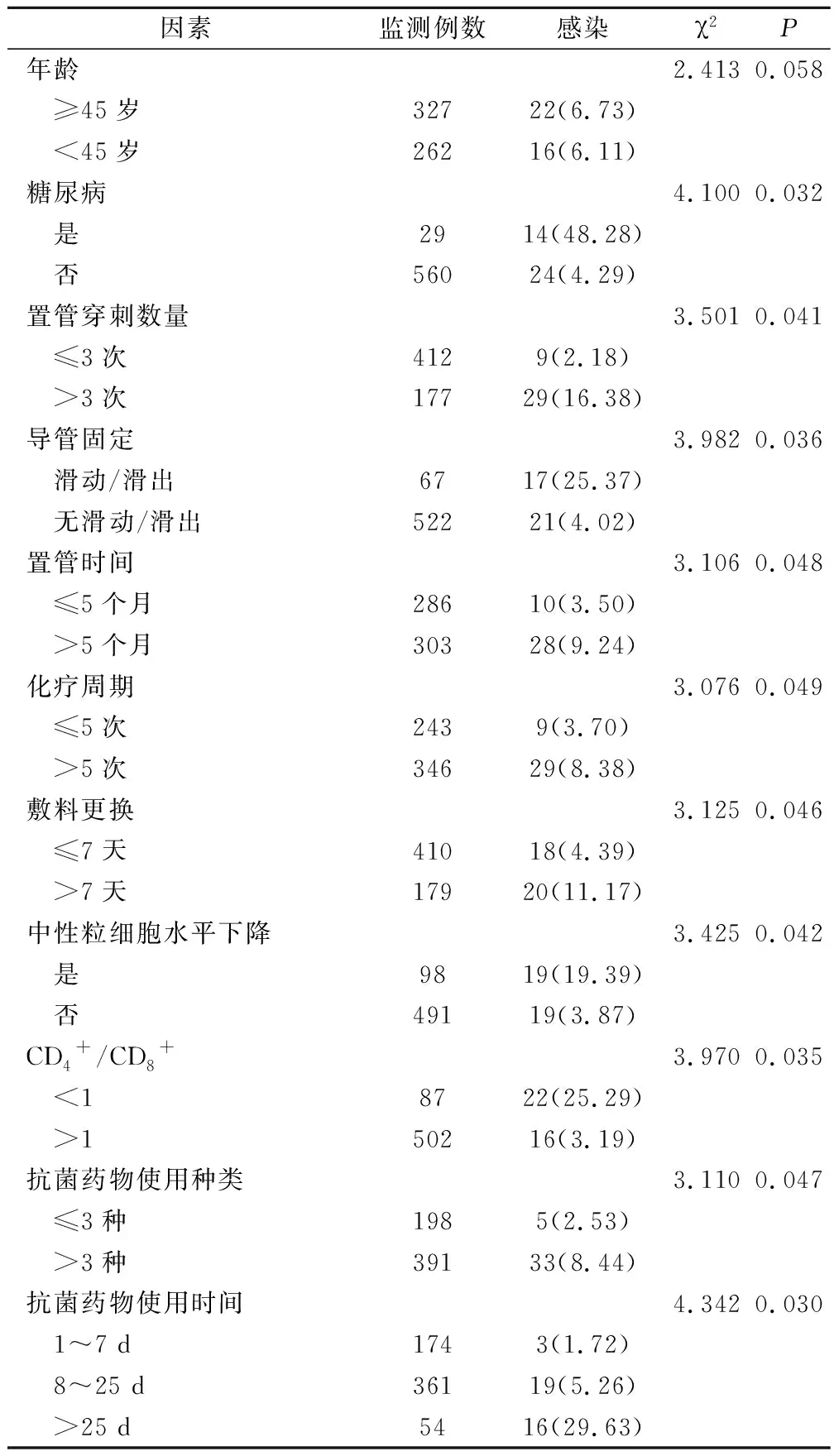
表1 宫颈癌PICC导管多重耐药菌感染单因素分析(例,%)
2.4 宫颈癌PICC导管多重耐药菌感染多因素分析
logistic回归分析以宫颈癌PICC导管多重耐药菌感染为因变量,将糖尿病、置管穿刺数量、导管滑动/滑出、置管时间、化疗周期、敷料更换、中性粒细胞水平下降、CD4+/CD8+<1、抗菌药物使用种类、抗菌药物使用时间作为自变量,结果证实化疗周期、中性粒细胞水平下降、CD4+/CD8+<1、抗菌药物使用种类、抗菌药物使用时间是宫颈癌PICC导管多重耐药菌感染的危险因素(P<0.05),见表2。

表2 宫颈癌PICC导管多重耐药菌感染危险因素logistic回归分析
3 讨论
近年来随着抗菌药物品种更新换代,多数感染症状得以有效控制;但与之而来的多重耐药菌大量产生,迫使抗菌药物不断升级,如三代以上头孢类或碳青霉烯酶抗菌药物,一旦再次耐药则难以遏制病情进展,造成感染播散,最终导致患者死亡[12-13]。耐药菌产生与以下机制不无关系,如病原菌自身染色体固有耐药性,即绝对耐药性;以及病原菌遗传基因变异而产生的耐药性表型,致既往敏感的抗菌药物产生耐药,即获得耐药性[14-15];而多重耐药菌感染多为获得性耐药,由此多重耐药菌感染是可防控的。
本研究监测本地区宫颈癌PICC导管多重耐药菌感染危险因素及病原学特征,旨在提高抗菌药物合理使用率、降低宫颈癌PICC导管多重耐药菌感染率,结果显示宫颈癌PICC导管相关性感染率15.96%、多重耐药菌感染率6.45%,均低于部分文献资料报道率[16],与本地区宫颈癌PICC导管多重耐药菌感染防控措施得当及各项操作技术等因素密切相关。检出的38株多重耐药菌株,包括耐甲氧西林金黄色葡萄球菌、耐甲氧西林表皮葡萄球菌、产超广谱β-内酰胺酶(ESBLs)肠杆菌科细菌、耐碳青霉烯类抗菌药物鲍曼不动杆菌和多重耐药/泛耐药铜绿假单胞菌,尤以前三者检出率最高且均是单株感染,与张长春等学者研究报道类似[17],但也同部分研究结果存在一定差异[18],与纳入病例标准、地区性、抗菌药物使用经验等因素不无关系。另外,本次病原学监测结果提示对于宫颈癌PICC者而言,加强药敏试验,根据多重耐药菌分布特点选取合理抗菌药物至关重要,尤其需慎用碳青霉烯类药物。进一步分析宫颈癌PICC导管多重耐药菌感染危险因素,结果显示化疗周期、中性粒细胞水平下降、CD4+/CD8+比值<1、抗菌药物使用种类、抗菌药物使用时间是宫颈癌PICC导管多重耐药菌感染危险因素(P<0.05),与部分研究文献略有差异,如糖尿病、置管时间等,与患者血糖水平控制良好及导管护理工作有关。而化疗周期、中性粒细胞水平下降、CD4+/CD8+比值<1、抗菌药物使用种类、抗菌药物使用时间是宫颈癌PICC导管多重耐药菌感染危险因素与以下机制有关,如中晚期宫颈癌患者往往需要配合化疗干预,化疗虽能有效控制肿瘤细胞生长繁殖与扩散,但也可致机体正常组织细胞功能丧失;且随着化疗周期延长,中性粒细胞匮乏及血红蛋白、白蛋白水平持续下降,致使患者机体免疫力低下、贫血愈发严重,导致条件致病菌转化、病原菌移位,从而诱发患者对自身固有菌群及外界致病菌感受性倍增,增加多重耐药菌感染率。抗菌药物虽能有效控制宫颈癌PICC导管感染,但长时间、多品种联合使用则会破坏机体内环境微生物平衡状态,易致病原菌基因突变、转化、移位以及作用靶位变化、胞膜主动转运下降等改变[19],从而诱发多重耐药菌感染。
综上所述,宫颈癌PICC导管多重耐药感染危险因素复杂多样,加强高危人群监测、根据多重耐药菌病原学特征选取合理抗菌药物,有利于宫颈癌PICC导管多重耐药菌感染的早期防控,避免耐药菌株播散与流行。
