丹参酮治疗雄激素性秃发大鼠模型的研究
2021-03-06胡嘉元王思丹刘青武杨顶权
胡嘉元 李 锘 底 君 王思丹 刘青武 陈 静 杨顶权
1首都医科大学附属北京中医医院皮肤科,北京,100010;2中日友好医院皮肤与性病科,北京,100029;3太阳宫社区卫生服务中心中医皮肤科,北京,100028;4钟祥市中医院皮肤科,湖北钟祥,431900;5北京中医药大学,北京,100029;6首都医科大学附属北京中医医院北京市中医研究所,北京,100010;7浙江省皮肤病医院,浙江德清,313200
雄激素性秃发(androgenetic alopecia, AGA)是临床上最常见的脱发性疾病,表现为头发密度进行性减少[1],头发生长周期及毛囊微结构的改变[2],据统计,我国男性AGA的发病率高达21.3%,女性发病率约为6.0%[3,4]。AGA的发病机制尚不完全清楚,目前毛发学界普遍认为此病为雄激素依赖的常染色体显性遗传多变性疾病[1],AGA发病涉及遗传易感性、性激素代谢、毛囊微环境炎症反应及精神因素等多个方面[5]。
雄激素性秃发的临床表现以头发密度进行性减少为主,同时伴有头皮脂溢增多、头屑增多、头皮瘙痒等症状[6],给患者带来巨大的身心困扰。目前AGA的临床治疗周期较长,指南中推荐的方法主要为抑制II型5α还原酶、抗雄激素以及外用米诺地尔[7],治疗手段有限。
丹参酮是中药丹参提取物制备的中成药,包含隐丹参酮、丹参酮IIA、丹参酮IIB以及羟基丹参酮IIA等主要成分,研究显示其具有调节性激素水平、抑制皮脂腺活性、改善微循环和显著的抗炎抑菌等作用[8],临床上广泛应用于治疗皮肤感染、痤疮等疾病。有研究应用丹参酮治疗AGA取得了一定疗效[9-11]。本研究应用DHT皮下注射的方法建立大鼠AGA模型,应用丹参酮对AGA模型大鼠进行治疗,评价丹参酮治疗AGA的疗效,并探讨其作用机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 SPF级Wistar大鼠32只,雄性,体重(220±20)g,购自北京维通利华实验动物技术有限公司,合格证号SCXK(京)2012-0001,饲养于中日友好医院临床医学研究所SPF级实验动物平台,自由饮水、摄食,适应性喂养1周。
1.1.2 试剂与主要实验仪器 二氢睾酮购于美国Sigma公司(批号521-18-6);药用玉米油(CAS:8001-30-7)购自北京索莱宝科技有限公司;实验药物丹参酮(河北兴隆希力药业有限公司)、非那雄胺片(杭州默沙东制药有限公司)均由中日友好医院药学部提供;大鼠雌二醇(E2)ELISA检测试剂盒、大鼠睾酮(T)ELISA检测试剂盒、大鼠二氢睾酮(DHT)ELISA检测试剂盒、大鼠酸性成纤维细胞生长因子(αFGF)ELISA检测试剂盒、大鼠胰岛素样生长因子(IGF-1)ELISA检测试剂盒、大鼠肿瘤坏死因子α(TNF-α)ELISA检测试剂盒、大鼠转化生长因子β1(TGF-β1)ELISA检测试剂盒均购于北京雅安达生物技术有限公司(YAD);酶标仪MK3雷勃(THERMO FISHER);洗板机MK2雷勃(THERMO FISHER);离心机英泰TG16(长沙英泰仪器有限公司);恒温箱DH3600A通利信达(天津市通利信达仪器)。
1.2 实验方法
1.2.1 实验动物分组 32只Wistar大鼠以随机数字表法分为4组:空白对照组(K组)、二氢睾酮造模组(DHT组)、丹参酮组(D组)及非那雄胺组(F组)各8只。
1.2.2 大鼠模型的建立 将实验药物二氢睾酮溶于药用玉米油中,配制为浓度6 mg/mL的溶液,DHT组、D组、F组大鼠每日给药,给药方式:大鼠背部皮下注射;给药量:5 mg/kg·d,连续给药60天;K组大鼠未做处理。各组间大鼠饲养条件、饮食及饮水均无差别。
1.2.3 实验给药 将实验药物丹参酮溶于生理盐水中,配制成25 mg/mL溶液,根据人/大鼠体表面积换算,D组大鼠予0.24 g/kg·d药量进行灌胃治疗,灌胃治疗从造模的第二天开始,连续给药60天;实验药物非那雄胺溶于生理盐水中,配制成0.012 mg/mL溶液,根据人/大鼠体表面积换算,F组大鼠予0.12 mg/kg·d药量进行灌胃治疗,灌胃时间与D组一致;其余2组的大鼠每日予等体积的生理盐水灌胃,灌胃时间与D组一致。
1.2.4 观察指标
1.2.4.1 一般情况 观察各组大鼠的精神、活动情况,背部皮下注射区域的外观、红肿程度、毛发的颜色、光泽度以及质地的变化。
1.2.4.2 组织病理学 建模60天之后,对各组大鼠行麻醉处理,大鼠背部皮下注射DHT的区域(K组大鼠相同部位)脱毛,剪取1.5 cm3的全皮组织,对其中1 cm3的全皮组织予甲醛溶液固定,并行蜡块包埋制作病理切片,HE染色,于光学显微镜下观察大鼠皮下注射区域的组织病理学特点,毛囊周围组织的炎症情况以及毛囊周期。
1.2.4.3 血清及组织激素与细胞因子水平的检测 对各组大鼠进行腹主动脉取血,用ELISA法检测血清中的睾酮(T)、雌二醇(E2)、二氢睾酮(DHT)、酸性成纤维细胞生长因子(αFGF)、胰岛素样生长因子(IGF-1)、肿瘤坏死因子α(TNF-α)以及转化生长因子β1(TGF-β1)的水平;将剩余的0.5 cm3全皮组织加生理盐水进行组织匀浆,离心,取上清液,用ELISA法定量检测组织中上述的激素及细胞因子的水平。

2 结果
2.1 一般情况 造模开始2周之后,DHT组、D组和F组的大鼠出现不同程度的精神亢奋、情绪躁动等情况,以DHT组大鼠的躁动情况最为明显,实验操作过程中出现暴力反抗行为。DHT组、D组和F组的大鼠背部注射区域皮肤未出现红肿、渗液、糜烂等异常,大鼠背部毛发逐渐开始失去光泽,毛色灰黄,毛发油腻明显,造模3周之后逐渐出现毛发脱落,毛发稀疏、干枯、纤细、质脆。观察结果提示AGA大鼠模型成功建立(图1)。

图1 1a:空白对照组大鼠背部毛发密集,洁净且具有光泽;1b:二氢睾酮造模组大鼠背部毛发油腻,毛色呈灰黄色,毛干质脆,部分毛发脱落;1c:丹参酮组大鼠背部毛发较二氢睾酮造模组大鼠毛发密集,质硬、且光泽度好;1d:非那雄胺组大鼠背部毛发较二氢睾酮造模组大鼠毛发密集,但相比丹参酮组毛发更为油腻
2.2 大鼠血清及组织激素、细胞因子水平的检测结果
2.2.1 血清激素及细胞因子检测结果 大鼠血清的激素及细胞因子检测结果显示,D组、F组的血清雌二醇浓度与DHT组相比显著升高,差异具有统计学意义(P<0.05),丹参酮显著升高AGA模型大鼠血清的雌二醇浓度,D组与F组相比较,非那雄胺升高血清雌二醇的水平略高于丹参酮,但未显示统计学差异;DHT组与D组、F组的血清DHT浓度比较有统计学差异(P<0.05),丹参酮可显著降低AGA模型大鼠血清的DHT浓度,其降低AGA模型大鼠血清DHT的程度较非那雄胺更明显;DHT组的血清TNF-α、TGF-β1浓度明显高于K组(P<0.05),丹参酮及非那雄胺均具有轻度降低AGA模型大鼠血清TNF-α、TGF-β1浓度的作用,但并无统计学差异(表1)。

2.2.2 组织激素及细胞因子检测结果 大鼠组织的激素及细胞因子检测结果显示,DHT组的组织睾酮浓度与K组、F组比较有显著性差异(P<0.05),丹参酮对AGA模型大鼠组织的睾酮浓度无明显影响;D组、F组的组织αFGF的浓度与DHT组相比明显升高(P<0.05),表明丹参酮能够显著提升AGA模型大鼠的组织αFGF浓度,且丹参酮提升大鼠组织αFGF的水平高于非那雄胺(表2)。

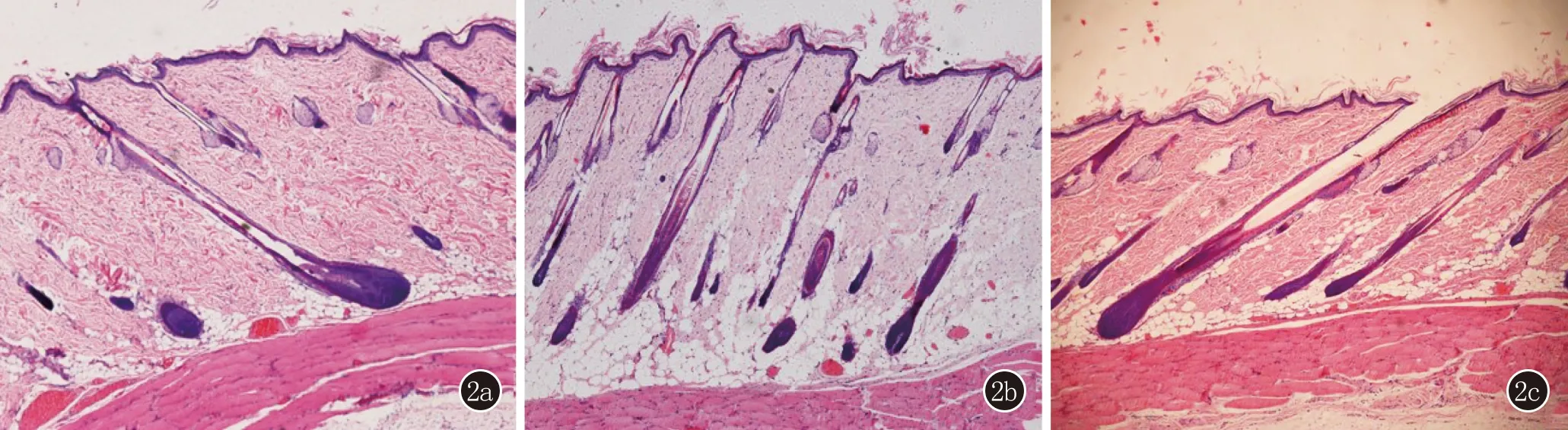
图2 2a:二氢睾酮造模组毛囊数量少,部分毛囊处于休止期或退行期,见毛囊微小化,皮下脂肪层明显变薄(HE,×200);2b:丹参酮组毛囊数量较多,多处于生长期,毛囊微小化不明显(HE,×200);2c:非那雄胺组病理可见较完整的处于生长期的毛囊(HE,×200)
2.3 组织病理学 典型的AGA组织病理学表现以终毛毳毛化为特征,DHT组的组织病理显示,毛囊的数量减少,部分毛囊处于休止期或退行期,可见毛囊微小化,皮下脂肪层明显变薄;而D组的毛囊数量较多,毛囊多处于生长期,未见到明显的毛囊微小化;F组的组织病理可见较完整的毛囊,毛囊处于生长期(图2)。
3 讨论
雄激素性秃发是临床上最常见的非瘢痕性脱发,流行病学调查显示我国目前有约1.3亿AGA患者。AGA作为损容性疾病[12],患者头顶部及额颞部的毛发稀疏甚则缺失对其外在形象及自信心产生了极大的负面影响,早期应用安全、有效的治疗对改善AGA患者发量、树立患者健康、自信形象至关重要。研究显示丹参酮治疗AGA能够有效改善头皮油脂分泌、增加毛发数量[13],但其作用机制尚不明晰。
本研究应用丹参酮对DHT诱导的AGA模型大鼠进行治疗,通过观察大鼠背部毛发改变、检测大鼠血清及局部组织的激素和细胞因子水平、分析大鼠背部皮肤毛囊的组织病理学特征,探讨丹参酮治疗AGA的作用机制。
雄激素性秃发与性激素代谢、毛囊微环境炎症反应密切相关[5],本实验应用ELISA法检测AGA模型大鼠血清及毛发组织相关激素、细胞因子水平以分析丹参酮在分子水平的相关作用。其中TNF-α、TGF-β1对毛发生长具有抑制作用。TNF-α作用于毛囊导致营养不良性生长期毛囊形成,组织病理学显示毛囊形态改变,毛囊球部和内根鞘角化异常,毛囊黑素细胞被破坏[14]。TGF-β1是雄激素诱导毛乳头细胞分泌的[15,16]直接抑制头皮前部上皮细胞生长的细胞因子[17],导致毛囊微型化,抗TGF-β1的抗体能够拮抗其产生的上皮细胞的生长抑制作用[17,18];研究显示[19]TGF-β1的表达增加可能导致毛囊周围纤维化,使毛囊加速进入生长中期,进一步导致毛囊萎缩;有研究在小鼠的生长期毛囊中注射TGF-β1,可致小鼠毛囊提前进入休止期[20],表明TGF-β1是诱导毛发进入退行期的重要因子。αFGF对毛发生长具有促进作用,能够促进新生血管形成,修复损害的内皮细胞,体外实验显示αFGF能够促进真皮乳头细胞和表皮角质形成细胞的DNA合成,对于刺激毛发生长具有正向调节作用[21]。
雄激素是AGA发病的直接诱发因素[22],其中最主要的是DHT,DHT含量在AGA患者的秃发区头皮明显增加[23],是导致AGA的关键因素[24],且DHT与雄激素受体(AR)有很强的结合力,其亲和力是睾酮的5倍以上[25],生物效能是睾酮的10倍,DHT与AR结合形成AR-DHT复合物,进入细胞核,参与调节DNA的转录与翻译,产生相应的生物学效应[26],促使毛乳头细胞产生更多TGF-β1[27],TGF-β1阻止毛囊内细胞的增殖、激活细胞内在的凋亡通路,引起毛囊内细胞主动死亡、引起毛囊微小化,进一步导致脱发。Sawaya等[28]认为DHT可能是通过选择性的调节凋亡蛋白酶的基因表达(如CASPASE-3、CASPASE-9等)来影响毛发生长的。雄激素同时招募相关的调节蛋白影响毛发生长,其中研究比较多的是Dickkopfs家族相关蛋白DKK-1,DKK-1是诱导毛囊再生和毛干生长的Wnt信号转导通路的抑制因子,在DHT的作用下DKK-1表达增加,抑制毛囊外根鞘细胞的生长、促使细胞凋亡[29]。
在本实验中,DHT组大鼠背部毛发与K组大鼠相比明显稀疏,部分毛发脱落,毛发分布凌乱,呈灰黄色,缺乏光泽,毛干纤细、干枯,表面有较多油脂颗粒附着;DHT组大鼠血清TNF-α、TGF-β1浓度均较K组明显升高(P<0.05),提示AGA模型大鼠造模成功。
D组大鼠背部毛发与DHT组大鼠比较毛发分布整齐,毛发较为浓密,毛色光泽度较好,毛发表面无明显油脂颗粒附着;D组大鼠血清雌二醇浓度较DHT组显著升高(P<0.05),血清二氢睾酮浓度较DHT组明显降低(P<0.05),其组织内αFGF的浓度显著高于DHT组(P<0.05)。
以上实验结果表明丹参酮胶囊能够显著降低循环中的DHT水平,调节性激素代谢,这与丹参酮的临床研究结果一致,认为丹参酮可以降低患者外周血的雄激素水平[30,31]。丹参酮降低血雄激素水平表现在其具有雌激素样活性和明显抗雄激素样活性作用[32],丹参酮的主要成分隐丹参酮能够降低模型雄鼠17-羟孕酮(17-OHP)水平,17-OHP是睾酮的前体物质,从而有效拮抗雄激素的合成[33],同时有研究[34]显示丹参酮分子的邻醌结构可与机体中的单胺类指标发生亲核反应,而下丘脑-垂体-肾上腺轴相关指标多为单胺类物质,因此调节下丘脑-垂体-肾上腺轴可能是丹参酮改善激素水平代谢的机制之一。
AGA病理表现为毛囊体积及密度逐渐缩小,终毛向毳毛转化,生长期与休止期毛囊比例不断下降[18],DHT组的组织病理显示,毛囊的数量减少,部分毛囊处于休止期或退行期,可见毛囊微小化,皮下脂肪层明显变薄;而D组的毛囊数量较多,且毛囊多处于生长期,未见到明显的毛囊微小化。提示丹参酮治疗AGA可能与其调节毛囊周期,维持毛囊数量有关。
实验结果显示F组治疗AGA模型大鼠能够提升血清雌二醇水平、降低DHT水平,这与非那雄胺的作用机制及导致的激素调节负反馈相关,F组提升雌二醇的水平略高于D组,但并无统计学差异。非那雄胺显著地提高了毛发组织的αFGF水平,但D组的提升程度稍高于F组。本实验中非那雄胺与丹参酮对AGA模型大鼠的治疗作用未显示出明显的差异,可能与实验时间较短、检测指标等因素相关,需进一步设计实验以研究两种治疗药物的干预特点。
