猪源乳酸菌分子生物学鉴定及黏附性特征
2021-03-05王大会李克克常世恺
王大会,李克克,常世恺
(1.丽水学院中国(丽水)两山学院,浙江省 丽水市323000;2.河南金百合生物科技股份有限公司河南省饲用微生态制剂工程技术研究中心,河南安阳市455000)
益生菌是当摄入足够数量时,对宿主产生健康益处的活性微生物。大量研究表明,益生菌能够改善肠道微生物菌群结构,构建有益的肠道微生态环境,抑制病原微生物的增植[1]。益生菌黏附和定植于宿主的肠道是发挥益生功能的前提,也是评价益生菌功能的重要特性之一,具有非常重要的理论和应用价值。人和动物的肠道菌群具有动态变化和种群繁杂的特性,对单个益生菌菌株的黏附能力评估通常采用体外细胞模型来开展,目前常见的细胞株有肠上皮样细胞Caco-2细胞株、人结肠癌细胞株HT-29、各种原代培养的上皮细胞以及分离纯化的黏液为主。本研究采用16SrDNA序列分析法对实验室分离保存的3株乳酸菌进行分类鉴定。以永生化猪小肠上皮细胞ZYM-SIEC02作为体外模型,通过革兰氏染色计数法分析益生菌在不同生长时期的黏附指数。旨在探索宿主同源性乳酸菌的黏附性能,为乳酸菌黏附定植的生物学作用提供理论基础,也为微生态制剂的生产提供科学依据。
1 材料与方法
1.1 材料
1.1.1 菌株与细胞
试验所用乳酸菌均分离于健康仔猪粪便和不同肠段肠黏液,由本实验室保存,标号分别为H菌、031菌和HN菌。猪小肠上皮细胞系(ZYM-SIEC02,保藏号:CCTCC-C201001,专利申请号:201010228957.3),由西北农林科技大学动物医学院张彦明教授惠赠。
1.1.2 培养基和试剂
伊红美蓝琼脂(EMB)培养基,LB培养基,MRS培养基,广东环凯微生物科技有限公司;DMEM/F12培养液,胎牛血清,美国Gibco公司;溶菌酶,Sigma公司;异丙醇,甲醇,宝生物工程(大连)有限公司;琼脂糖DNA回收试剂盒,北京百泰克生物技术有限公司;DNA Marker DL2000,广州东盛生物科技有限公司;细菌基因组DNA提取试剂盒(DP302),天根生化科技(北京)有限公司。
1.1.3 主要仪器
GZ-400-S恒温培养箱,湖南湘仪实验室仪器开发有限公司;HF90二氧化碳培养箱,力康生物医疗科技控股有限公司;分析天平,上海精科天平公司;-20℃低温冰箱,日本三洋公司;超净工作台,Mettle:AE-00。
1.2 方法
1.2.1 乳酸菌的鉴定
(1)菌株的培养扩增及革兰氏染色镜检:采用MRS液体培养基,37℃摇床培养18~24 h。并对该3株菌进行革兰氏染色,100倍油镜下观察。
(2)细菌基因组DNA提取:参照细菌基因组DNA提取试剂盒(DP302)试剂盒说明书。
(3)菌株的16SrDNA基因片段的PCR扩增及检测回收:采用细菌通用引物[2],正向引物为5′-AGA GTT TGA TCC TGG CTC AG-3′;反向引物为5′-CTA CGGCTA CCTTGTTACGA-3′。引物序列由宝生物工程(大连)有限公司合成。
将上述1.2.1.2制备的基因组DNA作为PCR扩增的模板,采用50μL反应体系(表1)进行PCR扩增。
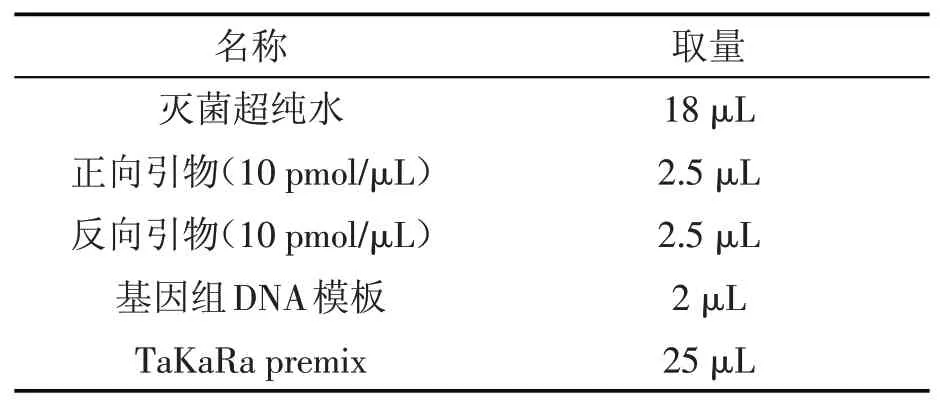
表1 PCR扩增体系
循环参数如下:94℃预变性5 min,然后进入以下30个循环,94℃变性1 min,55℃退火1 min,72℃延伸2 min,最后72℃末端延伸10 min。
PCR产物检测:扩增后取9μL的PCR产物与1μL缓冲液混合,加样于1.5%琼脂糖凝胶点样孔中,进行电泳,电压5 V/cm,电泳液为1×TAE。参考DNA回收试剂盒说明将目的条带切胶回收。
(4)细菌16SrDNA序列测定:由北京六合华大基因科技股份有限责任公司完成。
(5)细菌16SrDNA序列比对分析:登录NCBI网站,将所得测序结果提交到GenBank数据库进行序列比对。
1.2.2 菌株体外黏附试验
(1)菌悬液的制备:使用MRS液体培养基将菌株活化,37℃摇床孵育,分别于4 h、8 h、12 h、16 h、20 h、24 h和28 h取出。6000 r/min15 min离心后留菌体沉淀,用灭菌PBS调整菌液浓度为1×108CFU/mL备用。
(2)细胞的培养:使用5%胎牛血清的DMEM/F12培养基复苏猪小肠上皮细胞,37℃,5%CO2,每天换液一次,每2 d传代,调整细胞浓度至2×105CFU/mL,接入预先置入细胞爬片的6孔细胞培养板,每孔1 mL,二氧化碳培养箱约28 h后,观察细胞至单层或80%左右进行黏附试验。
(3)细菌的黏附试验[3]:将单层细胞用灭菌的PBS(pH7.4)漂洗2~3次,每孔加l mLDMEM/F12培养液和l mL菌悬液,顺时针摇匀后继续孵育,以空白PBS为对照,不同时期菌悬液样品3孔平行,然后继续孵育120 min后,用PBS缓冲液漂洗细胞3~5次,弃除未黏附的细菌。取出细胞爬片,晾干后用甲醇固定20 min,最后进行革兰氏染色。将染色后的玻片置于100倍油镜下随机挑选25个视野,计数50个细胞上黏附的细菌数,比较细菌各生长时期黏附性强弱。
(4)细菌生长曲线的测定:MRS液体培养基中接种目标益生菌37℃摇床孵育,每两小时取样,450 nm检测不同时间的OD值,做出该菌的生长曲线。
2 结果与分析
2.1 乳酸菌的菌落形态及染色特性
如图1所示,对该3株益生菌进行革兰氏染色镜检,100倍油镜观察均为革兰氏阳性。

图1 HN菌(a)、031菌(b)、H菌(c)革兰氏染色镜检(×1000)
2.2 乳酸菌的鉴定
2.2.1 菌株16SrDNA基因片段的PCR扩增
由图2可知,3株菌株的16SrDNA基因序列长度均在约1500 bp左右,
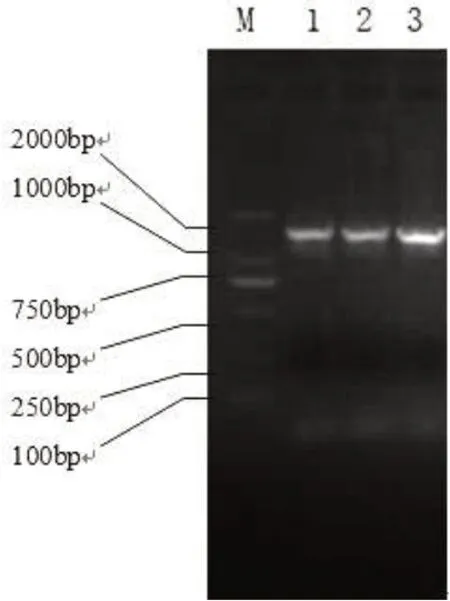
图2 PCR产物琼脂糖凝胶电泳
2.2.2 细菌16SrDNA序列比对
登陆NCBI网站,经核酸比对,菌株H,031和HN分别与唾液乳杆菌,粪肠球菌和约氏乳杆菌在核苷酸水平相似性为99%。
2.3 不同生长时期H菌对猪小肠上皮细胞的黏附性能
H菌在4 h、8 h、12 h、16 h、20 h、24 h和28 h不同生长时期对猪小肠上皮细胞的黏附见图3,均为革兰氏染色,×1000。不同生长时期H菌对猪小肠上皮细胞的黏附性能不同,其中以培育16 h和20 h的H菌黏附的个数最多(图3)。
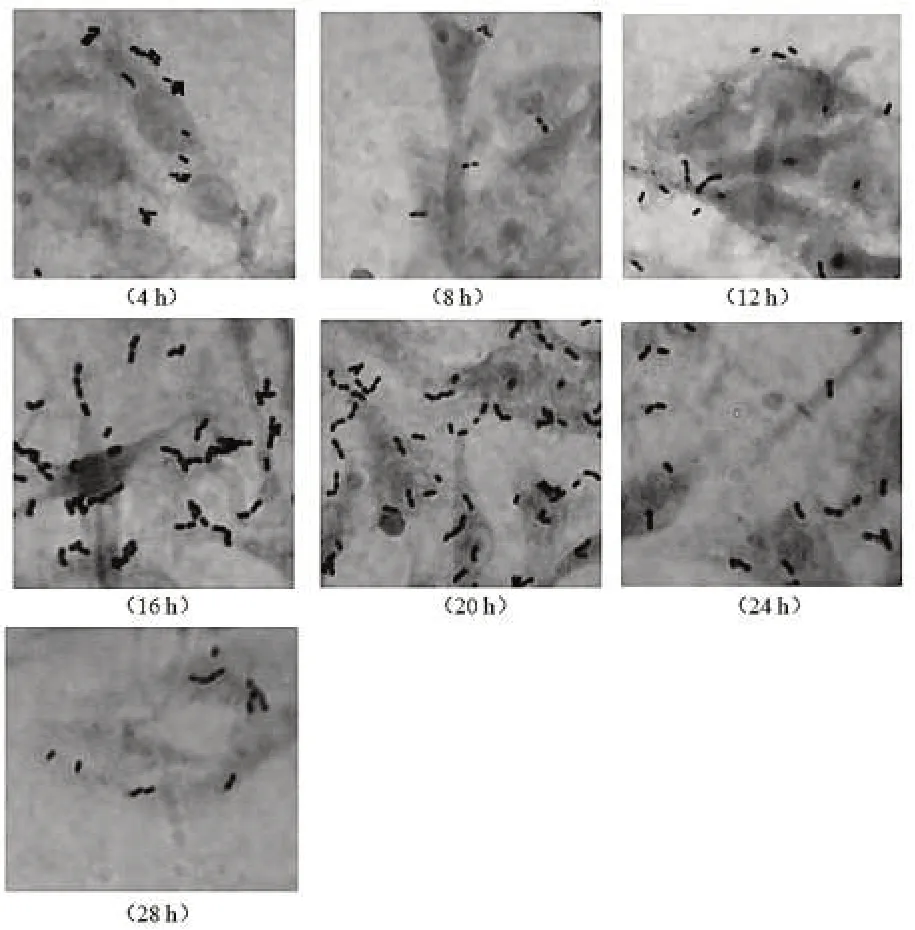
图3 孵育4 h、8 h、12 h、16 h、20 h、24 h和28 h的H菌对猪小肠上皮细胞的黏附
以50个细胞上的细菌黏附数的平均数加减其方差表示(X±S),不同时期H菌黏附数变化规律如图4所示。
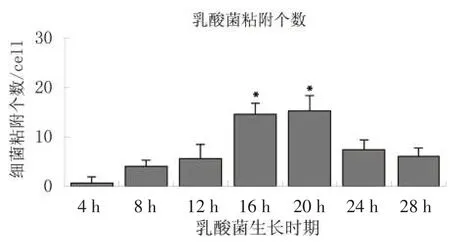
图4 不同生长时期H菌对猪小肠上皮细胞的黏附数
2.4 H菌生长曲线的测定
从图5可以看出,H菌在前8 h处于缓慢生长期,8~12 h处于对数生长期,12~28 h处于稳定期,28 h后处于衰老期。
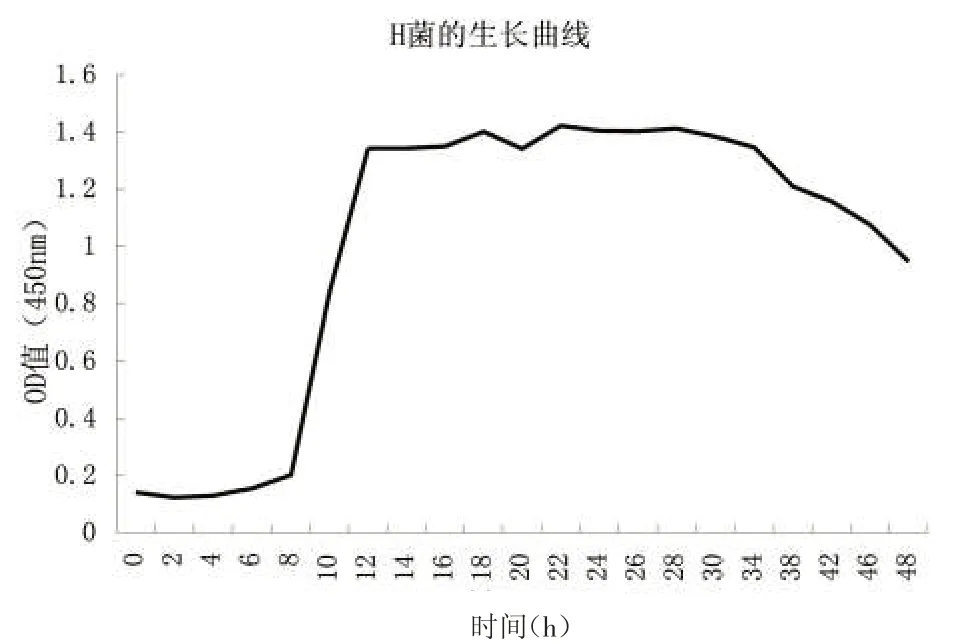
图5 H菌的生长曲线
3 讨论
3.1 乳酸菌的鉴定
经基于16SrDNA序列分析法初步确定了室验室分离保存的3株益生菌的种属。在种这个分类等级上,如果两个分类单位间的16SrRNA基因的同源性大于97.5%,则认为它们属于同一个种[4]。本研究中3株菌均具有对应16SrDNA序列相似性为99%的菌株,由此可认为,H菌为唾液乳杆菌,031菌为粪肠球菌,HN菌为约氏乳杆菌。
3.2 乳酸菌不同生长时期对猪小肠上皮细胞的黏附性
乳酸菌是应用最为广泛的益生菌种类之一,是机体肠道内的重要原生菌群,乳酸菌可以黏附定植于肠道黏膜和上皮细胞,从而形成稳定的菌群,对维持肠道微生态平衡和功能起有益作用[5,6]。乳酸菌要发挥益生作用,对肠道上皮细胞的黏附是定植及增殖的前提,因此,评估益生菌的黏附性能,是评价益生菌功能的重要指标[7、8]。试验菌株在不同生长时期黏附性差异显著(P<0.05),37℃孵育16~20 h时黏附性能最佳,通过对实验菌株生长曲线的测定我们可以得出,乳酸菌稳定期的黏附指数最高。不同生长时期菌体的形态结构、表面成分和代谢产物等均有差异,这可能是造成黏附指数差异的原因[9、10]。
