温度胁迫下卵形鲳鲹仔鱼骨骼组织病理及分子表征
2021-03-05韩明洋周胜杰杨蕊胡静马振华
韩明洋 周胜杰 杨蕊 胡静 马振华
摘要:【目的】探究不同养殖水温对卵形鲳鲹仔鱼骨骼组织病理和分子表征的影响,为进一步阐明鱼类骨骼发育的分子机理和骨骼畸形发生可能的机制提供参考依据。【方法】采用苏木精—伊红(HE)染色技术对分别在24、28和32 ℃水温下养殖一周后的卵形鲳鲹仔鱼头部和脊柱的骨骼组织进行观察,并利用原位杂交技术探究不同温度处理下骨骼发育相关基因的表达规律。【结果】随着水温的升高,卵形鲳鲹仔鱼头部软骨的细胞增大,软骨基质增多;高温下更多仔鱼的脊索向脊柱转变,软骨组织增多增大。头部骨骼中BMP2、BMP4、RUNX2、MMP9、MMP13和OCN的原位杂交信号均随水温的升高而有所增强;而在脊柱中,BMP2和BMP4的原位杂交信号随水温的升高而增強,RUNX2、MMP9和OCN在不同处理组之间的差异不明显,MMP13的信号则先增强后减弱。【结论】水温的升高会影响一系列骨骼发育相关基因的表达,进而促进卵形鲳鲹仔鱼头部骨骼的发育,在促进脊柱软骨组织增殖肥大的同时抑制脊柱的矿化。
关键词: 卵形鲳鲹;温度胁迫;骨骼发育;HE染色;原位杂交
中图分类号: S917.4 文献标志码: A 文章编号:2095-1191(2021)11-3147-10
Histopathology and molecular characterization of the skeletal tissues of golden pompano (Trachinotus ovatus) larvae
under temperature stress
HAN Ming-yang1,2,3,4, ZHOU Sheng-jie1,2,3, YANG Rui1,2,3, HU Jing1,2,3, MA Zhen-hua1,2,3*
(1South China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences, Guangzhou 510300, China; 2Key Laboratory of South China Sea Fishery Resources Exploitation and Utilization, Ministry of Agriculture and Rural Affairs,Guangzhou 510300, China; 3Sanya Tropical Fisheries Research Institute, Sanya, Hainan 572018, China; 4College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306,China)
Abstract:【Objective】 This study was conducted to investigate the histopathological effects and molecular regulatory characterization of bone development of golden pompano (Trachinotus ovatus) larvae under different breeding temperatures, and to provide support for further elucidations of the internal molecular mechanisms of bone development and malformation in fish. 【Method】 Skeletal tissues of the head and spine of the larvae were observed using hematoxylin-eosin (HE) staining after a week of farming at 24 ℃, 28 ℃, and 32 ℃. In situ hybridization was used to observe the expression of bone development-related genes. 【Result】 With an increase in temperature, enlarged chondrocytes and increased cartilage matrix were observed in the head. At the highest temperature, 32 ℃, more larval notochords transformed into spine and more spinal cartilaginous tissues were formed. The in situ hybridization signals of BMP2,BMP4,RUNX2,MMP9,MMP13 and OCN in the head were enhanced with an increase in water temperature. In the spine,the in situ hybri-dization signals of BMP2 and BMP4 were enhanced with an increase in water temperature,while the differences of RUNX2,MMP9 and OCN were not obvious between the different treatment groups. The signal of MMP13 was the strongest in the middle temperature group. 【Conclusion】 The increase in water temperature may promote the development of bone in the head of the larvae by changing the expression of bone-related genes,and inhibit the mineralization of the spine while promoting the development of the spinal cartilaginous tissues.
Key words: Trachinotus ovatus; temperature stress; skeletal development; hematoxylin-eosin staining; in situ hybridization
Foundation item:Hainan Natural Science Foundation(2019CXTD418,319QN339,319MS102); Fundamental Research Funds of Chinese Academy of Fishery Sciences(2020TD55)
0 引言
【研究意义】卵形鲳鲹(Trachinotus ovatus)又称金鲳,隶属于硬骨鱼纲(Osteichthyes)鲈形目(Perciformes)鲹科(Carangidae)鲳鲹属(Trachinotus),是一种广盐暖水性中上层鱼类(许晓娟等,2009)。由于肉嫩味美,营养价值较高,且养殖周期短,可全程使用配合饲料,卵形鲳鲹已成为我国华南沿海重要的海水养殖鱼类之一,生产规模不断加大且畅销海内外(刘锡强等,2014;黄倩倩等,2019;孙莘溢等,2019)。但在人工育苗过程中的畸形率较高,甚至达到33%,是制约卵形鲳鲹苗种培育和养殖规模进一步扩大的主要因素(郑攀龙,2015)。仔、稚鱼骨骼畸形是鱼类苗种繁育过程中的常见问题之一。相对成鱼而言,仔、稚鱼的发育对外界因素更加敏感,环境和营养等因素均可能导致高畸形率的发生,在人工养殖条件下鱼苗骨骼畸形发生更为常见(刘康等,2011;郑珂等,2016)。骨骼发育异常会降低仔鱼的运动和进食能力并提高其应激敏感性,从而导致鱼苗质量下降,死亡率上升(Cahu et al.,2003;张书剑,2008)。温度能影响鱼类等变温动物的存活、生长、摄食和繁殖,在鱼体的新陈代谢等所有生理生化过程中起着重要的控制作用(李文龙等,2017;Sun et al.,2019;Zhou et al.,2019),是影响鱼类苗种培育重要的环境因素之一。相关研究认为,水温会影响鱼的骨骼发育,过高或过低的水温均会增加骨骼畸形率和死亡率(Ludwig and Lochmann,2009;Yang et al.,2016)。加强对卵形鲳鲹骨骼发育的研究,探讨养殖水温等环境因素对骨骼发育的影响,可丰富脊椎动物骨骼发育生物学的基础理论,对优化养殖方案以减少骨骼畸形带来的经济损失具有重要意义。【前人研究进展】目前,国内外学者已对大黄鱼(La-rimichthys crocea)(王秋荣等,2010)、塞内加尔鳎(Solea senegalensis)(Boglino et al.,2012)、刀鲚(Coilia nasus)(張宗锋等,2015)、美洲鲥(Alosa sapidissima)(邓平平等,2017)、鞍带石斑鱼(Epinephelus lanceolatus)(吕雪娇等,2018)、尖吻鲈(Lates calcarifer)(周胜杰等,2018)和银鳕鱼(Anoplopoma fimbria)(Deary et al.,2019)等不同鱼类的骨骼形态和发育进行了研究,并揭示了影响骨骼发育的因素,主要包括遗传、营养和环境因素等(Cobcroft et al.,2004;黄超等,2013;郑珂等,2016)。温度作为水产养殖的重要环境因素之一,不适宜的温度可能导致鱼体生理机能的紊乱,造成生长异常及疾病发生,因此温度与鱼类骨骼发育的关系受到重视(Chen et al.,2002)。大西洋鲑鱼(Salmo salar)在高温下饲养脊椎畸形率超过28%(Ytteborg et al.,2010a);不同的温度变化会造成金头鲷(Sparus aurata)的鳃盖、脊柱、尾鳍和背鳍的畸形(Georgakopoulou et al.,2010);温度高于18 ℃会导致塞内加尔鳎的脊柱畸形率升高(Dionisio et al.,2012)。【本研究切入点】骨骼形成是一个通过涉及细胞外基质成分、信号分子和转录因子高度调节的分子途径的复杂过程(Karsenty,2000)。目前,关于卵形鲳鲹的骨骼发育和畸形已有一些研究,如郑攀龙等(2014)、郑攀龙(2015)对卵形鲳鲹的骨骼发育时序以及温度和营养对卵形鲳鲹骨骼畸形的影响进行了研究;Ma等(2016,2017b)对不同水温或营养条件下卵形鲳鲹的颌骨畸形发生以及骨形态发生蛋白基因进行了研究,Sox家族等骨骼发育相关的基因也被初步了解(Ma et al.,2017a);Sun等(2020)评估了在集约化养殖系统中,卵形鲳鲹早期发育阶段骨骼畸形的类型和频率。然而,未见卵形鲳鲹在温度胁迫下骨骼组织病理学的相关报道,温度调控卵形鲳鲹骨骼发育的分子机制尚不明确。【拟解决的关键问题】采用苏木精—伊红(HE)染色探讨温度对卵形鲳鲹仔鱼骨骼组织的影响,采用原位杂交技术观察不同温度处理下骨骼发育调控基因的表达,旨在揭示卵形鲳鲹仔鱼骨骼发育的分子机理及温度对仔鱼骨骼发育的内在调控机制,进一步丰富脊椎动物骨骼发育生物学理论。
1 材料与方法
1. 1 试验材料
同批卵形鲳鲹的受精卵从海南省陵水县某养殖场取得,运至中国水产科学研究院南海水产研究所热带水产研究开发中心孵化。孵化后第2 d将仔鱼转至9个500 L循环海水玻璃纤维缸中,密度为60尾/L,盐度保持在(32±1)‰,溶解氧保持在6.7±0.2 mg/L,pH 7.7~8.1,每天投喂2次,及时吸污清底以保持水体清洁。
主要试剂包括无水乙醇、二甲苯、苏木素—伊红染液、盐酸、氨水、中性树胶、4%多聚甲醛(DEPC水)、石蜡、甲醇、双氧水、PBS缓冲液(由DEPC水配制)、20×SSC洗脱液、BSA、10×蛋白酶K储存液、杂交缓冲液、鼠抗地高辛标记过氧化物酶(anti-DIG-HRP)和DAB显色剂。
主要仪器设备:脱水机(JJ-12J,武汉俊杰电子有限公司)、包埋机(JB-P5,武汉俊杰电子有限公司)、病理切片机(RM2016,上海徕卡仪器有限公司)、冻台(JB-L5,武汉俊杰电子有限公司)、组织摊片机(KD-P,浙江省金华市科迪仪器设备有限公司)、烤箱(DHG-9140A,上海慧泰仪器制造有限公司)、正置光学显微镜(NIKON ECLIPSE CI,日本尼康)、成像系统(NIKON DS-U3,日本尼康)、摇床(钟摆式,TSY-B,Servicebio)、涡旋混匀器(MX-F,Servicebio)、Gene tech pen(GT1001,Gene tech)、恒温箱(LGF-070A,武汉奥普森试验设备有限公司)和高压灭菌锅(SYQ-DSX-280B,上海申安医疗器械厂)。
1. 2 试验设计
分为3个试验组,分别为低温组(LT,24 ℃)、中温组(MT,28 ℃)和高温组(HT,32 ℃),每个试验组设3个平行。养殖一周后对3组分别取样,每缸各取10尾仔鱼分别置于4%多聚甲醛中用于组织病理切片,另各取10尾通过液氮速冻后置于超低温冰箱 -80 ℃保存用于原位杂交。
1. 3 组织切片制备及观察
用4%多聚甲醛将仔鱼固定24 h以上,经脱水和常规石蜡包埋后进行切片,片厚4 μm。脱蜡后采用苏木精—伊红进行染色,即切片入Harris苏木素染色3~8 min,自来水冲洗,1%盐酸酒精分化数秒,自来水冲洗,0.6%氨水返蓝,流水冲洗,入伊红染液中染色1~3 min,脱水封片后进行显微镜镜检和图像采集分析。染色结果中细胞核蓝色,细胞质红色。
1. 4 显色原位杂交检测
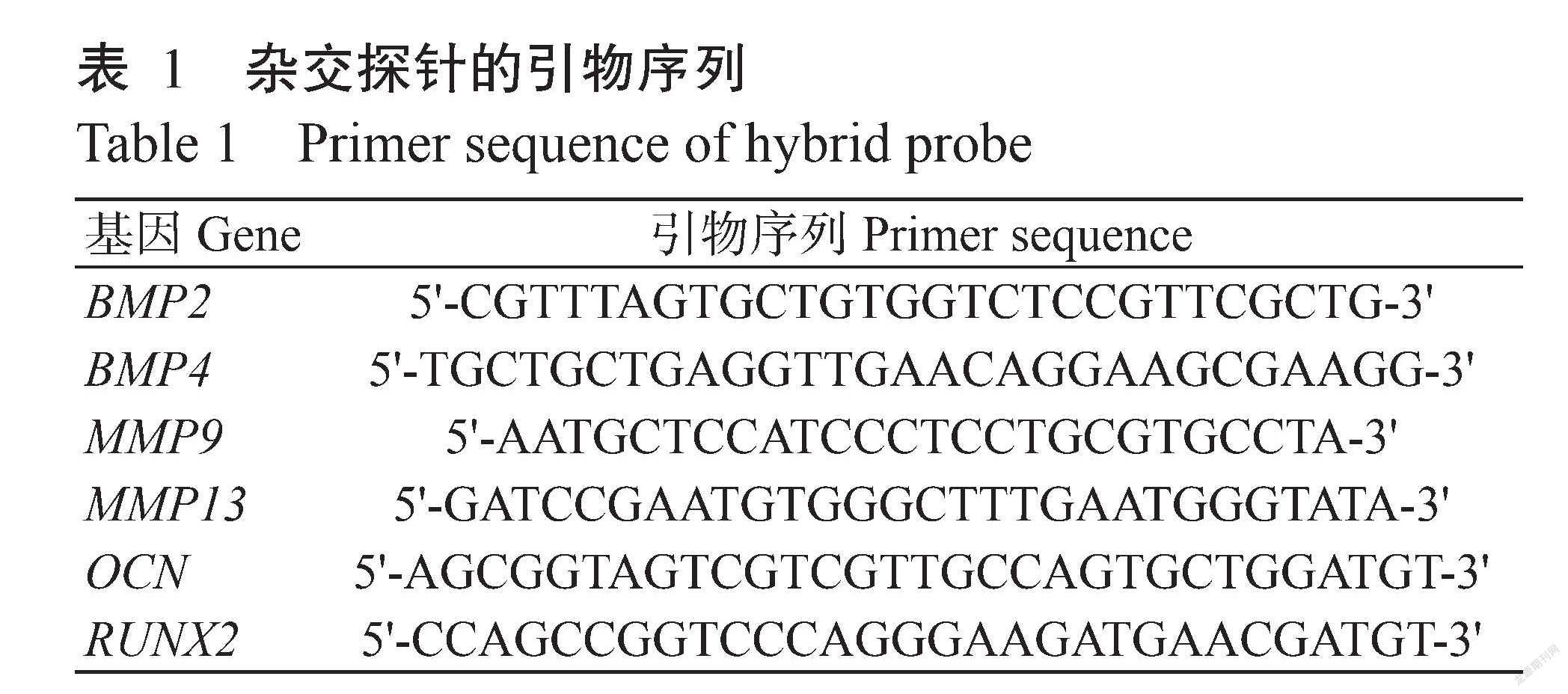
将样品取出洗净后立即放入固定液(DEPC水配制)中固定12 h,完成后经梯度酒精脫水,进行浸蜡包埋和切片;依次将切片放入二甲苯Ⅰ 15 min、二甲苯Ⅱ 15 min、无水乙醇Ⅰ 5 min、无水乙醇Ⅱ 5 min、85%酒精5 min、75%酒精5 min、DEPC水洗,滴加蛋白酶K(20 μg/mL)37 ℃消化30 min,纯水冲洗后PBS洗3次,每次5 min;滴加3%甲醇-H2O2,室温避光孵育15 min,将玻片置于PBS中,在脱色摇床上晃动洗涤3次,每次5 min;滴加预杂交液,37 ℃孵育1 h后倾去预杂交液,滴加含探针杂交液,恒温箱37 ℃杂交过夜;用SSC洗去杂交液,滴加BSA,室温30 min后倾去,滴加鼠抗地高辛标记过氧化物酶,37 ℃孵育40 min后,PBS洗4次,每次5 min;切片稍甩干后,在圈内滴加新鲜配制的DAB显色液,显微镜下控制显色时间,阳性为棕黄色,纯水冲洗切片终止显色。加Harris苏木素复染3 min左右,自来水冲洗,1%盐酸酒精分化数秒,自来水冲洗,氨水返蓝,流水冲洗。最后脱水封片,进行显微镜检和图像采集分析。根据前期转录组测序数据所得卵形鲳鲹的骨形态发生蛋白(BMP2和BMP4)、钙骨素(OCN)、侏儒相关转录因子2(RUNX2)和基质金属蛋白(MMP9和MMP13)基因序列设计杂交所用探针(表1)。
2 结果与分析
2. 1 组织病理学观察结果
由图1可知,低温组中,部分卵形鲳鲹仔鱼头部的软骨基质染色较浅(图1-A),脊索处未出现明显软骨组织分化(图1-B);中温组中,头部的软骨基质增多,染色较深(图1-C),而锥体后部存在少量脉棘软骨组织,软骨细胞较小,软骨基质较少(图1-D);高温组中,头部的软骨基质染色最深,软骨骨膜增厚(图1-E),锥体存在较多软骨组织,细胞增大增多,软骨基质明显增多且颜色较深(图1-F)。
2. 2 骨骼发育相关基因在仔鱼骨系组织中的表达
原位杂交结果显示,BMP2在卵形鲳鲹仔鱼头部软骨的软骨膜和软骨基质中观察到阳性杂交信号,当温度从24 ℃升至32 ℃时,棕黄色阳性信号加强(图2-A~图2-C);在脊椎中的阳性信号同样随着温度的升高而增强(图3-A~图3-C)。头部软骨中BMP4的杂交信号在低温组和中温组中较弱且差异不明显,在高温组中杂交信号有所增强(图2-D~图2-F);在脊柱中BMP4的杂交信号随着温度的升高而增强(图3-D~图3-F)。RUNX2在头部软骨的软骨膜中存在阳性信号,中温组和高温组的阳性信号较低温组稍强(图2-G~图2-I);脊柱中RUNX2的杂交信号较弱,且在不同温度处理组之间差异不明显(图3-G~图3-I)。MMP9在头部软骨中阳性信号明显,在高温组中的信号稍强于低温组和中温组(图4-A~图4-C);其在脊柱中的信号在不同温度组之间差异并不明显,且在高温组中稍弱(图5-A~图5-C)。对于MMP13而言,头部软骨中高温组的阳性信号稍强于低温组和中温组(图4-D~图4-F),而在脊柱中中温组的阳性信号最强,在低温组和高温组中信号则较弱(图5-D~图5-F)。OCN在头部软骨中阳性信号随着温度的升高而增强(图4-G~图4-I),而在脊柱中阳性信号在不同处理组之间无明显区别(图5-G~图5-I)。
3 讨论
3. 1 不同温度处理对卵形鲳鲹仔鱼骨骼组织病理变化的影响
鱼类骨骼发育主要涉及软骨细胞、成骨细胞和破骨细胞的综合作用。骨形成包括膜内成骨和软骨内成骨2种方式,胚胎时期大多数骨以软骨内成骨方式发生,软骨组织逐渐被骨组织替代,涉及软骨的生长与退化以及成骨和破骨的平衡过程等(孙冬梅,2009)。由于软骨细胞和成骨细胞在软骨形成过程中具有交互作用,使得骨和软骨发育中遗传相互作用的研究复杂化。通常人们通过直接观察法、micro CT、X光透视和茜素红—阿利新蓝双染色等方法对鱼类骨骼进行观察研究(张宁等,2012;万世明等,2014;郑攀龙等,2014;周胜杰等,2018),尤其是茜素红—阿利新蓝双染色法的出现和不断完善,对鱼类早期软、硬骨发育研究起到了极大的促进作用(陈渊戈等,2011)。现代细胞和分子生物学、组织学和组织化学等学科及技术不断发展,为深入研究仔鱼骨骼发育和探索各种因素对骨骼发育的调控机制等提供了新思路和条件。
针对哺乳动物的研究已表明,脊柱畸形发生过程中伴随骨形态和骨细胞密度改变、成骨细胞变薄及细胞增殖和细胞死亡等形态学变化(Urban and Roberts,2003)。观察仔鱼骨骼组织形态的变化,是研究骨骼生长和骨骼畸形发生的重要方法。郑攀龙(2015)对卵形鲳鲹仔鱼骨骼发育的研究表明,其颌骨在孵化后第3 d已开始分化,在孵化后11 d颌骨基本完成矿化;而脊柱在孵化后7~9 d开始发育,出现髓棘和脉棘等并逐渐矿化,脊柱畸形的发生率也开始增多。本研究中,卵形鲳鲹仔鱼孵化后8 d,在中温组和高温组中仔鱼椎体血液区出现脉棘软骨组织,在32 ℃条件下,部分仔鱼软骨细胞肥大且排列无序,软骨基质钙化更明显;头部的软骨钙化也随温度升高而加强。Ytteborg等(2010b)发现高温导致大西洋鲑鱼椎体融合畸形的增加,脊柱观察结果表明其软骨细胞呈现增殖旺盛且排列无序等特点,成骨细胞生长区与软骨细胞区之间的边界不明显,椎间隙出现矿化。本研究结果与其存在相似,表明温度的升高可能对卵形鲳鲹头部骨骼的发育起到促进作用,在促进椎体软骨发育的同时抑制其骨化进程,改变原有的骨骼发育顺序进程。这可能是异常温度诱导仔、稚鱼骨骼畸形发生的原因之一。
3. 2 不同温度处理对卵形鲳鲹仔鱼骨骼发育相关基因的影响
3. 2. 1 信号分子和转录因子 骨形态发生蛋白(BMPs)是一类属于TGF-β超家族的多功能生长因子,参与细胞增殖、存活、分化和凋亡的调控(Xiao et al.,2007),是骨骼发育的重要调控因子。BMP2通过诱导RUNX2等转录因子在未分化间质细胞中的表达,促进软骨和成骨细胞的分化,促使非骨系细胞逆分化为骨系细胞(郁卫东和秦书俭,2000;Carreira et al.,2014),促进基质钙化。BMP2对于软骨内骨形成是不可或缺的,被认为是软骨内骨发育过程中软骨细胞增殖和成熟的主要因素(Shu et al.,2011)。软骨细胞特异性敲除BMP2会导致严重的软骨发育不良表型,如通过对斑马鱼(Danio rerio)BMP2基因进行敲降后发现,RUNX2等成骨相关基因的表达降低,斑马鱼的骨发育受到抑制(姜宇等,2019)。BMP4可诱导未分化间质干细胞向软骨细胞的分化成熟,促使软骨基质的增多(Nishimura et al.,2012;叶娜等,2017),影响骨骼的发育和重塑。在罗非鱼(Oreochromis mossambicus)和鲤鱼(Cyprinus carpio)肌肉中,BMP4的表达会影响肌间骨的分布(Su and Dong,2018)。Ytteborg等(2010a)探究了大西洋鲑鱼脊柱中骨骼发育相关基因在不同饲养温度下的表达差异,结果表明高饲养水温下BMP2和BMP4的表达增强。Ma等(2016)的研究结果表明,BMP2和BMP4在卵形鲳鲹仔鱼的转录水平同样会随着温度的升高而增强,仔鱼的颌骨畸形发生率也随之增加。本研究结果表明,温度的升高会导致卵形鲳鲹仔鱼头部和脊柱软骨组织中BMP2和BMP4的表达增强。该结果进一步验证了Ma等(2016)的推测,温度可能通过上调BMP2和BMP4的表达而影响仔鱼的头部和脊柱骨骼发育。RUNX2的表达可影响软骨细胞的增殖和成熟以及成骨细胞的分化(徐婧等,2016)。在本研究中,RUNX2在卵形鯧鲹仔鱼头部骨骼中的表达同样随着温度的升高而增强,与BMPs的表达相一致。
3. 2. 2 细胞外基质成分 细胞外基质(ECM)主要由胶原、蛋白多糖、糖蛋白、糖胺多糖和弹力纤维等五大类物质组成,其动态变化与鱼类发育、组织修复等生理过程密切相关(袁发焕,2000;Pedersen et al.,2015)。基质金属蛋白酶(MMPs)是一类生物发育所必需的因子,也是参与ECM降解的重要蛋白酶,可帮助细胞迁移、增殖和细胞间的交流(Rajaram et al.,2016)。MMP9和MMP13是MMPs家族中的2个重要成员。MMP9是肥大软骨细胞生长板血管生成和细胞凋亡的关键调节因子,MMP13则能调节肥大软骨基质重塑,缺失会导致软骨内骨化延迟(Vu et al.,1998;Stickens et al.,2004)。本研究中,MMP9和MMP13在高温组卵形鲳鲹仔鱼头部软骨中的表达信号较强,说明温度可能会增强卵形鲳鲹仔鱼头部骨骼的重塑过程。对哺乳动物研究发现,MMP13与骨性关节炎等疾病有关,该基因在患关节炎的动物中表达上调,进而增加骨重塑和细胞外基质降解(Takaishi et al.,2008)。Wargelius等(2010)研究认为,MMP13的表达可能是养殖大西洋鲑鱼ECM重塑增加和脊椎压缩的早期迹象,其表达的增加会导致锥体结构和矿物质含量的改变,导致压缩脊椎的发生。Ytteborg等(2010a)研究则表明,高的养殖水温会导致大西洋鲑鱼脊柱中MMP9和MMP13表达的下调。本研究中,卵形鲳鲹仔鱼脊柱中MMP13在高温组中的信号弱于中温组,表明高温可能抑制了脊柱的软骨内骨化进程。脊柱中MMP13在高温下的低表达还可能与BMP4的负向调节有关(Otto et al.,2007)。OCN是骨代谢的标志物之一,与骨基质的矿化有关(Al Rifai et al.,2017;苏晓慧和李维辛,2020)。本研究中,卵形鲳鲹仔鱼头部骨骼中OCN的信号随着温度的升高而增强,脊柱中OCN的信号在不同处理组间差异不明显。同样表明温度可能促进头部骨骼的矿化,同时抑制脊柱的软骨内骨化进程。头部骨骼与脊柱中骨骼发育相关基因呈现不同的表达规律,可能与骨骼发育时序有关,而温度的改变会导致仔鱼骨骼发育时序发生变化(郑珂等,2016)。
4 结论
水温升高可能通过改变一系列骨骼发育相关基因的表达,进而促进卵形鲳鲹仔鱼头部骨骼的发育,在促进脊柱软骨组织发育的同时抑制脊柱的矿化。
参考文献:
陈渊戈,夏冬,钟俊生,赵盛龙,张宇. 2011. 刀鲚仔稚鱼脊柱和附肢骨骼发育[J]. 上海海洋大学学报,20(2):217-223. [Chen Y G,Xia D,Zhong J S,Zhao S L,Zhang Y. 2011. Development of the vertebral column and the appendicular skeleton in the larvae and juveniles of Coilia nasus[J]. Journal of Shanghai Ocean University,20(2):217-223.]
邓平平,施永海,徐嘉波,严银龙,谢永德,刘永士,张宗锋. 2017. 美洲鲥仔稚鱼脊柱及附肢骨骼系统的早期发育[J]. 中国水产科学,24(1):73-81. [Deng P P,Shi Y H,Xu J B,Yan Y L,Xie Y D,Liu Y S,Zhang Z F. 2017. Early development of the vertebral column and appendi-cular skeleton of Alosa sapidissima[J]. Journal of Fishery Sciences of China,24(1):73-81.] doi:10.3724/SP.J.1118. 2017.16080.
黄超,谭肖英,罗智. 2013. 鱼类仔稚鱼骨骼发育的研究进展[J]. 当代水产,38(3):74-76. [Huang C,Tan X Y,Luo Z. 2013. Research progress on skeletal development of juvenile and juvenile fishes[J]. Current Fisheries,38(3):74-76.] doi:10.3969/j.issn.1674-9049.2013.03.017.
黄倩倩,林黑着,周传朋,黄忠,杨育凯,虞为,黄小林,何嘉奇. 2019. 卵形鲳鲹幼鱼对维生素B2的需要量[J]. 南方水产科学,15(1):69-76. [Huang Q Q,Lin H Z,Zhou C P,Huang Z,Yang Y K,Yu W,Huang X L,He J Q. 2019. Vitamin B2 requirement of juvenile golden pompano (Trachinotus ovatus)[J]. South China Fisheries Science,15(1):69-76.] doi:10.12131/20180065.
姜宇,王亮,朱国兴,徐又佳. 2019. 斑马鱼中骨形态发生蛋白2a敲降对骨代谢的影响[J]. 中华骨质疏松和骨矿盐疾病杂志,12(2):165-171. [Jiang Y,Wang L,Zhu G X,Xu Y J. 2019. Effects on osteoblasts by bone morphgenetic protein 2a knoched down in zebrafish[J]. Chinese Journal of Osteoporosis and Bone Mineral Research,12(2):165-171.] doi:10.3969/j.issn.1674-2591.2019.02.010.
李文龙,梁兴明,梁萌青,张天时,孙德强. 2017. 温度对大菱鲆幼鱼生长及免疫相关酶活性的影响[J]. 水产科学,36(3):311-316. [Li W L,Liang X M,Liang M Q,Zhang T S,Sun D Q. 2017. Effects of temperature on growth and enzyme activity related to immunity in juvenile turbot Scophthalmus maximus[J]. Fisheries Science,36(3):311-316.] doi:10.16378/j.cnki.1003-1111.2017.03.009.
刘康,张璐,刘丽燕,马学坤,刘贤敏,刘晋,庞观宏,曾凡归. 2011. 简述鱼类骨骼畸形及其诱因[J]. 广东饲料,20(4):46-48. [Liu K,Zhang L,Liu L Y,Ma X K,Liu X M,Liu J,Pang G H,Zeng F G. 2011. Description of fish skeletal deformities and its incentives[J]. Guangdong Feed,20(4):46-48.] doi:10.3969/j.issn.1005-8613.2011.04.016.
刘锡强,马学坤,刘康,蒋焕超. 2014. 华南地区金鲳鱼养殖报告[J]. 当代水产,39(2):26-29. [Liu X Q,Ma X K,Liu K,Jiang H C. 2014. Report on golden pompano farming in South China[J]. Current Fisheries, 39(2):26-29.] doi:10.3969/j.issn.1674-9049.2014.02.002.
呂雪娇,王雨浓,刘清华,翟介明,李军. 2018. 鞍带石斑鱼仔稚幼鱼骨骼发育与生长特性研究[J]. 海洋科学,42(5):116-121. [Lü X J,Wang Y N,Liu Q H,Zhai J M,Li J. 2018. Research on skeletal development and allometric growth in larval and juvenile Epinephelus lanceolatus[J]. Marine Sciences,42(5):116-121.] doi:10.11759//hykx20180308002.
苏晓慧,李维辛. 2020. 骨钙素在老年2型糖尿病患者中的血糖调控作用及其影响因素研究[J]. 中国全科医学,23(17):2157-2163. [Su X H,Li W X. 2020. Actions of osteocalcin in glucose metabolism and influencing factors in elderly patients with type 2 diabetes[J]. Chinese Ge-neral Practice,23(17):2157-2163.] doi:10.12114/j.issn. 1007-9572.2020.00.333.
孙冬梅. 2009. 决定骨骼发育的转录因子的转录调控机制的研究[D]. 长春:东北师范大学. [Sun D M. 2009. The study of the transcriptional regulatory mechanisms of transcription factors that determine bone development[D]. Changchun:Northeast Normal University.]
孙莘溢,黄小林,黄忠,曹晓聪,周婷,林黑着,舒琥,虞为,杨育凯,李涛. 2019. 卵形鲳鲹摄食、耗氧节律和胃肠排空时间的研究[J]. 南方水产科学,15(5):77-83. [Sun X Y,Huang X L,Huang Z,Cao X C,Zhou T,Lin H Z,Shu H,Yu W,Yang Y K,Li T. 2019. Diet feeding,oxygen consumption rhythm and gastrointestinal evacuation time of Trachinotus ovatus[J]. South China Fisheries Science,15(5):77-83.] doi:10.12131/20190072.
万世明,易少奎,仲嘉,王卫民,蒋恩明,陈柏湘,高泽霞. 2014. 团头鲂肌间骨发育的形态学观察[J]. 水生生物学报,38(6):1143-1151. [Wan S M,Yi S K,Zhong J,Wang W M,Jiang E M,Chen B X,Gao Z X. 2014. Developmental and morphological observation of intermuscular bones in Megalobrama amblycephala[J]. Acta Hydrobiologica Sinica,38(6):1143-1151.] doi:10.7541/2014. 166.
王秋荣,倪玥莹,林利民,王志勇. 2010. 大黄鱼仔稚鱼脊柱、胸鳍及尾鳍骨骼系统的发育观察[J]. 水生生物学报,34(3):467-472. [Wang Q R,Ni Y Y,Lin L M,Wang Z Y. 2010. Development of the vertebral column and the pectoral and caudal fins in larvae of the large yellow croa-ker Larimichthys crocea(Richardson)[J]. Acta Hydrobiologica Sinica,34(3):467-472.] doi:10.3724/SP.J.1035.2010. 00467.
徐婧,李蜀光,王麗艳,施亮. 2016. 骨形成相关基因的研究进展[J]. 医学综述,22(18):3572-3575. [Xu J,Li S G,Wang L Y,Shi L. 2016. Research development of bone formation related genes[J]. Medical Recapitulate,22(18):3572-3575.] doi:10. 3969/j.issn.1006-2084.2016.18.010.
许晓娟,李加儿,区又君. 2009. 盐度对卵形鲳鲹胚胎发育和早期仔鱼的影响[J]. 南方水产,5(6):31-35. [Xu X J,Li J E,Ou Y J. 2009. Effects of salinity on embryonic development and early larvae in ovate pompano Trachinotus ovatus[J]. South China Fisheries Science,5(6):31-35.] doi:10.3969/j.issn.1673-2227.2009.06.006.
叶娜,戚基萍,吴鹤. 2017. 骨形态发生蛋白4的相关研究进展[J]. 医学综述,23(5):872-876. [Ye N,Qi J P,Wu H. 2017. Research progress of bone morphogenetic protein 4[J]. Medical Recapitulate,23(5):872-876.] doi:10.3969/j.issn. 1006-2084.2017.05.009.
郁卫东,秦书俭. 2000. 骨形态发生蛋白-2在骨形成过程中的作用机制[J]. 中国临床解剖学杂志,18(1):82-83. [Yu W D,Qin S J. 2000. The functional mechanism of BMP-2 in osteogentic process[J]. Chinese Journal of Clinical Anatomy,18(1):82-83.] doi:10.3969/j.issn.1001-165X. 2000.01.036.
袁发焕. 2000. 细胞外基质、基质金属蛋白酶及其抑制因子的研究进展[J]. 国外医学(临床生物化学与检验学分册),21(2):62-65. [Yuan F H. 2000. Research progress of extracellular matrix,matrix metalloproteinases and their inhibitors[J]. Foreign Medical Sciences,21(2):62-65.] doi:10.3969/j.issn.1673-4130.2000.02.003.
張宁,苏胜彦,董在杰,马庆男,袁新华. 2012. 基于micro CT扫描技术的鲤骨骼和显微结构分析[J]. 南方水产科学,8(6):44-49. [Zhang N,Su S Y,Dong Z J,Ma Q N,Yuan X H. 2012. Study on bone and microstructure of common carp using micro CT scanning[J]. South China Fi-sheries Science,8(6):44-49.] doi:10.3969/j.issn.2095-0780.2012.06.007.
张书剑. 2008. 各种营养素对鱼类骨骼健康的影响[J]. 饲料研究,(1):7-10. [Zhang S J. 2008. Effects of various nutrients on bone health of fish[J]. Feed Research,(1):7-10.] doi:10.13557/j.cnki.issn1002-2813.2008.01.022.
张宗锋,施永海,张根玉,张海明,严银龙,刘永士. 2015. 刀鲚脊柱及附肢骨骼早期发育研究[J]. 水产科技情报,42(4):175-178. [Zhang Z F,Shi Y H,Zhang G Y,Zhang H M,Yan Y L,Liu Y S. 2015. Study on the early deve-lopment of spine and appendage bone of Coilia nasus[J]. Fisheries Science & Technology Information,42(4):175-178.] doi:10.16446/j.cnki.1001-1994.2015.04.002.
郑珂,岳昊,郑攀龙,马振华. 2016. 海水养殖鱼类仔、稚鱼骨骼发育与畸形发生[J]. 中国水产科学,23(1):250-261. [Zheng K,Yue H,Zheng P L,Ma Z H. 2016. Skeletal ontogeny and deformities in commercially cultured marine fish larvae[J]. Journal of Fishery Sciences of China,23(1):250-261.] doi:10.3724/SP.J.1118.2016.15226.
郑攀龙,马振华,郭华阳,李有宁,张殿昌,江世贵. 2014. 卵形鲳鲹尾部骨骼胚后发育研究[J]. 南方水产科学,10(5):45-50. [Zheng P L,Ma Z H,Guo H Y,Li Y N,Zhang D C,Jiang S G. 2014. Ontogenetic development of caudal skeletons in Trachinotus ovatus larvae[J]. South China Fisheries Science,10(5):45-50.] doi:10.3969/j.issn.2095- 0780.2014.05.007.
郑攀龙. 2015. 卵形鲳鲹仔稚鱼骨骼发育及骨骼畸形研究 [D]. 上海:上海海洋大学. [Zheng P L. 2015. Skeletal ontogeny and malformation of golden pompano Trachinotus ovatus larvae[D]. Shanghai:Shanghai Ocean University.]
周胜杰,马婷,胡静,马振华,杨其彬,陈旭,杨蕊,刘亚娟,孟祥君. 2018. 尖吻鲈仔鱼骨骼发育观察[J]. 南方农业学报,49(3):592-598. [Zhou S J,Ma T,Hu J,Ma Z H,Yang Q B,Chen X,Yang R,Liu Y J,Meng X J. 2018. Skeleton development observation of Lates calcarifer larva fish[J]. Journal of Southern Agriculture,49(3):592-598.] doi:10.3969/j.issn.2095-1191.2018.03.27.
Al Rifai O,Chow J,Lacombe J,Julien C,Faubert D,Susan-Resiga D,Essalmani R,Creemers J W M,Seidah N G,Ferron M. 2017. Proprotein convertase furin regulates osteocalcin and bone endocrine function[J]. Journal of Clinical Investigation,127(11):4104-4117. doi:10.1172/jci93437.
Boglino A,Jose Darias M,Ortiz-Delgado J B,Oezcan F,Estevez A,Andree K B,Hontoria F,Sarasquete C,Gisbert E. 2012. Commercial products for Artemia enrichment affect growth performance,digestive system maturation,ossification and incidence of skeletal deformities in Senegalese sole(Solea senegalensis) larvae[J]. Aquaculture,324-325:290-302. doi:10.1016/j.aquaculture.2011.11.018.
Cahu C,Infante Z J,Takeuchi T. 2003. Nutritional components affecting skeletal development in fish larvae[J]. Aquaculture,227(1-4):245-258. doi:10.1016/s0044-8486(03)00507-6.
Carreira A C,Lojudice F H,Halcsik E,Navarro R D,Sogayar M C,Granjeiro J M. 2014. Bone morphogenetic proteins:Facts,challenges,and future perspectives[J]. Journal of Dental Research,93(4):335-345. doi:10.1177/002203 4513518561.
Chen W H,Sun L T,Tsai C L,Song Y L,Chang C F. 2002. Cold-stress induced the modulation of catecholamines,cortisol,immunoglobulin M, and leukocyte phagocytosis in tilapia[J]. General and Comparative Endocrinology,126(1):90-100. doi:10.1006/gcen.2001.7772.
Cobcroft J M,Pankhurst P M,Poortenaar C,Hickman B,Tait M. 2004. Jaw malformation in cultured yellowtail kingfish (Seriola lalandi) larvae[J]. New Zealand Journal of Marine and Freshwater Research,38(1):67-71. doi:10. 1080/00288330.2004.9517218.
Deary A L,Porter S M,Dougherty A B,Duffy-Anderson J T. 2019. Preliminary observations of the skeletal development in pre-flexion larvae of sablefish Anoplopoma fimbria[J]. Ichthyological Research,66(1):177-182. doi:10.1007/s10228-018-0657-0.
Dionisio G,Campos C,Valente L M P,Conceicao L E C,Cancela M L,Gavaia P J. 2012. Effect of egg incubation temperature on the occurrence of skeletal deformities in Solea senegalensis[J]. Journal of Applied Ichthyology,28(3):471-476. doi:10.1111/j.1439-0426.2012.01996.x.
Georgakopoulou E,Katharios P,Divanach P,Koumoundouros G. 2010. Effect of temperature on the development of skeletal deformities in Gilthead seabream(Sparus aurata Linnaeus,1758)[J]. Aquaculture,308(1-2):13-19. doi:10.1016/j.aquaculture.2010.08.006.
Karsenty G. 2000. Bone formation and factors affecting this process[J]. Matrix Biology,19(2):85-89. doi:10.1016/S0945-053X(00)00053-6.
Ludwig G M,Lochmann S E. 2009. Effect of temperature on larval sunshine bass growth and survival to the fingerling stage[J]. North American Journal of Aquaculture,71(3):260-266. doi:10.1577/a08-057.1.
Ma Z H,Fu M J,Peng X Y,Qin J G. 2017a. Expression of Sox5,Sox8 and Sox9 genes in golden pompano Trachinotus ovatus(Linnaeus 1758) larvae during ontogeny and in response to water temperature[J]. Israeli Journal of Aquaculture-Bamidgeh,69. doi:10.46989/001c.20891.
Ma Z H,Hu J,Yu G,Qin J G. 2017b. Gene expression of bone morphogenetic proteins and jaw malformation in golden pompano Trachinotus ovatus larvae in different feeding regimes[J]. Journal of Applied Animal Research,46(1):164-177. doi:10.1080/09712119.2017.1282371.
Ma Z H,Zhang N,Qin J G,Fu M J,Jiang S G. 2016. Water temperature induces jaw deformity and bone morphogenetic proteins (BMPs) gene expression in golden pompano Trachinotus ovatus larvae[J]. Springerplus,5(1):1475. doi:10.1186/s40064-016-3142-0.
Nishimura R,Hata K,Matsubara T,Wakabayashi M,Yoneda T. 2012. Regulation of bone and cartilage development by network between BMP signalling and transcription factors[J]. Journal of Biochemistry,151(3):247-254. doi:10.1093/ jb/mvs004.
Otto T C,Bowers R R,Lane M D. 2007. BMP-4 treatment of C3H10T1/2 stem cells blocks expression of MMP-3 and MMP-13[J]. Biochemical and Biophysical Research Communications,353(4):1097-1104. doi:10.1016/j.bbrc.2006. 12.170.
Pedersen M E,Vuong T T,Ronning S B Kolset S O. 2015. Matrix metalloproteinases in fish biology and matrix turnover[J]. Matrix Biology,44-46:86-93. doi:10.1016/j.matbio.2015.01.009.
Rajaram S,Murawala H,Buch P,Patel S,Balakrishnan S. 2016. Inhibition of BMP signaling reduces MMP-2 and MMP-9 expression and obstructs wound healing in regene-rating fin of teleost fish Poecilia latipinna[J]. Fish Phy-siology and Biochemistry,42(2):787-794. doi:10.1007/s10695-015-0175-1.
Shu B,Zhang M,Xie R,Wang M N,Jin H T,Hou W,Tang D Z,Harris S E,Mishina Y,O'Keefe R J,Hilton M J,Wang Y,Chen D. 2011. BMP2,but not BMP4,is crucial for chondrocyte proliferation and maturation during endochondral bone development[J]. Journal of Cell Science,124(20):3428-3440. doi:10.1242/jcs.083659.
Stickens D,Behonick D J,Ortega N,Heyer B,Hartenstein B,Yu Y,Fosang A J,Schorpp-Kistner M,Angel P,Werb Z. 2004. Altered endochondral bone development in matrix metalloproteinase 13-deficient mice[J]. Development,131(23):5883-5895. doi:10.1242/dev.01461.
Su S Y,Dong Z J. 2018. Comparative expression analyses of bone morphogenetic protein 4(BMP4) expressions in muscles of tilapia and common carp indicate that BMP4 plays a role in the intermuscular bone distribution in a dose-dependent manner[J]. Gene Expression Patterns,27:106-113. doi:10.1016/j.gep.2017.11.005.
Sun J H,Liu G D,Guo H Y,Zhu K C,Guo L,Liu B S,Zhang N,Zhang D C. 2020. Skeletal anomalies in cultured golden pompano Trachinotus ovatus at early stages of development[J]. Diseases of Aquatic Organisms,137(3):195-204. doi:10.3354/dao03436.
Sun J L,Zhao L L,Wu H,Lian W Q,Cui C,Du Z J,Luo W,Li M Z,Yang S. 2019. Analysis of miRNA-seq in the li-ver of common carp(Cyprinus carpio L.) in response to different environmental temperatures[J]. Functional & Integrative Genomics,19(2):265-280. doi:10.1007/s10142- 018-0643-7.
Takaishi H,Kimura T,Dalal S,Okada Y,D'Armiento J. 2008. Joint diseases and matrix metalloproteinases:A role for MMP-13[J]. Current Pharmaceutical Biotechnology,9(1) 47-54. doi:10.2174/138920108783497659.
Urban J P G,Roberts S. 2003. Degeneration of the intervertebral disc[J]. Arthritis Research & Therapy,5(3):120-130. doi:10.1186/ar629.
Vu T H,Shipley J M,Bergers G,Berger J E,Helms J A,Hanahan D,Shapiro S D,Senior R M,Werb Z. 1998. MMP-9/gelatinase B is a key regulator of growth plate angioge-nesis and apoptosis of hypertrophic chondrocytes[J]. Cell,93(3):411-422. doi:10.1016/s0092-8674(00)81169-1.
Wargelius A,Fjelldal P G,Grini A,Gil-Martens L,Kvamme B O,Hansen T. 2010. MMP-13(Matrix MetalloProteinase 13) expression might be an indicator for increased ECM remodeling and early signs of vertebral compression in farmed Atlantic salmon(Salmo salar L.)[J]. Journal of Applied Ichthyology,26(2):366-371. doi:10.1111/j.1439-0426.2010.01436.x.
Xiao Y T,Xiang L X,Shao J Z. 2007. Bone morphogenetic protein[J]. Biochemical and Biophysical Research Communications,362(3):550-553. doi:10.1016/j.bbrc.2007. 08.045.
Yang Q B,Ma Z H,Zheng P L,Jiang S G,Qin J G,Zhang Q. 2016. Effect of temperature on growth,survival and occurrence of skeletal deformity in the golden pompano Trachinotus ovatus larvae[J]. Indian Journal of Fisheries,63(1):74-82. doi:10.21077/ijf.2016.63.1.51490-10.
Ytteborg E,Baeverfjord G,Torgersen J,Hjelde K,Takle H. 2010a. Molecular pathology of vertebral deformities in hyperthermic Atlantic salmon(Salmo salar)[J]. BMC physiology,10:12. doi:10.1186/1472-6793-10-12.
Ytteborg E,Torgersen J,Baeverfjord G,Takle H. 2010b. Morphological and molecular characterization of developing vertebral fusions using a teleost model[J]. BMC Physio-logy,10:13. doi:10.1186/1472-6793-10-13.
Zhou T,Gui L,Liu M L,Li W H,Hu P,Duarte D F C,Niu H B,Chen L B. 2019. Transcriptomic responses to low temperature stress in the Nile tilapia,Oreochromis niloticus[J]. Fish & Shellfish Immunology,84:1145-1156. doi:10.1016/j.fsi.2018.10.023.
收稿日期:2020-12-14
基金項目:海南省自然科学基金项目(2019CXTD418,319QN339,319MS102);中国水产科学研究院基本科研业务费专项(2020TD55)
通讯作者:马振华(1981-),https://orcid.org/0000-0003-3112-3153,博士,副研究员,主要从事海水鱼类繁育与发育研究工作,E-mail: zhenhua.ma@hotmail.com
第一作者:韩明洋(1995-),https://orcid.org/0000-0002-0587-4124,主要从事海水鱼类繁育与发育研究工作,E-mail:myhan2019@163.com
2111501186301
