亲水作用色谱-串联质谱法测定动物源运动食品中3种氨基糖苷类抗生素的残留量
2021-03-04宫明明
宫明明
(黄淮学院,河南 驻马店 463000)
氨基糖苷类抗生素(aminoglycosides,AGs)是一类水溶性碱性抗生素,化学结构上包含两个以上氨基糖并由配苷键与中心的己糖或戊糖相连[1-2],是畜禽养殖领域较常使用的兽药[3-4]。AGs药物具有耳毒性和肾毒性等毒副作用,人类长期食用其残留超标的食品将会危害人体健康。典型的代表药物有链霉素、双氢链霉素、新霉素、潮霉素B、安普霉素等,其中,新霉素、潮霉素B、安普霉素等属于新型氨基糖苷类抗生素,能同时检测多种目标物的方法标准尚未形成。为了防止通过食物链引起人体中毒,特别是以动物性组织为原料制成的动物源性运动食品这类特殊食品,有必要建立一种快速检测其中这些组分的方法,加强AGs在动物源运动食品中的残留监控。
由于潮霉素B、安普霉素和新霉素属于强极性化合物,在常规反相色谱柱上保留性能不佳,强极性和高水溶性也给样品前处理和色谱分离增加了难度[5-7]。采用溶剂萃取或者固相萃取的前处理方式处理动物源运动食品,目标物回收率不理想[8-10]。毛细管电泳、柱后衍生-高效液相色谱(high performance liquid chromatography,HPLC)法虽然简便,但灵敏度不高[11-12];高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)法虽灵敏度较色谱方法有所提高,但是流动相中要加入离子对试剂,这会导致系统稳定性差以及会出现高离子强度抑制待测物电离的问题[13-14]。然而,亲水作用色谱(hydrop interaction liquid chromatography,HILIC)是一种介于正相色谱和反相色谱之间的分离模式,可用于分析强极性和强亲水性样品,以及适用于分离在常规反相色谱上保留不佳的组分,且易与质谱联用,可解决多种AGs的分离问题。
本研究通过利用基质固相分散(matrix solid phase dispersion,MSPD)技术对强极性较难分离的3种AGs进行提取后,通过优化亲水交互作用色谱仪器条件以及前处理过程,建立亲水交互作用色谱-串联质谱(hydrophilic interaction liquid chromatography tandem mass spectrometry,HILIC-MS/MS)法检测动物源运动食品中3种AGs的残留量,克服了常规方法损伤质谱的缺陷,提高方法的实用性。
1 材料与方法
1.1 材料与试剂
潮霉素B(纯度98.5%)、新霉素(纯度99.0%)、安普霉素(纯度98.0%)标准品:上海安谱实验科学科技有限公司;动物源运动食品(鸡胸肉源蛋白棒、牛肉源蛋白棒、乳清蛋白棒、鸡胸肉运动代餐粉、牛肉运动代餐粉、蛋白运动能量棒):市售;乙腈、甲酸(色谱纯):德国Merck公司。
1.2 仪器与设备
API4000型高效液相色谱-串联质谱仪:美国Waters公司;Sielc Obelisc R色谱柱(2.1 mm×100 mm,5 μm):美国飞诺美公司;InertSustain Amide色谱柱(2.1 mm×100 mm,1.7 μm)、BEHHILIC色谱柱(2.1mm×100mm,3μm):日本岛津有限公司;TSKgel Amide-80色谱柱(2.1 mm×100 mm,1.7 μm):美国沃特世公司;IKA MS3 basic涡旋混合器:IKA(广州)仪器设备有限公司。
1.3 实验方法
1.3.1 样品前处理
取2.0 g动物源运动食品、2.0 g二氧化硅填料和2.0 g乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)二钠盐混匀,装入SPE管中,1.0 mL/min的流速下用10.0 mL纯水淋洗,再用乙腈-甲酸溶液洗脱,收集洗脱液,定容至2 mL,用0.22 μm滤膜过滤后分析。
1.3.2 色谱条件的优化
固定色谱条件:进样量3μL;柱温35℃;流速0.3mL/min。
色谱柱的选择:考察色谱柱种类(键合相为硅胶的BEH HILIC色谱柱、键合相为酰胺基的InertSustain Amide色谱柱、键合相为酰胺基的TSKgel Amide-80色谱柱以及键合相为含电荷的极性和非极性混合基团的Sielc Obelisc R色谱柱)对3种氨基糖苷类抗生素的分离效果,4种色谱柱中InertSustain Amide色谱柱以10 mmol/L乙酸铵-乙腈(10∶90,V/V)为流动相进行等度洗脱,其余3种色谱柱都以1.0%甲酸水溶液-乙腈(10∶90,V/V)为流动相进行等度洗脱。
流动相的选择:考察了水-乙腈(10∶90,V/V)、1.0%甲酸水溶液-乙腈(10∶90,V/V)以及10 mmol/L乙酸铵-乙腈(10∶90,V/V)等溶液的等度洗脱效果,并对甲酸水溶液-乙腈(10∶90,V/V)流动相体系中不同甲酸含量(0.05%、0.10%、0.25%、0.50%、0.75%、1.00%)进行比较,以样品的加标回收率考察提取效果。
基质效应的影响:为减少基质效应,尽量除去动物源运动食品中的干扰物质,在上述流动相等度洗脱的基础上,收集每段淋洗液进样检测,最终确梯度洗脱程序[15-17]。
1.3.3 质谱条件
选用质谱检测器的电喷雾离子源(electrosprayion source,ESI+)模式,离子源电压为4 200 V,离子源温度为380 ℃,扫描模式为多反应离子监测模式(multiple reaction monitoring,MRM),其他质谱检测参数见表1。

表1 3种氨基糖苷类抗生素质谱检测参数Table 1 Mass spectrometry detection parameters of 3 aminoglycoside antibiotics
1.3.4 方法学验证
标准溶液的配制:配制不同质量浓度(5ng/mL、10ng/mL、50 ng/mL、100 ng/mL、200 ng/mL、500 ng/mL)的混合标准溶液,在优化好的色谱条件下检测,以质量浓度(x)为横坐标,响应强度为纵坐标(y)绘制标准曲线,其中以信噪比(S/N)=3计算检出限(limit of detection,LOD),以信噪比(S/N)=10计算定量限(limit of quantitation,LOQ)。
稳定性及重复性实验:在最优条件下,对潮霉素B、安普霉素和新霉素的混合标准溶液(50 ng/mL)进行HILICMS/MS检测分析,连续测定7 d,每天进样3次,测得3种化合物组分保留时间和峰面积的日间和日内相对标准偏差(relative standard deviation,RSD)。
加标回收实验:在空白样品中分别添加低(100 μg/kg)、中(250 μg/kg)和高(500 μg/kg)三个水平混合标准品溶液,按照所建立的方法进行样品前处理及测定,计算加标回收率及RSD。
2 结果与分析
2.1 色谱条件的优化
2.1.1 色谱柱的选择
不同色谱柱对3种氨基糖苷类抗生素的分离效果见图1。不同键合固定相的色谱柱在分离目标物组分的过程中保留机制迥异[18-20],这4款亲水作用色谱柱(BEH HILIC色谱柱、Sielc Obelisc R色谱柱、TSKgel Amide-80色谱柱以及InertSustain Amide色谱柱)对3种AGs的分离效果也相差较大,其中BEH-HILIC柱分离3种目标物不出峰,其余3种色谱柱可以对目标物实现分离。
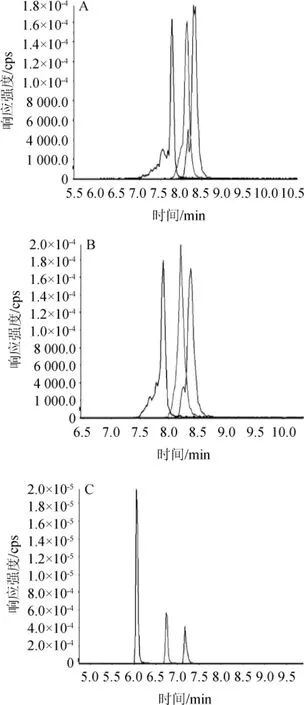
图1 3种色谱柱对3种氨基糖苷类抗生素的分离效果Fig. 1 Effect of 3 chromatographic columns on the separation of 3 aminoglycoside antibiotics
由图1可知,InertSustain Amide色谱柱在以10 mmol/L乙酸铵-乙腈(10∶90,V/V)为流动相等度洗脱模式下,可以实现3种氨基糖胺类抗生素的分离,但潮霉素B、新霉素会出现色谱峰分叉等现象,且目标物响应强度相应较弱;而Sielc Obelisc R色谱柱和TSKgel Amide-80色谱柱在以1%甲酸-乙腈(10∶90,V/V)为流动相等度洗脱模式下,也可实现3种氨基糖苷类抗生素的分离。但以TSKgel Amide-80色谱柱分离的色谱图不理想,目标物峰形有展宽和拖尾现象;而以阳离子极性与非极性混合作用机理模式的Sielc Obelisc R色谱柱上目标组分的分离色谱图效果较好,各组分有较好的分离度,故最终采用Sielc Obelisc R色谱柱。
2.1.2 流动相的选择
采用Sielc Obelisc R色谱柱分离,不同流动相等度洗脱对3种氨基糖苷类抗生素回收率的影响见图2。
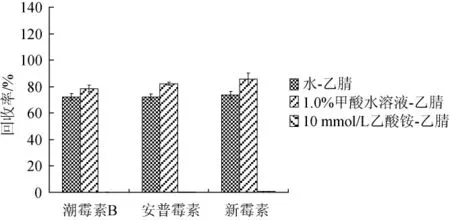
图2 3种流动相对3种氨基糖苷类抗生素回收率的影响Fig. 2 Effect of 3 kinds of mobile phase on recovery of 3 aminoglycoside antibiotics
由图2可知,3种流动相中1.0%甲酸水溶液-乙腈(10∶90,V/V)洗脱效果最好,3种AGs均能被洗脱,这是由于AGs包含多个氨基结构,属于碱性糖苷,酸性洗脱液易与氨基糖苷类结合,所以1.0%甲酸水溶液-乙腈(10∶90,V/V)洗脱得到的各分析物回收率高于水-乙腈(10∶90,V/V)洗脱。进一步优化甲酸水溶液-乙腈(10∶90,V/V)流动相体系中甲酸含量对洗脱效率的影响,分别用0.05%~1.00%甲酸水溶液-乙腈(10∶90,V/V)进行洗脱,计算3种氨基糖苷类抗生素的回收率,结果见图3。
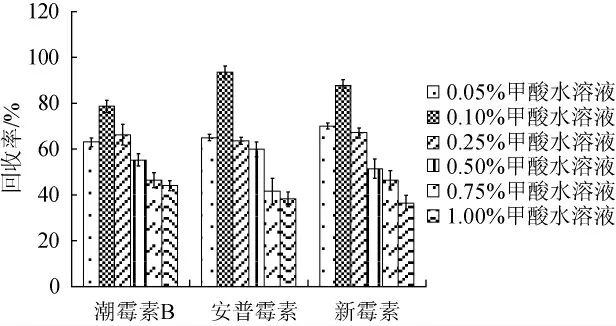
图3 流动相中甲酸含量对3种氨基糖苷类抗生素回收率的影响Fig. 3 Effect of formic acid content in mobile phase on recovery of 3 aminoglycoside antibiotics
由图3可知,流动相采用0.10%甲酸水溶液-乙腈(10∶90,V/V)洗脱时,各分析物的回收效果最好,回收率范围为79.1%~92.6%。因此,确定最优的流动相为0.10%甲酸水溶液-乙腈。
2.1.3 基质效应的影响
为了减少质谱分析时的基质效应,尽量除去动物源运动食品中的干扰物质,方法采用乙腈-甲酸溶液梯度淋洗以去除干扰物质[21-25]。收集每段淋洗液进样检测,最终确定最优流动相及其梯度洗脱程序见表2。

表2 流动相梯度洗脱程序Table 2 Gradient elution program of mobile phase
2.2 方法学验证
2.2.1 标准曲线的制作
在最优色谱条件下检测3种氨基酸糖苷类抗生素标准品,绘制标准曲线,确定检出限及定量限,结果见表3。
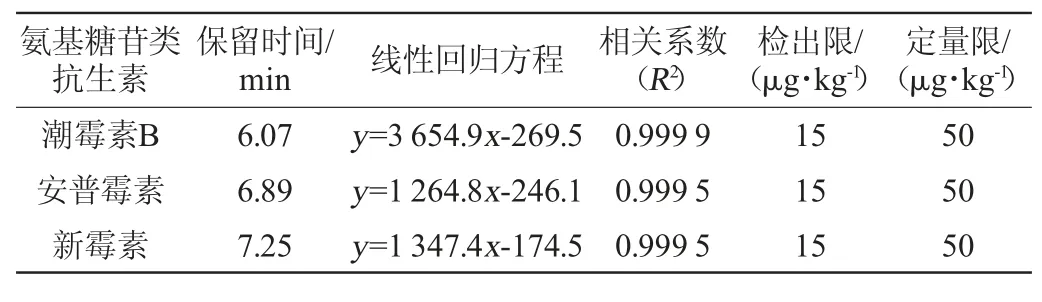
表3 3种氨基糖苷类抗生素的保留时间、标准曲线、相关系数、检出限与定量限Table 3 Retention time, standard curve, correlation coefficient, limit of detection and quantification of 3 aminoglycoside antibiotics
由表3可知,3种AGs线性关系良好,相关系数(R2)在0.999 5~0.999 9之间,方法的检出限均为15 μg/kg,定量限均为50 μg/kg。
2.2.2 稳定性与重复性
在最优条件下,潮霉素B、安普霉素和新霉素保留时间的日间和日内RSD分别为3.5%~7.9%和3.5%~4.1%;峰面积的日间和日内RSD分别为3.6%~7.4%和3.2%~3.9%,说明该方法的稳定性和重复性均良好。
2.2.3 加标回收率实验
在最优条件下,潮霉素B、安普霉素和新霉素的加标回收率实验结果见表4。

表4 方法的回收率及相对标准偏差(n=5)Table 4 Recoveries and relative standard deviation of the method (n=5)
由表4可知,3种AGs平均加标回收率在85.7%~93.6%,回收率实验结果的相对标准偏差(RSD)为3.1%~5.2%,可以满足检测方法的要求。
2.3 实际样品的检测
将本方法应用于从超市中随机抽取的5种品牌共10份动物源运动食品样品,检测3种AGs的残留。结果显示样品中3种AGs的含量均低于50μg/kg,均满足国家标准GB31650—2019《食品安全国家标准食品中兽药最大残留限量》中的限量要求。
3 结论
本研究通过对4种HILIC色谱柱比较和MSPD条件的优化,建立了亲水交互作用色谱-串联质谱法测定动物源运动食品中3种AGs残留的分析方法,即样品经Sielc Obelisc R柱分离,采用0.10%甲酸水溶液-乙腈梯度洗脱。采用该方法3种化合物组分在5~500 ng/mL的质量浓度范围内具有良好的线性关系,相关系数R2为0.999 5~0.999 9,检出限均为15 μg/kg,定量限均为50 μg/kg,保留时间的日间和日内RSD分别为3.5%~7.9%和3.5%~4.1%,峰面积的日间和日内RSD分别为3.6%~7.4%和3.2%~3.9%,说明该方法的稳定性和重复性均良好。加标回收率为85.7%~93.6%,回收率试验结果的RSD为3.1%~5.2%。本方法灵敏度高,重现性好,有效解决了检测氨基糖苷类抗生素时反相色谱柱上保留性能不佳、回收率低的分析难点,可为动物源运动食品中3种AGs残留的分析和监控提供技术支持。
