白桦茸不同提取物对小鼠急性毒性实验研究
2021-03-04李建华赵良友刘成臻刘树民
李建华,赵良友,张 娜,刘成臻,刘树民
(1.中国辐射防护研究院,太原 030000,2.黑龙江中医药大学药物安全性评价中心,哈尔滨 150040)
白桦茸(Betulaplatyphylla),属于多孔菌科纤孔菌属,菌核呈现瘤状,外表黑灰,有不规则沟痕,内部黄色,较硬。研究[1]表明,白桦茸在癌症、糖尿病、心脏病和胃肠道疾病等方面有很好的疗效。白桦茸主要活性物质包括白桦茸多糖、白桦茸黄酮、白桦茸三萜类物质等[2]。本实验对白桦茸水提物、白桦茸发酵液、白桦茸醇提物进行小鼠急性毒性实验,并测定白桦茸醇提物对小鼠的LD50,为白桦茸保健品的研发及临床使用提供可靠的保证。
1 材料与方法
1.1 药材
大兴安岭白桦茸(Betulaplatyphylla)购自黑龙江省药材公司,经黑龙江中医药大学中药资源与开发教研室王振月教授鉴定为真菌门担子菌亚门层菌纲非褐菌目多孔菌科褐卧孔菌属白桦茸。
1.2 动物
18~22gSPF级ICR小鼠140只,雌雄各半,黑龙江中医药大学实验动物中心,生产许可证号:SCXK(黑)2018-003,饲养于黑龙江中医药大学动物实验中心,室内温度20~25℃,相对湿度40%~60%。
1.3 试剂、仪器与设备
甲醇(天津市恒兴化学试剂制造有限公司),甲醛(天津市天力化学试剂有限公司),无水乙醇(天津市恒兴化学试剂制造有限公司),95%乙醇(天津市恒兴化学试剂制造有限公司),伊红(江苏世泰实验器材有限公司),苏木素(江苏世泰实验器材有限公司),二甲苯(天津市天力士化学试剂有限公司)。冻干机(北京松源华兴科技发展有限公司),AL204电子天平(梅特勒-托利多仪器上海有限公司),脱水机(LEICA-ASP300S),包 埋 机(LEICA-EG1150H),切 片 机(LEICARM2255),染色机(LEICA-ST5010),生物显微镜(OLYMPUS-CX31)。
1.4 实验方法
1.4.1白桦茸不同提物的制备
1.4.1.1白桦茸水提物的制备 白桦茸在纯净水溶液中经83℃提取3.4h,料液比1:36(w/v),提取4次,通过热水浸提的方式得到白桦茸水提物,其中1g水提物相当于4.5g白桦茸[3]。
1.4.1.2白桦茸发酵液的制备 采用20L全自动小型发酵罐进行桦褐孔菌液体发酵,培养基配方:1%玉米淀粉,2%葡萄糖,0.2%蛋白脉,0.1% KH2PO4,0.05% MgSO4。实消冷却后接入桦褐孔菌液体菌种(采用PDA加富培养基200mL,分装于500mL三角瓶中,重复5次后封口,120℃高压灭菌30min。冷却后将桦褐孔菌菌种块接入液体培养基中,27℃,200r·min-1,培养96h),接种量为10%,27℃,20r·min-1,培养8d后,将发酵液pH调至11~12,在100℃条件下提取lh,过滤菌球,取浓缩液加入85%乙醇中进行醇沉,静置24h后,取上清液至旋转蒸发仪浓缩回收乙醇,离心后的沉淀冷冻干燥,称质量[4-5]。
1.4.1.3白桦茸醇提物的制备 白桦茸在30%乙醇溶液中经85℃提取4h,料液比1:30(w/v),提取2次,通过水浴回流装置得到白桦茸醇提物,将2次得到的白桦茸醇提物混合,利用旋转蒸发仪回收溶剂,得到浓缩液利用冻干机48h后得到冻干粉。其中1g提取物相当于10g白桦茸。
1.4.2小鼠经口急性毒性预实验 实验选取SPF级ICR小鼠60只,体质量(20±2)g,雌雄各半,实验前禁食12h,将白桦茸水提物、白桦茸发酵液和白桦茸醇提物按照小鼠最大体积0.4mL·10g-1单次经口给药,观察记录小鼠死亡情况,根据小鼠给药后的状态和死亡数,来调节给药剂量,找出各组小鼠全死亡和全不死亡的剂量,并根据预实验结果进行正式实验[6]。
1.4.3小鼠经口急性毒性实验 根据预实验的结果,选取SPF级ICR小鼠80只,体质量(20±2)g,随机分成8组,分别为对照组、白桦茸水提物最大给药浓度组、白桦茸发酵液最大给药浓度组和白桦茸醇提物组(采用Bliss法,按照0.7倍剂量间距,将小鼠分为4.0、5.6、8.0、11.2、16.0g·kg-1·BW5个剂量组),每组10只,雌雄各半,驯化饲养3d,实验前小鼠禁食不禁水12h,经口单次予白桦茸不同提取物,对照组予等量的纯净水,灌胃3h后自由进食[7-8]。
1.4.4观察检测 给药后,观察内容包括动物运动情况、眼睑指征、呼吸、皮毛、排泄物和分泌物等。记录动物中毒症状及中毒反应的起始时间、严重程度、持续时间等。实验期间各组动物的死亡情况并详细登记,出现死亡或濒死动物及时进行解剖检查。体质量指标,实验期间称量小鼠给药第1天、第3天、第7天、第14天的体质量。检测脏器系数和主要脏器的病理检查,小鼠解剖时,观察脏器色泽、体积、质地等变化;将心、肝、脾、肺、肾脏和脑于10%福尔马林固定,修块、脱水、包埋、切片、HE染色、封片,显微镜下观察组织器官的组织结构和细胞形态。
1.5 统计学方法
体质量采用Excel进行统计,实验结果均以均数±标准差(±s)表示,采用DAS软件计算LD50和LD50的95%的可信限和回归方程。
2 结果
2.1 预实验结果
白桦茸水提物组,通过予小鼠白桦茸水提物最大给药浓度(10g·kg-1),观察14d后,未发现小鼠死亡。白桦茸发酵液组,通过予小鼠白桦茸发酵液最大给药浓度(8g·kg-1),给药后发现小鼠活动减少,次日小鼠恢复正常状态,观察14d后无小鼠死亡。白桦茸醇提物组,发现通过予小鼠不同剂量的白桦茸醇提物,小鼠全部死亡的剂量为16.0g·kg-1,全不死亡的剂量为4.0g·kg-1。根据预实验结果,予小鼠白桦茸水提物最大给药浓度(10g·kg-1),予小鼠白桦茸发酵液最大给药浓度(8g·kg-1),予小鼠白桦茸醇提物采用Bliss法,按照0.7倍剂量间距,将小鼠分为4.0、5.6、8.0、11.2、16.0g·kg-1·BW5个剂量组,测LD50。
2.2 正式实验结果
各组给药后发现,对照组无异常,小鼠予白桦茸水提物后,给药当日部分小鼠活动减少,给药次日发现少数小鼠有稀便,持续观察至第3天小鼠恢复正常,至观察期结束未发现小鼠死亡;小鼠予白桦茸发酵液后,给药当日雄性和雌性各有2只小鼠活动减少,持续观察至第3天小鼠恢复正常,至观察期结束未发现小鼠死亡;小鼠予白桦茸醇提物后,给药当日小鼠活动减少,16.0g·kg-1剂量组小鼠给药后60min,4只雌性和3只雄性小鼠出现呼吸急促、腹式呼吸,持续1min后死亡,给药后75min剩余3只小鼠出现同样症状,持续一段时间后死亡,11.2 g·kg-1剂量组小鼠给药3h后,2只雌性和2只雄性小鼠呼吸急促,持续一段时间后死亡,剩余存活小鼠至观察期结束未死亡,8.0g·kg-1剂量组小鼠给药次日,发现有1只雌性和1只雄性小鼠死亡,5.6g·kg-1剂量组小鼠观察至给药后第3天,1只雌性小鼠死亡,4.0g·kg-1剂量组小鼠至观察期结束,小鼠未发现异常状态,未发生死亡。实验观察期间,对所有死亡小鼠及时解剖,部分小鼠肠有胀气现象,未发现脏器有质地、色泽等改变,剩余存活小鼠至观察期结束麻醉后剖检,小鼠皮毛、分泌物等未见异常,解剖观察脏器未见异常。小鼠急性毒性实验情况,见表1,表2。采用DAS1.0软件,根据小鼠予白桦茸醇提物死亡情况计算,LD50为10.399g·kg-1,LD50的平均可信限(ML95)为1.735,LD50的95%可信限(L95)为8.808~12.278g·kg-1,LD50的平均可信限率(L95%)为0.167,斜率(b)为6.622,Sb为1.635,X50为1.017,Sx50为0.037,回归方程为Y(几率单位)=-1.735+6.622×log(D)。

表1 雌性小鼠急性毒性实验情况表 只

表2 雄性小鼠急性毒性实验情况表
2.3 各组小鼠体质量变化指标检测
小鼠急性毒性实验中,驯化饲养3d小鼠体质量平稳,给药时小鼠初始体质量在22~24g,记录小鼠1、3、7、14d的体质量,各给药组与对照组比较,小鼠予白桦茸水提物组的体质量至3d时,体质量呈下降趋势,至7d和14d体质量与对照组相同呈上升趋势;小鼠予白桦茸发酵液组体质量至3d时,体质量呈下降趋势,至7d和14d体质量呈上升趋势;小鼠予白桦茸醇提物各组小鼠体质量至3d,体质量呈下降趋势,至7d,小鼠予白桦茸醇提物4.0、5.6组小鼠体质量逐渐恢复,小鼠予白桦茸醇提物8.0、11.2组小鼠体质量呈下降趋势,至14d,小鼠予白桦茸醇提物4.0、5.6组小鼠体质量呈上升趋势,小鼠予白桦茸醇提物8.0、11.2组小鼠体质量略有上升。说明白桦茸水提物和白桦茸发酵液单次灌胃予小鼠后,未影响小鼠的生长,白桦茸醇提物单次灌胃予小鼠后,对小鼠的生长有一定的影响,见表3,表4。

表3 雌性小鼠体质量变化情况 g

表4 雄性小鼠体质量变化情况 g
2.4 小鼠脏器指数变化情况
小鼠脏器系数是脏器的重量与自身重量的比值,能初步反映小鼠整体营养状态和病变情况,各给药组小鼠脏器指数结果与对照组相比无统计学意义(P>0.05),见表5,表6。初步判定不会对小鼠造成脏器的损伤。
表5 雌性小鼠脏器指数变化情况

表6 雄性小鼠脏器指数变化情况
2.5 小鼠主要脏器形态学检查情况
通过对照组与白桦茸醇提物11.2g·kg-1组的心、肝、脾、肺、肾脏和大脑的组织病理观察,白桦茸醇提物组小鼠肝脏与对照组相比偶见肝细胞散在性肿大及核浓缩,其他脏器未发现形态学上的改变。见图1。
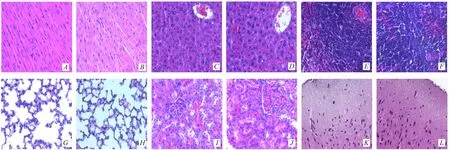
图1 小鼠主要脏器形态学情况(HE染色,×10)
3 讨论
白桦茸不同提取物小鼠单次经口急性毒性实验研究发现,小鼠予白桦茸水提物未发生死亡,个别小鼠有稀便现象和体质量轻微下降的趋势,可能与给予白桦茸水提物后影响小鼠肠蠕动有关,次日恢复且体质量呈平稳上升趋势,病理解剖观察无异常,结果表明白桦茸水提物最大耐受剂量不低于10.0g·kg-1;小鼠予白桦茸发酵液未发生死亡,在给药后小鼠活动减少和体质量有轻微的下降趋势,可能因为小鼠受到药物刺激的原因,次日逐渐恢复且体质量呈平稳上升趋势,病理解剖观察无异常,结果说明白桦茸发酵液最大耐受剂量不低于8.0g·kg-1;小鼠予不同浓度的白桦茸醇提物有不同程度的死亡,实验结果发现随着给药浓度的升高小鼠死亡的数量有升高的趋势,死亡的时间有缩短的趋势,小鼠死亡前呼吸急促、腹式呼吸,死亡后解剖观察组织器官,发现小鼠发生死亡可能与小鼠肠胀气有关,经计算白桦茸醇提物小鼠经口急性毒性LD50为10.399g·kg-1,LD50的95%可信限(L95)为8.808~12.278g·kg-1,各给药组小鼠的体质量均有不同程度下降,说明白桦茸醇提物对小鼠具有一定的毒性,并在组织病理形态学的观察发现少数小鼠肝脏偶见病变,可能白桦茸醇提物对肝脏有一定毒性。
组织病理学可以通过形态学的改变来确定药物毒性作用的靶器官,本研究主要对小鼠的心、肝、脾、肺、肾脏和大脑进行HE染色,在显微镜下观察未发现有极显著形态学的改变,可能与单次给药和给药周期过短有关,所以仍无法确定其靶器官,后期可以开展长期的毒性实验,对其脏器进行组织病理检查,确定白桦茸醇提物毒性作用的靶器官,并联合代谢组学技术、基因组学技术等对白桦茸醇提物的毒性机制进一步的探讨,为白桦茸的研发和临床使用提供可靠的保证。
