鸭源NF-κB1基因荧光定量PCR方法建立及其初步应用
2021-03-04贺欣薇曾茂芹刘妍罕张扬子温贵兰程振涛
张 飘,贺欣薇,杨 霞,曾茂芹,刘妍罕,张扬子,杨 颖,3,温贵兰,3,程振涛,3,文 明,3,*
(1.贵州大学 动物科学学院,贵州 贵阳 550025;2.贵州省畜牧兽医研究所,贵州 贵阳 550025;3.贵州省动物生物制品工程技术研究中心,贵州 贵阳 550025)
核因子κB(nuclear factor-kappa B ,NF-κB)是在1986年由Ranjan Sen等人在鼠B淋巴细胞中发现并将其命名[1],随着对该因子的深入研究,人们发现NF-κB家族由5种NF-κB/Rel蛋白组成,分别为NF-κB1(p50)、NF-κB2(p52)、RelA(p65)、RelB和c-Rel,几乎所有细胞中均有表达[2]。NF-κB信号通路是已知的炎症发展的主要通路[3]。NF-κB是免疫细胞的激活、细胞周期调控、细胞分化增殖凋亡中的重要转录因子[4],同时也是Toll样受体家族(Toll-like receptors,TLRs)信号通路的下游信号分子,在调控炎症因子转录中占有主要地位[5],最新的研究表明,其还与海马神经元损伤[6]及癫痫[7]有关。当细胞处于健康或未受到外界刺激时,NF-κB的p65亚基与κB抑制蛋白-α(IκB-α)会结合在一起,从而覆盖NF-κB1核蛋白定位信号,使NF-κB1以失活状态存在于胞质中,但当细胞受到外界中某些细胞因子、细菌、病毒感染及内毒素等刺激时[8-10],就会使IκB-α磷酸化后被降解,从而暴露出NF-κB1核蛋白定位信号[11],NF-κB1与IκB-α解离后会迅速转移至细胞核,并与核内DNA特定靶部位结合,启动相关靶基因转录[12],从而引起一系列生理病理过程。以往对NF-κB1基因检测的多为蛋白水平,缺少转录水平的检测方法,而本实验室基于前期在DEV增殖和NF-κB信号通路方面的探索,建立了可为进一步研究 NF-κB 信号通路中NF-κB1基因转录水平检测的荧光定量PCR方法,并对鸭胚成纤维细胞(duck embryo fibroblasts,DEF)在感染鸭肠炎病毒(DEV)后NF-κB1基因转录表达量的时间变化情况进行了检测,以此来阐明NF-κB信号通路与DEV增殖的关系。
1 材料与方法
1.1 材料
1.1.1 实验动物与毒株
受精鸭蛋,购自贵州省三穗县三穗鸭保种场,经DEV核酸检测为阴性;鸭肠炎病毒DEV-GZ株,由贵州省动物生物制品工程技术研究中心提供。
1.1.2 主要试剂
胎牛血清,购自杭州四季清公司;胰蛋白酶,购自Hyclone公司;RNA试剂盒,购自天根生化科技有限公司;质粒中量抽提试剂盒,购自杭州爱思进生物技术有限公司;PrimeScriptTMRT Master Mix(Perfect Real Time)、SYBR Premix Ex TaqⅡ(Tli RNaseH Plus)、TRIzol RNA分离试剂、pMDTM19-T载体等,购自宝生物工程(大连)有限公司;DNA凝胶回收试剂盒,购自美国OMEGA公司;E.coliDH5α感受态细胞由本实验室提供。
1.2 方法
1.2.1 目的基因引物设计与合成
根据GenBank上NF-κB1基因序列(登录号:NM-205134),利用软件Primer 5.0,设计并合成一对特异性引物,引物预扩增片段为156 bp。引物序列为NF-κB1-F:5′-GATACAACCCAGGACTC-3′;NF-κB1-R:5′-ACATAAGACGCACCAC-3′,送生工生物工程(上海)股份有限公司合成。
1.2.2 DEF的制备与cDNA的合成
鸭胚成纤维细胞(DEF)制备:将受精三穗鸭蛋置于37 ℃恒温孵化箱中,待其孵化到10 d后取出胚体,并去掉胚体头部、四肢、内脏及红细胞,余下部分加入胚体10倍体积0.25%胰蛋白酶溶液,消化一段时间后,离心后取底部沉淀并加入胎牛血清混匀终止消化,过滤后溶液中即含有鸭胚成纤维细胞,放入培养箱培养备用。使用RNA试剂盒提取DEF总RNA,并用NanoDrop-2000测定仪(重复3次)确定RNA的纯度及未发生降解后,使用反转录试剂Prime ScriptTMRT Master Mix(Perfect Real Time)将其反转录成cDNA,反转录条件为:37 ℃反转录15 min,85 ℃作用5 s。
1.2.3 NF-κB1基因PCR扩增、克隆及质粒的提取
以1.2.2节中cDNA为模板,使用50 μL体系对NF-κB1进行PCR扩增。PCR反应体系为:2×TaqPCR Master Mix 25.0 μL、F/R引物各2.0 μL、cDNA样本4.0 μL和无菌无酶ddH2O 17.0 μL,总体积50.0 μL。将得到的PCR扩增产物进行凝胶电泳,将预期条带使用OMEGA胶回收纯化试剂盒对目的基因进行纯化回收,将回收产物与19-T载体16 ℃连接12 h,将连接产物转化感受态细胞2 h后,接种到100 mmol·L-1Amp LB培养基中培养12 h,挑取培养基中单个白色菌落于液体培养基,37 ℃恒温培养12 h,使用质粒提取试剂盒提取质粒,将得到的重组质粒进行PCR验证,并送往生工生物工程(上海)股份有限公司进行测序。比对测序结果准确即为阳性质粒,测定浓度,计算其拷贝数后[5],用无菌双重蒸水10倍系列稀释成标准品,4 ℃备用。
1.2.4 NF-κB1基因荧光定量PCR反应体系的建立及条件优化
以1.2.3中构建好的阳性标准质粒(pMD-19T-NF-κB1)为模板,用荧光定量引物在荧光PCR仪上进行扩增及分析。荧光定量PCR体系为:SYBR premix ExTaqⅡ(Tli RNase H Plus)染料5.0 μL、F/R引物各0.5 μL、cDNA样本1.0 μL和无菌无酶ddH2O 3.0 μL,总体积10.0 μL。反应条件:95 ℃预变性30 s;95 ℃变性5 s、退火50~64 ℃ 30 s,共进行39个循环。以出现荧光的Ct值最小、荧光阈值最高且熔解曲线为单峰,即没有非特异性扩增产物作为标准,对退火温度及引物进行优化。
1.2.5 NF-κB1基因荧光定量PCR方法标准曲线建立及检验
取1.2.3节中标准质粒进行荧光定量PCR扩增,并设置阴性对照(将标准质粒换成同体积无菌无酶去离子水),每个稀释浓度做3个平行重复,以Ct值为纵坐标、底物拷贝数对数为横坐标,绘制标准曲线。检测NF-κB1基因的熔解曲线,确定熔解峰单峰,以无菌无酶的去离子水作阴性对照,同时选取本实验室已构建好的几种质粒(pMD-19T-ADF、pMD-19T-JAK2、pMD-19T-STAT3、pMD-19T-SOCS1、pMD-19T-IL-1β、pMD-19T-JAK2),以标准质粒作为阳性对照,进行特异性验证。以1.2.3节中标准质粒为模板,10倍稀释,共稀释10个浓度梯度,然后进行qPCR和普通PCR反应,检测2种方法能检测到的最低拷贝数,进而比较其灵敏性。选取3个浓度梯度(1.0×107~1.0×109copies·mL-1)的标准品质粒,将不同稀释度的标准品进行重复检测,计算批间和批内变异系数,分析方法的重复性。
1.2.6 NF-κB1基因荧光定量PCR方法在DEV感染DEF中的初步运用
将1.2.2节中制成的细胞接种到96孔细胞培养板中,加入细胞营养液,培养箱中放置4 h,观察细胞贴壁后分为两个组,实验组和对照组,实验组中每孔接种1 000 LD50的DEV-GZ株0.2 mL DEV病毒液,对照组加入0.2 mL细胞营养液,每一组设置5个重复孔。继续培养12、24、36、48、60、72、84、96、108和120 h后收集细胞,提取细胞RNA并反转录成cDNA,具体步骤同1.2.2节,利用建立的NF-κB1基因荧光定量PCR方法检测在感染DEV前后DEF细胞中NF-κB1基因转录变化情况。
2 结果与分析
2.1 NF-κB1基因PCR结果与标准质粒
以DEF细胞中提取并反转录的cDNA为模板进行PCR扩增,得到预期156 bp大小的条带(图1)。将重组质粒进行PCR鉴定,并测序比对,结果显示,PCR鉴定与测序均与预期相符,标准质粒构建成功(图2)。在NanoDrop-2000浓度测定仪上测定标准质粒浓度,计算出其拷贝数为1.79×1011copies·mL-1,用无菌无酶去离子水10倍系列稀释成1.79×100~1.79×1011copies·mL-1。
2.2 NF-κB1标准曲线建立
采用矩阵法优化退火温度,结果显示,退火温度为60 ℃时效果最佳。用标准质粒10倍系列稀释为模板进行荧光定量PCR检测,绘制的曲线呈现典型的S型,各稀释浓度梯度标准品曲线之间呈现平行,Ct值相差均匀,各稀释浓度标准品的Ct值与拷贝数的对数呈现良好的线性关系,阴性对照无扩增曲线。扩增效率为109.2%,以Ct值为纵坐标、底物拷贝数对数为横坐标,取连续的5个点(1.79×107~1.79×1011copies·mL-1)获得荧光定量PCR方法标准曲线方程,模板Ct值(y)与起始拷贝数(x)关系式为y=-3.12x+44.086(相关系数R2=1)(图3),满足R2>0.99。
2.3 特异性、敏感性和重复性检验
特异性、敏感性和重复性检验结果显示:NF-κB1基因荧光定量PCR的熔解曲线没有出现非特异性的扩增产物以及二聚体,呈现单峰,阴性对照与其他质粒均无扩增曲线,阳性对照呈现典型的S型曲线,表示针对该基因的引物具有良好的特异性(图4-A、B)。以1.79×100~1.79×109copies·mL-1标准阳性质粒作为模板进行荧光定量PCR扩增,均能检测到扩增信号,说明该方法可检测到的拷贝数为1.79 copies·mL-1,而普通PCR能检测到的最低拷贝数为1.79×102copies·mL-1,因此,建立的NF-κB1基因荧光定量PCR方法比普通PCR高出100倍,说明该方法具有良好的灵敏性(图4-C、D)。选取1.79×107~1.79×109copies·mL-1标准品质粒,分别进行批内和批间重复,批内重复变异系数分别是0.06%、0.20%、0.04%、0.15%、0.28%、0.07%、0.19%、0.14%和0.15%,批间重复变异系数分别是0.17%、0.10%和0.16%,均小于0.3%,说明本研究建立的方法重复性好,具有较高的稳定性(表1)。
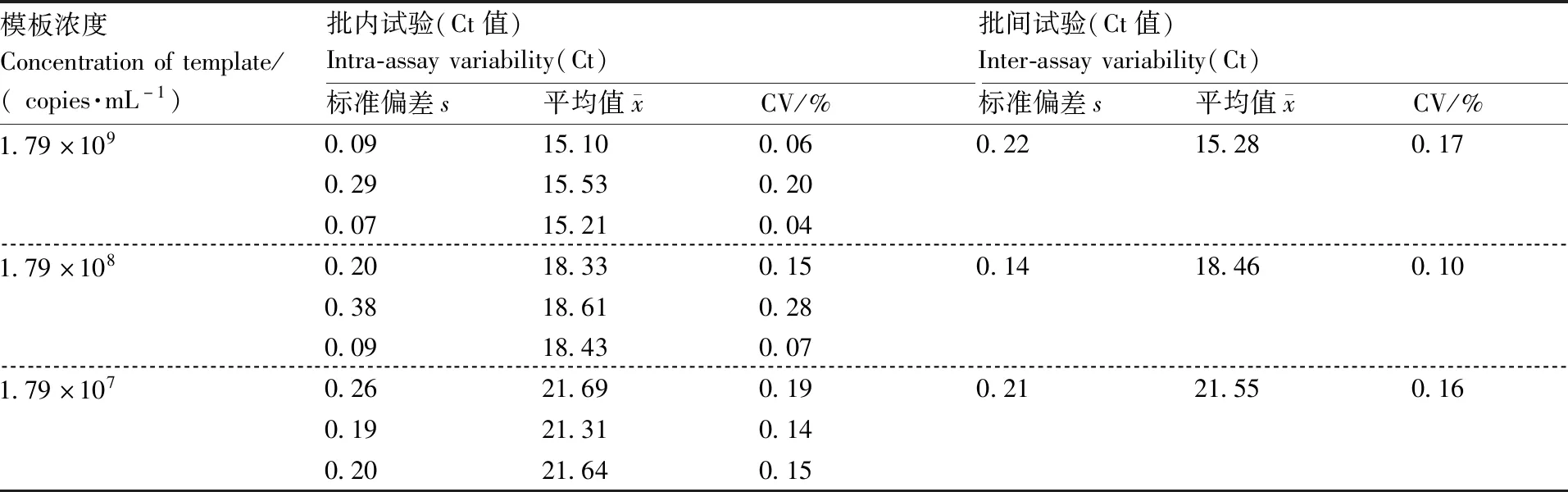
表1 重复性检验Table 1 Repeatability test
2.4 NF-κB1基因荧光定量PCR方法在DEV感染DEF中的初步运用
通过NF-κB1基因荧光定量PCR方法检测,DEF在感染DEV前或后,NF-κB1基因在DEF细胞中随时间的改变其转录水平均无线性规律,但DEF细胞感染DEV后整体转录表达水平高于未感染时正常细胞,差异显著(P<0.05),其中36~84 hNF-κB1基因的转录水平与正常细胞中差异极显著(P<0.01)(表2、图5)。

表2 NF-κB1基因在感染DEV前后在DEF细胞中转录水平Table 2 Repeated field value NF-κB1 gene transcription level in DEF cells before and after infection with DEV
3 讨论
核因子κB(nuclear factor kappa-B,NF-κB)是一种蛋白质复合体,包括5个相关的蛋白质,在几乎所有细胞中均存在,参与细胞对外界刺激的响应,包括病原微生物感染、辐射、热应激、重金属污染等。在大多数细胞中,NF-κB是以无活性的形式存在于细胞质中,当细胞受到外界刺激如病原感染、氧化应激、促炎细胞因子刺激等,均能激活NF-κB信号通路[13]。当NF-κB信号通路被激活后,不需要蛋白质合成,在短时间内即可有效影响宿主细胞的多种生命活动。因此,NF-κB信号通路成为病毒入侵细胞的重要作用靶点。但一直以来针对NF-κB信号通路的大部分研究都是利用ELISA试剂盒对关键因子进行检测[14],即从蛋白水平进行检测,来分析该通路的变化情况,或者直接对NF-κB1( p50)蛋白质进行原核表达来分析该通路的变化情况[15],但免疫学方法存在一定的误差,分子生物学方法可以做到更为精确的检测[16]。而且前者只能说明蛋白水平的变化情况,没有转录水平的变化情况。目前,检测基因mRNA的主要方法有普通PCR、荧光定量PCR、Northern blot、基因芯片和转录组测序,而荧光定量PCR作为其中的经典方法,从而被广泛应用[17]。本研究为阐明当细胞受到外界刺激时NF-κB信号通路关键因子的mRNA变化情况,建立了针对NF-κB1基因既可靠又精确的荧光定量PCR方法。
本研究采用SYBR Green染料法建立了鸭NF-κB1基因荧光定量PCR方法,该方法熔解曲线没有出现非特异性的扩增产物以及二聚体,呈现单峰,特异性检测中阴性对照与其他质粒均无扩增曲线,阳性对照呈现典型的S型曲线;灵敏度检测表明,该方法最小检出量为1.79 copies·mL-1,而普通PCR方法最小检出量为1.79×102copies·mL-1,荧光定量PCR方法是普通PCR最小检出量的100倍;重复性检测表明,批内和批间重复变异系数均小于0.3%,综上所述,本研究建立的NF-κB1基因荧光定量PCR方法具有良好的特异性、灵敏性、重复性以及具有较高的稳定性。
本研究以建立的NF-κB1基因荧光定量PCR方法,首次检测并分析感染或不感染DEV对DEF细胞中NF-κB1基因整体转录表达水平影响,从而初步探究DEV对NF-κB信号通路的影响。DEF细胞感染DEV后整体转录表达水平高于未感染时正常细胞,差异显著(P<0.05),其中36~84 hNF-κB1基因的转录水平与正常细胞中差异极显著(P<0.01),在这过程中NF-κB可能诱导了大量炎性基因的转录引发炎症反应,从而提升病毒致病力。
本研究成功建立了鸭NF-κB1基因荧光定量PCR检测方法,并通过该方法检测发现DEF细胞感染DEV后NF-κB1基因整体转录表达水平高于未感染时正常细胞,在个别时段差异极显著(P<0.01),且DEV可以激活NF-κB信号通路。
