胃癌患者HLA-I表达水平与免疫活性细胞反应及预后的相关性
2021-03-03宿冬远
张 玲,宿冬远,姜 政
胃癌是一种常见的消化系统恶性肿瘤,根据WHO统计结果显示,亚洲范围内胃癌的发病率居全球恶性肿瘤发生率的第7位,病死率在10%左右[1-2]。在我国胃癌的发病率仅次于第1位的肺癌,由于早期胃癌无明显症状,多数患者初诊时已为晚期,而晚期胃癌患者多伴随淋巴或血液转移,往往预后较差[3],因此针对胃癌侵袭能力及预后生物标志物的筛选研究成为热点方向之一。机体的免疫系统通过识别并杀伤肿瘤细胞来阻止肿瘤发生进展的这一过程被称为免疫监视[4],虽然大多数的肿瘤抗原具有免疫原性,但机体的免疫系统并不能完全有效的祛除肿瘤细胞,与肿瘤细胞的免疫逃逸有关[5]。
人类白细胞抗原(human leukocyte angigen,HLA)是参与内源性抗原肽加工、处理及提呈的重要抗原[6]。目前研究证实HLA-I表达的降低或缺失会使得HLA-I向T细胞呈递的抗原多肽无法被细胞毒性T细胞识别,导致肿瘤细胞逃避免疫监视继续发展[7]。但胃癌中HLA-I与免疫活性细胞反应及预后之间的相关研究鲜少报道,因此本研究通过免疫组化检测胃癌组织中HLA-I及微环境中免疫活性细胞浸润情况,来分析HLI-I与免疫活性细胞反应及预后之间的关系,探讨HLA-I在胃癌发生中的作用。
1 资料和方法
1.1临床资料 收集本院2014年12月—2016年12月期间胃肠外科、消化科及肿瘤科胃癌患者手术切除的胃癌组织石蜡标本80例为癌组织组,并取同期非胃癌胃破裂穿孔患者的正常胃组织石蜡标本80例为正常胃组织组。胃癌组织组患者均经资深病理科医师阅片后确诊;男56例,女24例;年龄43~75(57.3±7.2)岁;淋巴结转移31例,无淋巴结转移49例;TNM分期:Ⅰ/Ⅱ期35例,Ⅲ/Ⅳ期45例。正常胃组织组男52例,女28例;年龄40~73(55.6±6.8)岁。2组性别、年龄比较差异无统计学意义(P>0.05),具有可比性。
1.2方法
1.2.1主要试剂:HLA-I鼠抗人单克隆抗体(1∶100)购自日本MBL公司;兔抗人CD11c单克隆抗体(1∶200)购自英国abcam公司,用于标记树突状细胞;即用型鼠抗人CD45 RO、CD8单克隆抗体购自迈新生物技术开发公司,分别用于标记记忆性T淋巴细胞和细胞毒性T淋巴细胞;羊抗鼠和兔二抗,DAB显色液均购自迈新生物技术开发公司。
1.2.2免疫组化:将固定好的胃癌组织及正常胃组织制成切片。将制好的切片放入60℃烤箱内烘烤2 h完成脱水、脱蜡及抗原修复之后,用50 ml的3%过氧化氢洗涤,放入37℃烤箱中烘干25 min,PBS漂洗3次,每次5 min,分别加入一抗4℃过夜,次日室温复温20 min后用PBS漂洗3次,加入辣根过氧化物酶标记的二抗37℃条件下孵育30 min,加入适量二氨基联苯胺(DAB)显色后,继续加入苏木素复染10 min,流水下洗净,二甲苯脱水透明后加入中性树胶封片,镜检。以试剂盒提供的已知阳性表达切片为阳性对照,PBS代替一抗为阴性对照。
1.2.3结果判定标准:所有阅片均由两位高年资病理医师进行双盲法评估结果。具体方法为每张切片400倍镜下随机选取5个视野,并在视野上计数100个细胞,首先观察细胞染色强度,无变色为0分,浅黄色为1分,棕黄色为2分,黄褐色为3分;接着计算阳性细胞百分比,<10%为0分,10%~20%为1分,21%~50%为2分,>50%为3分。取2项评分的乘积记为每个标本的染色积分,积分<3分判定为阴性,≥3分判定为阳性。
1.3随访 患者自手术切除后开始门诊复查或电话随访,治疗后1年内每3个月门诊复查1次,2年内半年复查1次,以后至少每年复查一次。随访记录生存时间及随访时状态(存活、死亡或其他)。

2 结果
2.1胃癌组织及正常胃组织中HLA-I及免疫活性细胞表达情况 胃癌组织组HLA-I、CD11c+树突状细胞、CD45RO+记忆性T细胞、CD8+细胞毒性T淋巴细胞阳性表达率均低于正常胃组织组(P<0.01)。见表1。

表1 胃癌组织及正常胃组织中HLA-I及免疫活性细胞阳性表达情况[例(%)]
2.2HLA-I表达水平与临床病理特征及免疫活性细胞反应的相关性 胃癌组织中HLA-I的表达与淋巴结转移、分化程度、TNM分期、CD11c+树突状细胞、CD45RO+记忆性T细胞、CD8+细胞毒性T淋巴细胞表达有关(P<0.05)。见表2。

表2 HLA-I表达水平与临床病理特征及免疫活性细胞反应的相关性[例(%)]
2.3单因素分析 80例胃癌患者术后随访时间为3.8~61.5个月,中位随访时间为28.7个月,3年内无病生存率为53.75%(43/80)。单因素分析显示淋巴结转移、TNM分期Ⅲ/Ⅳ期、肿瘤直径≥4 cm、3种免疫活性细胞阴性表达、HLA-I阴性表达均是胃癌患者预后生存的影响因素(P<0.05)。见表3。

表3 胃癌患者预后生存的单因素分析
2.4胃癌患者预后生存的多因素Cox回归分析 多因素Cox生存分析模型分析显示,淋巴结转移、Ⅲ/Ⅳ期、3种免疫活性细胞阴性表达、HAL-I阴性表达是胃癌患者预后的独立危险因素(P<0.05)。见表4。
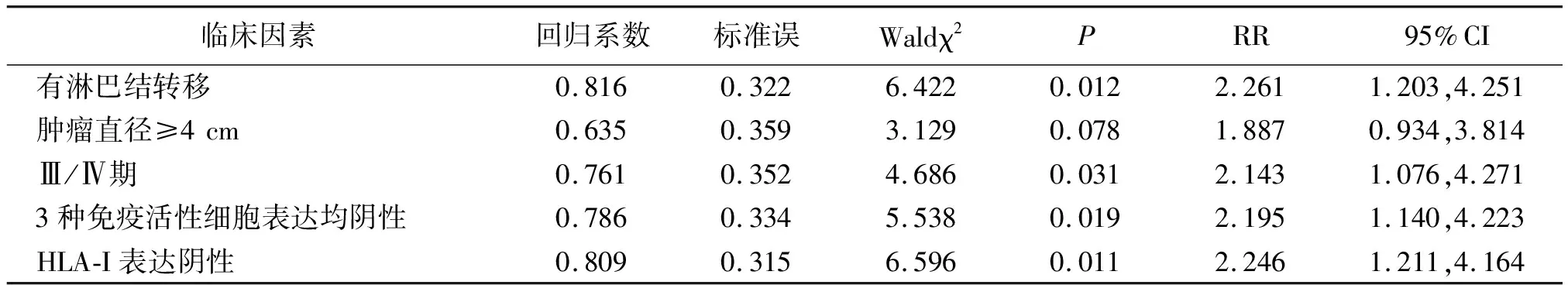
表4 胃癌患者预后生存的多因素Cox回归分析
3 讨论
机体抗肿瘤机制主要由细胞免疫介导,其中细胞毒性T淋巴细胞作为特异性消除癌细胞的主要效应细胞,需识别肿瘤细胞表面具有免疫活性的不同类型HLA-I类分子才能杀伤肿瘤细胞[8]。HLA-I类分子表达降低或者缺失均会导致细胞毒性T淋巴细胞识别功能异常,从而使肿瘤细胞免疫逃逸[9]。本研究结果显示,胃癌组织组HLA-I的阳性表达水平显著降低,且胃癌微环境中树突状细胞、记忆性T细胞、细胞毒性T淋巴细胞等免疫活性细胞的阳性表达水平也显著降低,这提示机体的免疫功能对肿瘤细胞反应无能,这一过程可能与HLA-I介导的免疫逃逸关系密切。Park等[10]研究发现,HLA-I类分子作为所有有核细胞上的可被CD8+细胞毒性T细胞识别的肽抗原,在Ⅱ、Ⅲ期胃癌患者中的阳性表达率仅为34.7%和40.5%,并且HLA-I阴性表达与CD8+细胞毒性T细胞浸润呈负相关。本研究发现,HLA-I表达水平与树突状细胞、记忆性T细胞、细胞毒性T淋巴细胞等免疫活性细胞表达相关。树突状细胞作为机体内功能最强的抗原提呈细胞,对维持T细胞的记忆功能是必需的[11],而胃癌组织中低表达情况可能是因为HLA-I类分子的表达受到多种参与抗原加工提呈过程的相关蛋白影响,使得肿瘤细胞内被降解的多肽无法有效的提呈给HLA-I类分子,影响到细胞膜上表达的密度及稳定性,从而无法被CD8+细胞毒性T细胞识别[12],另外非经典的HLA-I类基因也会抑制NK和T细胞的功能进而促进肿瘤细胞的免疫逃避机制[13]。
本研究结果显示,HLA-I在有淋巴结转移、低分化水平、TNM分期Ⅲ/Ⅳ期患者癌组织中表达水平显著降低,提示HLA-I可能在胃癌的发生早期及整个进展过程中均发挥着重要的作用,并且能够在一定程度反映出胃癌的恶性程度,而恶性程度越高可能患者的预后也越差。通过Kaplan-Meier分析发现,淋巴结转移、TNM分期、肿瘤直径≥4 cm、3种免疫活性细胞阴性表达、HAL-I阴性表达是胃癌患者预后的影响因素。有研究认为,肿瘤局部浸润的记忆性T细胞与树突状细胞越多,患者的无瘤生存率也越高[14-15],可能是当肿瘤微环境中免疫活性细胞反应较强,异常表达的相关蛋白能够被快速的识别并破坏,同时也能够破坏侵入至淋巴结中的肿瘤细胞,阻止癌细胞的发展,同时较高水平的HLA-I表达提示肿瘤细胞表面的HLA-I类复合物结构稳定,呈递的抗原肽更容易被细胞毒性T淋巴细胞识别而杀伤癌细胞,阻止癌细胞的发展[16]。多因素Cox生存分析模型分析也进一步证实了淋巴结转移、TNM分期Ⅲ/Ⅳ期、3种免疫活性细胞阴性表达、HAL-I阴性表达是胃癌患者预后的独立危险因素。
综上所述,HAL-I类分子作为肿瘤抗原肽呈递的关键分子,其表达降低会引起胃癌局部微环境中树突状细胞、记忆性T细胞、细胞毒性T淋巴细胞等免疫活性细胞浸润减少,致使肿瘤细胞逃避免疫监视,躲避杀伤,从而向淋巴结或其他部位转移,导致患者预后较差,因此通过提高肿瘤细胞表面HLA-I表达情况,增强肿瘤抗原特异性免疫应答可能是靶向治疗的方向之一。但本研究样本量较小,还需要扩大病例数做进一步研究。
