未分化型骨肉瘤患者临床预后模型的开发和应用*
2021-03-03贺希希韦庆军
贺希希,韦庆军
(广西医科大学第一附属医院创伤手外科,南宁 530021)
骨肉瘤(osteosarcoma,OS)是青少年和儿童最常见的原发恶性骨肿瘤[1],OS 以恶性成骨细胞系细胞产生骨基质为特征,可分为成骨细胞、成软骨细胞和成纤维细胞亚型[2]。目前OS 新辅助化疗的标准方案是由甲氨蝶呤、阿霉素和顺铂组成的联合方案[3]。新辅助化疗联合手术显著提高了OS 患者的生存率,但肿瘤的存在会导致在新辅助化疗期间耐药或微转移性疾病的增加[4],近30年来OS生存率一直停滞不前[5]。此外,肿瘤的遗传异质性、病理多样性、肿瘤细胞恶性分化等因素严重影响临床治疗和患者预后,其中肿瘤恶性分化程度表明肿瘤细胞分化程度越低,恶性程度越高,治疗效果越差[6]。在已有报道的骨肿瘤研究中,在“未分化”级别与“低分化”级别的骨原发性肉瘤患者中,肿瘤恶性程度更高,截肢率更高,预后效果更差[7]。然而,目前缺乏客观有效的预后模型,用于评价未分化型OS 患者的预后情况。美国检测、流行病学和最终结果登记研 究(surveillance,epidemiology and end result,SEER)数据库是美国最大的肿瘤登记注册数据库,覆盖了大约26%的美国人口,包括17个按地理位置确定的中心癌症登记处,这些登记所涵盖的人口与美国总人口相当[8]。本研究旨在基于SEER 数据库探讨未分化型OS 患者的预后生存情况,开发能够预测未分化型OS 患者的1 年、3 年和5 年癌症特异性生存率(cancer-specific survival,CCS)的预后模型,供临床工作者能够快速、直观、准确的个体化判断患者预后情况,具有一定临床指导意义。
1 资料与方法
1.1 资料收集 患者资料均来自SEER 数据库,使用SEER*Stat 软件(8.3.8 版本)Incidence-SEER 18 Regs Custom Data(with additional treatment fields),Nov 2018 Sub 模块中检索2004—2015 年诊断为OS的患者资料,包括性别、肿瘤组织学分类、原发性肿瘤原发部位、TNM 分期、手术、化疗、生存时间、生存结局。
1.2 数据处理方法 SEER数据库中检索出2004—2015 年诊断为OS 的患者共5 356 例。具体筛选标准如下:(1)组织学诊断明确为osteosarcomas;(2)肿瘤分化等级为undifferentiated;anaplastic;Grade IV;(3)具有完整随访记录。排除标准:(1)生存时间和生存状态不明确者;(2)仅有尸检报告和死亡证明者;(3)非OS 疾病原因死亡及死亡原因不明确者;(4)年龄、肿瘤原发部位、TNM 分期、手术及放疗等信息不明确者。最终筛选出1 056 例进行研究。为了得到充足样本量,将美国癌症联合委员会第六版和第七版恶性肿瘤分期共同纳入本研究。另外,由于OS 极少出现局部淋巴结转移,故在无法判断是否有局部淋巴结转移时,将其视为无局部淋巴结转移,即Nx期被纳入N0期[9]。根据第三版国际肿瘤学疾病分类(international classification of diseases for oncology,third edition,ICD-O-3),本研究OS 组织学分类包括:9180 普通型OS;9181 软骨母细胞性OS;9182 成纤维细胞性OS;9183 血管扩张性OS;9184 骨Paget 病OS;9185 小细胞性OS;9186 中央OS;9187 骨内分化良好性OS;9192 骨旁OS;9193骨膜OS;9194 高级别表面OS。SEER 数据库是免费的公共数据库,不能识别患者的基本信息,故本研究不需要伦理委员会批准及患者知情同意。
1.3 统计学方法 采用R 3.5.3软件进行分析数据,采用单因素和多因素Cox 回归分析计算OS 多因素风险比(hazard ratio,HR),根据HR构建OS 预后模型,使用一致性指数(concordance index,C-index)和校准图评估模型的精确性;通过受试者工作特征(receiver operating characteristic,ROC)曲线下面积(area under curve,AUC)评价其可信度。采用Ka‐plan-Meier(K-M)生存分析分析各个预后因素对OS患者独立的预后价值。为了保证模型准确性,减少混杂因素,排除非OS 死亡及死亡原因不明确患者病例,采用CSS 作生存分析指标。以P<0.05 为差异有统计学意义。
2 结果
2.1 一般情况 共有1056 例OS 患者纳入分析,其中女459 例,男597 例。生存时间为0~155 个月,中位生存时间是41个月。所有OS患者中组织学类型以9180普通型OS为主。
2.2 OS 患者预后因素分析结果 单因素Cox 回归分析中显示,性别对患者预后差异无统计学意义(HR=1.21,95%CI=0.99~1.48,P=0.063)。多因素Cox回归分析显示,肿瘤原发部位为四肢骨、手术治疗是OS 患者的保护因素(P<0.05);年龄分组中20~59 岁、≥60 岁,T 期分组中T2、T3、Tx,N 期分组中N1,M 期分组中M1、Mx均是OS 的独立危险因素(P<0.05),见表1、图1。
2.2 OS 预后模型构建与验证 根据多因素Cox 回归分析结果,将肿瘤组织学分类、年龄、肿瘤原发部位、T期、N期、M 期、手术、化疗和放疗9个预后因素纳入预后模型构建,由此可直观预测OS患者1年、3年、5 年的CSS,见图2。C-index 为0.753,表明该模型预测能力具有中等准确性。采用Bootstrap 自举法(B=1000)构建校准图比较模型预测值与实际值,校准图结果表明,该模型1年、3年、5年预测CSS与实际CSS有较好的一致性,见图3。1年CSS AUC为0.890,3 年CSS AUC 为0.754,5 年CSS AUC 为0.735,表明该模型对OS 患者的1 年、3 年、5 年CSS具有良好的预测能力,见图4。

表1 OS患者预后因素单因素和多因素Cox回归分析结果
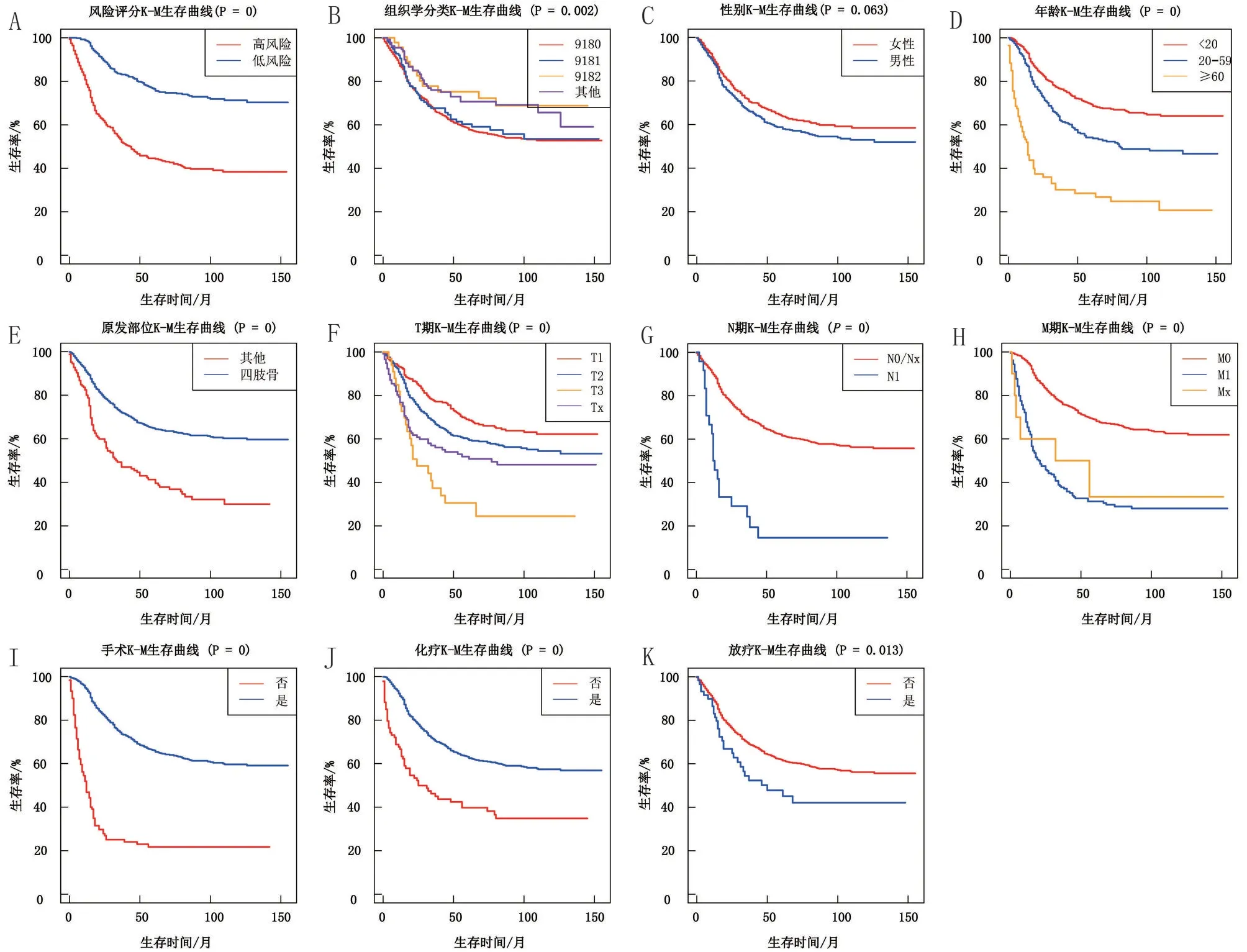
图1 OS独立预后因素的CSS生存曲线图
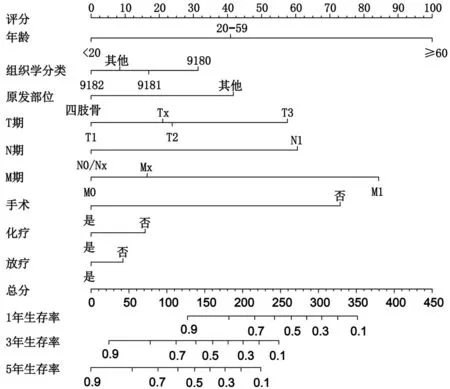
图2 未分化型OS患者CSS预测列线图
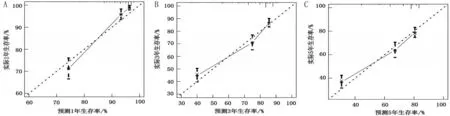
图3 预后模型校准曲线

图4 特异性生存率ROC曲线
3 讨论
OS 是最常见的骨原发癌,其发生率为0.2/10 000/年~0.3/10 000/年[3]。由于OS 主要发生在青少年或青壮年,严重危害社会劳动力。在过去的20年里,临床工作者试图通过强化标准治疗来提高OS患者的治愈概率,但是都还没有成功,反而增加化疗毒性。对于OS 患者的临床诊疗效果,大多数临床医生仅能依据经验对患者的预后做出判断,而不是根据一个完善的评价模型。列线图作为一种能够整合多个预后因素,精确预测患者生存率的统计工具[10],已被广泛用作个体患者生存预测。SEER数据库的大型临床数据使列线图的建立提供了充足的数据支持,保证预后模型的精确度和可信度。本研究基于1 056 例未分化型OS 患者的临床数据,构建并验证了以预测OS 患者1 年、3 年、5 年的CSS 列线图模型,全面、准确的分析未分化型OS 患者预后相关因素,揭露OS 原发部位为四肢骨和治疗方式为手术是该肿瘤的保护因素(P<0.05),为临床工作者提供一个直观、可个体化预测未分化型OS 患者预后情况的模型。
本研究单因素分析中,发现性别在统计学上没有明显差异(P>0.05),结果表明其对OS患者的预后没有影响。肿瘤原发部位为四肢骨是OS 的保护因素(HR=0.43,95%CI=0.35~0.54,P<0.001),说明肿瘤发生在四肢骨相对于其他部位骨生存风险较低,Smeland等[11]研究同样发现中轴骨骨肿瘤患者较四肢骨骨肿瘤患者预后差。其原因可能是发现中轴骨OS 患者相对于四肢骨更容易进行远处转移,并且发生在脊柱、颅骨、骨盆等部位的OS,其解剖位置复杂,肿瘤体积往往较大,使得根治性手术变得非常困难[12],治疗难度大,术后又容易引发严重并发症,从而导致预后差,因此风险系数高于四肢骨。
手术切除原发灶是唯一的人为干预的OS 保护因素(HR=0.37,95%CI=0.28~0.49,P<0.001)。在任何OS 的治疗方案中,手术切除原发肿瘤和转移灶是必不可少的手段[13]。术前辅助化疗和手术切除肿瘤原发灶一直是绝大多数OS 患者的标准治疗方案[4]。在个别情况下,例如诊断不确定性或无法避免截肢时,立即手术切除病灶具有临床价值的[14]。现存最棘手的问题是,当肿瘤原发在骨盆和脊柱时,手术切除通常是无法实现的。应由经验丰富的团队做出个体治疗决策。在此情况下,质子束或碳离子治疗改善患者病情有适当的疗效[15]。
OS 是青少年最常见的原发性骨肿瘤,但由于OS 的发病是呈双峰分布的,60 岁以上的老年人是该病的第二高峰[8]。在年轻的患者中,OS 最常出现在长骨干骺端,如股骨远端、胫骨近端和肱骨近端[16]。作为第二高发的老年人群体中,老年患者的OS通常认为是以继发性恶性肿瘤为主,主要归因于骨paget病的肉瘤变[17]。在老年患者中,肿瘤发生在轴位和已放疗过的部位为主[18],这就回归到上述两项保护因素:肿瘤原发部位和手术切除原发灶。由于轴位解剖结构复杂,症状不明显,难以明确诊断,并且手术切除难以实施。而且老年患者的远处转移发生率更高,主要原因可能是肿瘤生物学的延迟诊断或者年龄的特异性差异[8]。肿瘤转移更频繁加上高剂量化疗的耐受性低,进一步降低了老年患者的生存率[19]。
在以往研究中,报道肿瘤分期和部位是OS 患者最显著的预后因素[20]。肿瘤的分期包括TNM 分期,其中肿瘤的大小是OS 预后关键指标之一,Biel‐ing 等[21]明确了以肿瘤体积150 cm3为预后的临界点,当体积超过该值时患者预后更差。OS最常见的是肺部转移,多个研究报道表明伴有转移的OS 患者的生存预后显著较差[22]。TNM 分期对OS 的治疗有指导意义,而且在评价预后方面也非常重要的价值。
本文全面分析未分化型OS 患者中,各个因素与患者预后相关性,依据患者的情况可个体化估算患者1 年、3 年、5 年CSS,对临床医生的治疗具有指导性意义。然而,SEER 数据库来源于美国,亚洲人群数量较少,本模型在国内方面的应用可能存在一定的局限性,缺少内部人群进行验证,这也是本课题组下一步工作需要解决的问题。
猜你喜欢
杂志排行
广西医科大学学报的其它文章
- Effect of miR-200a-3p targeting transthyretin(TTR)on the biological behavior of placental trophoblasts in hypertensive disorder complicating pregnancy
- 沙利度胺对重型β地中海贫血患者红系细胞γ珠蛋白基因表达及分化的作用研究*
- CEMIP调控Src/AKT/STAT3信号通路对非小细胞肺癌上皮间质转化及细胞侵袭、迁移的影响*
- 乳铁蛋白对正畸复发移动过程中牙周改建的影响*
- 秦皮苷对脂多糖诱导的软骨细胞氧化应激和炎症因子的影响*
- miR-133b-3p对大鼠脑缺血/再灌注损伤的影响及其作用机制*
