不同潮气量机械通气对4NQO饲养大鼠的肺损伤研究*
2021-03-03黄金水陈秋妙唐亚平施小彤
黄金水,陈秋妙,唐亚平,施小彤
(广西医科大学口腔医学院/附属口腔医院麻醉科,南宁 530021)
4-硝基喹啉-1-氧化物(4-nitroquino-line-l-ox‐ide,4NQO)是细胞内氧化应激的一个强有力的诱导剂,可能会引起DNA 的变化,研究发现,大鼠经4NQO 饮水法饲养数周至半年,可诱导出舌组织不典型增生及癌变等病理模型[1-2]。而对于口腔疾病需长时间机械通气的手术而言,手术时间及气管导管留置时间过长易出现通气相关性肺损伤(VILI)。经研究发现,肺保护性通气策略(LPVS)可以降低机械通气引起的肺组织损伤程度,但对于LPVS 应用于口腔疾病手术报道较少,本课题组前期临床研究发现,LPVS 可以促进口腔癌手术患者的氧合功能恢复[3]。因此,本研究分析LPVS 对4NQO 饲养的大鼠机械通气后肺损伤的影响,并观察大鼠肺泡灌洗液(BALF)内白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)和总蛋白的浓度变化,以及肺水含量和病理改变,旨在探讨LPVS的相关保护机制。
1 资料与方法
1.1 主要动物与实验试剂
选用SPF 级SD 大鼠30 只,雄性,4 周龄,90~100 g,购买于广西医科大学实验动物中心,实验动物合格证号:SCXK 桂2014-0002。本动物试验经广西医科大学实验动物伦理委员会批准,实验操作符合动物伦理学要求。4NQO(Meilunbio);大鼠IL-6酶联免疫吸附试验(ELISA)试剂盒、大鼠TNF-α ELISA 试剂盒(CUSABIO);BCA 蛋白浓度测定试剂盒(Beyotime);TUNEL检测试剂盒(Roche)。
1.2 动物模型建立
4NQO 用蒸馏水配成0.5%的水溶液,避光保存于4 ℃冰箱,使用时用自来水配置成0.005%的溶液。30 只大鼠饲养在广西医科大学实验动物中心普通环境,室内温度22~25 ℃,湿度40%~70%,明暗交替时间12/12 h,提供充足的饲料,0.005%的4NQO水溶液置入避光瓶中,饲养12周。
1.2 动物模型分组及处理
1.2.1 动物模型分组 30 只大鼠,编号后使用SPSS 23.0 生成随机数字,并随机均分为3 组:(1)对照组(A组):进行气管切开,无机械通气;(2)常规潮气量组(B组):VT=10 mL/kg,RR=50次/min,IE=1∶2;(3)肺保护性通气组(C 组):VT=6 mL/kg,RR=50 次/min,PEEP=0.490 kPa,IE=1∶2,采用控制性肺膨胀法(SI)实施RMs,将大鼠的呼气端导管接上3 通管并连接50 mL 注射器和水封瓶,同时将呼气末端导管插入水封瓶5 cm,在呼气末暂停呼吸机,注射器人工给予0.490 kPa 压力并维持5 s,同样的方法逐渐给予15 cm H2O、2.45 kPa 的压力,并各维持5 s,RMs 完成后立即转为原通气模式,并于1 h 进行一次SI[4],每组10只。
1.2.2 处理 实验前禁食12 h,麻醉方法采用腹腔注射20%乌拉坦按1 g/kg 麻醉大鼠,后固定于仰卧位行气管切开,静脉间断给予罗库溴铵10 mg/kg 维持肌肉松弛,气管插管后,连接小动物呼吸机(上海普辛仪器科技有限公司),按不同通气模式给予机械通气。麻醉成功后行颈静脉置管,用于补液,通气期间以10 mL/kg·h-1的速率输注生理盐水补液。吸空气4 h 后在麻醉状态下以放血法处死大鼠采集标本。
1.3 检测指标及方法
1.3.1 组织病理学检查 立即完整分离大鼠舌组织、肺组织后,用滤纸吸干表面血迹,取右肺下叶和舌组织分别使用4 ℃的多聚甲醛固定,保存48 h 后行石蜡包埋,制作病理切片。
1.3.2 苏木精-伊红(HE)及TUNEL 染色 取舌组织和右肺下叶切片分别行HE 染色后,在光学显微镜下观察。右肺下叶行Smith 评分:对气道上皮细胞损伤、间质性肺水肿、中性粒细胞浸润、透明膜和肺泡或间质出血进行0~4分半定量分析,每块切片均评估出5 个分数,总肺损伤评分为5 个分数之和[5]。同时,使用TUNEL 法检测右肺下叶的肺泡上皮细胞凋亡指数(AI):选择3张肺组织切片,按试剂盒步骤进行TUNEL 检测,细胞核呈棕黄色为凋亡细胞。每张切片随机选取肺泡区5个完整而不重叠的高倍视野(×400),计算AI(AI=凋亡细胞数/细胞总数×100%),并取平均值。
1.3.3 支气管BALF中的IL-6和TNF-α的测定 肉眼观察肺组织大体变化,并于右主支气管处结扎右肺,左肺使用4 ℃生理盐水3 mL,反复灌洗3 次,每次回抽2 mL,共6 mL,收集所有BALF 后,4 ℃、2 000 r/min离心10 min,取上清液于−80 ℃冰箱冻存。ELISA 法按试剂盒步骤检测BALF 中的IL-6和TNF-α水平。
1.3.4 BALF中的总蛋白浓度测定 BCA蛋白浓度试剂盒按步骤测定BALF中的总蛋白浓度测定。
1.3.5 右肺上叶的湿/干重比(W/D)分离右肺上叶,用滤纸吸干血迹称湿重,随后在60 ℃烘干箱烘干48 h称干重,并计算其湿/干重比值(W/D))。
1.4 统计学方法
所有数据采用SPSS 23.0 统计软件进行分析,结果以均数±标准差(±s)表示,当方差齐时,组间比较采用单因素方差分析,两两比较采用LSD-t检验;当方差不齐时,采用非参数秩和检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 舌组织观察
HE 染色:大鼠饲养12 周以后,舌头前部可观察到上皮发育不良,其特征为从基底层延伸至颗粒层的非典型有丝分裂,细胞核/细胞质比率增加、基底细胞破裂,排列紊乱、角化过度,上皮厚度增加;中部出现上皮萎缩,角蛋白层的锯齿特征消失,随后基底细胞的正常特征发生变化,表明中度发育不良,见图1。
2.2 肺组织观察
2.2.1 病理观察 肉眼观下,A 组的肺组织为正常肺组织,表面无损伤,无充血水肿;B 组表面充血水肿,少部分泛白,部分表现为弥漫性出血点;C 组无明显血性液体渗出,表面无明显出血点,仅有少量肺组织水肿。光镜下(HE 染色),A 组肺泡无破裂,肺间质无增厚,肺泡内无明显炎性细胞浸润;B组肺泡融合较多,肺间质部分增厚,可见炎性细胞浸润,红细胞渗出较多;C组肺泡融合较少,肺间质增厚较少,仅有少量红细胞渗出,见图2。
2.2.2 TUNEL 染色 A 组肺组织偶见凋亡细胞,B组的TUNEL 染色阳性细胞最多,C 组肺组织TU‐NEL 染色阳性细胞较B 组的少,可见少量散在凋亡细胞,见图3。
2.2.3 HE染色后Smith评分及TUNEL法检测AI 与A组对比,B组和C组的肺组织Smith评分和AI显著升高(P<0.05)。与B 组对比,C 组的肺组织Smith评分和AI均下降(P<0.05),见表1。
2.3 各组BALF中的IL-6、TNF-α含量、总蛋白浓度和W/D值对比
与A 组对比,B 组和C 组大鼠BALF 中TNF-α、IL-6 含量、总蛋白浓度及肺W/D 显著升高(P<0.05)。与B 组对比,C 组的BALF 中TNF-α、IL-6 含量、总蛋白浓度及肺W/D 均明显下降(P<0.05),见表2。
表1 3组大鼠BALF中肺组织损伤的Smith评分、AI比较 ±s

表1 3组大鼠BALF中肺组织损伤的Smith评分、AI比较 ±s
与A组比较,*P<0.05;与B组比较,#P<0.05。
表2 3 组大鼠BALF 中TNF-α、IL-6 含量、总蛋白浓度及肺W/D比较 ±s

表2 3 组大鼠BALF 中TNF-α、IL-6 含量、总蛋白浓度及肺W/D比较 ±s
与A组比较,*P<0.05;与B组比较,#P<0.05。
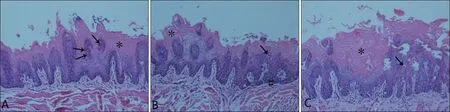
图1 舌组织病理改变(HE染色×200)
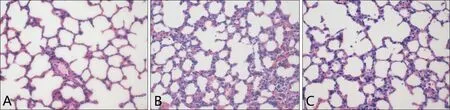
图2 3组大鼠肺病理改变(HE染色×400)
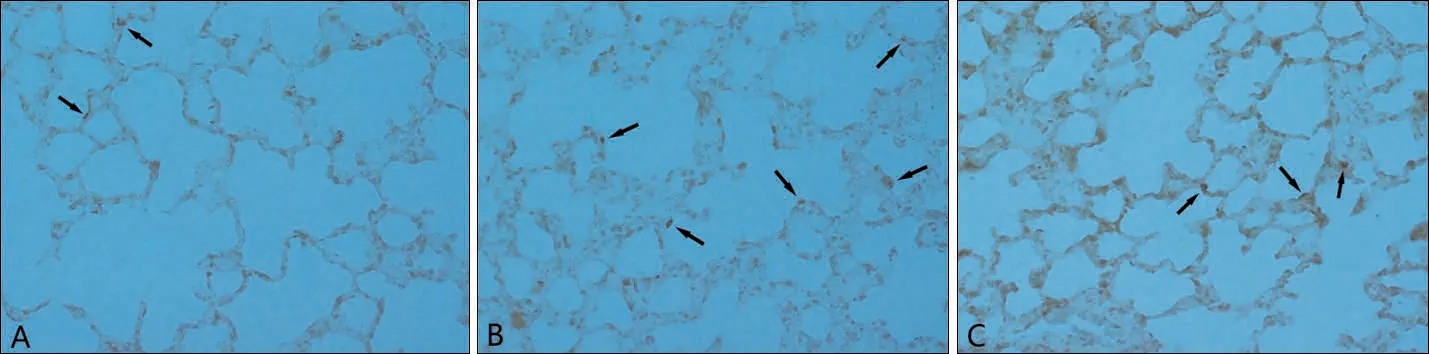
图3 3组大鼠肺组织TUNEL染色结果(×400)
3 讨论
对于口腔疾病患者手术实施LPVS 的研究尚少,临床发现,LPVS 可以有效的改善口腔肿瘤患者的术后肺部预后,缩短ICU 住院时间[6]。对于相关动物实验目前尚未有报道。而LPVS 通常由小潮气量、适当的PEEP 和定时的肺复张构成。本研究参照一项meta 分析确定LPVS 的小潮气量为6 mL/kg[7],PEEP 的取值参考文章取0.490 kPa[8-9]。肺复张策略的实施方法有3种:压力性控制法(PCV)、SI及PEEP 递增法(IP),本研究采用的是SI 法,从0.490 kPa、1.47 kPa 到2.45 kPa 给予肺复张可温和的提高气道压力,避免一次性引起肺部的压力性肺损伤[4]。从舌组织HE染色结果可以看出,4NQO饮水法饲养大鼠12 周后可诱发舌组织病理表现出的轻中度增生和非典型性增生,和Alicia 等[10]的研究结果相似,提示4NQO 可成功诱导出舌组织不典型增生的模型。此外,可能因饲养时间过短,因此尚未发现舌组织癌变。而通过对4NQO饲养后的大鼠进行肺保护性通气的研究,可以模拟临床上LPVS 应用于口腔疾病手术长时间机械通气(4 h)后的肺保护的研究,并提供基础研究理论支持。
本研究结果发现,常规潮气量组和肺保护性通气组大鼠在长时间机械通气后,BALF 中的TNF-α、IL-6、总蛋白浓度及肺W/D 均比对照组增高,而肺保护性通气组的各项指标均低于常规潮气量组(P<0.05),而TNF-α 和IL-6 均为肺炎相关的重要炎症因子,主要产生于单核巨噬细胞,在机械通气后引起相关肺损伤中表达增高[11-12]。因此,提示使用LPVS 可减少炎症因子的产生,对口腔疾病大鼠需长时间机械通气后可能可减少肺部炎症反应的发生。
本研究结果显示,对照组和肺保护性通气组的TUNEL染色阳性细胞较少,而常规潮气量组的肺组织中凋亡细胞增多,主要为肺泡上皮细胞和肺泡巨噬细胞;同时,通过HE 染色结果可见,常规潮气量组出现肺泡融合,中性粒细胞聚集和肺泡间质增厚和肺泡内少量出血,相对于对照组和肺保护性通气组的肺组织损伤程度较为严重。可认为,LPVS 不激活肺组织细胞凋亡程序,同时,可以减轻炎症反应。有学者认为,在健康肺组织中,肺泡巨噬细胞可通过释放NO 保护肺泡Ⅱ型上皮细胞免受凋亡,而常规潮气量中,肺泡巨噬细胞大量增生及因细胞周期短而大量凋亡,导致肺泡Ⅱ型上皮细胞随之凋亡,进而导致肺泡表面活性物质合成和释放障碍,造成肺组织损伤加重[13-14]。
综上所述,使用LPVS,可以有效的减轻经4NQO 饮水法饲养的大鼠的肺损伤。但因本研究只选择0.49 kPa EEP 值作为研究的因素,未研究其他水平的PEEP 值,因此,临床应用时可根据患者自身情况来调节相应的PEEP值。
猜你喜欢
杂志排行
广西医科大学学报的其它文章
- Effect of miR-200a-3p targeting transthyretin(TTR)on the biological behavior of placental trophoblasts in hypertensive disorder complicating pregnancy
- 沙利度胺对重型β地中海贫血患者红系细胞γ珠蛋白基因表达及分化的作用研究*
- CEMIP调控Src/AKT/STAT3信号通路对非小细胞肺癌上皮间质转化及细胞侵袭、迁移的影响*
- 乳铁蛋白对正畸复发移动过程中牙周改建的影响*
- 秦皮苷对脂多糖诱导的软骨细胞氧化应激和炎症因子的影响*
- miR-133b-3p对大鼠脑缺血/再灌注损伤的影响及其作用机制*
