circ_0000285通过miR-637/STAT3轴调控宫颈癌细胞的增殖、迁移和侵袭
2021-03-03庞旭姣吕向坤魏杏茹
庞旭姣,吕向坤,魏杏茹
(1.河北省第七人民医院,定州 073000;2.中国人民解放军陆军第八十二集团军医院,保定 071000;3.河北省保定市妇幼保健院,保定 071000)
宫颈癌是常见的女性生殖系统恶性肿瘤,据报道,局部早期宫颈癌治愈率达90%,但晚期宫颈癌具有较高的迁移率和淋巴结转移率,其中位生存时间仅8~13 个月,预后较差[1-2]。目前对于晚期复发及预后差的宫颈癌仍缺乏有效的治疗方法,因此,进一步揭示宫颈癌的分子机制,发掘新的分子靶向治疗靶点非常重要。
环状RNA(circular RNAs,circRNAs)是一种新的非编码RNA,因其具有闭合环状结构、表达稳定等特点而成为近年来疾病研究中的热点[3]。miRNA是一类长度约22 个核苷酸的非编码RNA,是肿瘤发生、进展及预后的重要调控因子。近年来多项证据表明,circRNA 可竞争性结合miRNAs,进而解除miRNAs 对其靶基因的调控作用,参与肿瘤进展[4]。研究报道,circ_0000285 在宫颈癌中高表达,发挥促癌作用[5],但其作用分子机制尚未完全阐明。因此,本研究旨在分析circ_0000285 对宫颈癌细胞增殖、迁移和侵袭的影响,并探讨其潜在作用机制。
1 材料与方法
1.1 组织样本 收集2018 年1 月至2020 年1 月在河北省第七人民医院进行肿瘤根治术治疗的50 例宫颈癌患者的宫颈癌组织和癌旁正常组织样本,所有的宫颈癌患者均经组织病理诊断确诊,术前未接受放疗、放疗等辅助治疗。本研究所有实验均获得医院伦理委员会的批准,样本采集均获得患者及其家属的同意。
1.2 细胞培养和转染 人卵巢上皮细胞株HOSEp‐iC 和宫颈癌细胞株OVCAR-3、A2780 和SiHa 由中国科学院上海细胞库提供。接种于含有1%青链霉素和10%胎牛血清的DMEM 培养液中,在37 ℃、5%CO2的培养箱中培养,每2~3 d 更换一次培养液,直到细胞达到对数生长期。
消化、收集对数生长期的OVCAR-3 细胞,将细胞分为以下几组:(1)Blank 组:细胞未经任何处理;(2)si-NC 组:细胞转染siRNA NC(si-NC);(3)sicirc_0000285 组:细胞转染siRNA circ_0000285(sicirc_0000285);(4)si-circ_0000285+anti-NC组:细胞共同转染siRNA circ_0000285(si-circ_0000285)和miRNA inhibitor 阴性对照(anti-NC);(5)si-circ_0000285+anti-miR-637 组:细胞共同转染siRNA circ_0000285(si-circ_0000285)和miR-637 inhibitor(anti-miR-637);(6)miR-NC 组:细胞转染miRNA mimics 阴性对照(miR-NC);(7)miR-637 组:细胞转染miR-637 mimics;(8)miR-637+pcDNA 组:细胞共同转染miR-637 mimics 和pcDNA3.1空载体;(9)miR-637+信号传导与转录激活因子3(STAT3)重组过表达质粒(pcDNA-STAT3)组:细胞共同转染miR-637 mimics 和pcDNA3.1-STAT3。细胞转染使用Li‐pofectamine 3000试剂,转染48 h后用于后续实验。
1.3 RT-qPCR 法检测circ_0000285、miR-637 及STAT3 表达使用 TRIzol 试剂(美国Invitrogen 公司)从组织样本和各细胞株中提取总RNA,使用PrimerScript RT 试剂试剂盒(中国Takara 公司)将纯化的RNA 逆转录为cDNA。采用SYRB Green 法,使用ABI 7500 型实时荧光定量PCR 仪进行PCR 扩增反应。以GAPDH 作为circ_0000285 和STAT3 mRNA 的内参,U6 作为miR-637 的内参,采用2−ΔΔCt法计算目的基因的相对表达水平。引物序列:GAP‐DH 上游5’-CTCTCTGCTCTCCTGTTCGAC-3’,下游 5’-TGAGCGATGTGGCTCGGCT-3’;circ_0000285 上 游5’-TATGTTGGTGGATCCTGTTCG‐GCA-3’,circ_0000285 下游5’-TGGTGGGTAGAC‐CAAGACTTGTGA-3’;STAT3 mRNA 上游5’-GCATTACGCTTAAGGCCTA-3’,STAT3 mRNA 下 游5’-CAATGGGCACTCCGGGATCG-3’;miR-637 上游5’-ACUGGGGGCUUUCGGGCUCUGCGU-3’,miR-637 下游5’-ACGCAGAGCCCGAAAGCCCCCAGU-3’;U6 上游5’-CGCTTCGGCAGCACATAT‐TAC-3’,U6 下 游5’-TTCACGAATTTGCGTGTC‐CAT-3’。
1.4 CCK8实验检测细胞增殖活性 收集对数生长期的OVCAR-3细胞,调整细胞密度为5×104个细胞/mL。在96 孔板中接种100 µL 的细胞悬液,置于37 ℃、5%CO2的培养箱中培养。分别培养24 h、48 h、72 h,加入10 µL CCK8 溶液,继续培养4 h,使用酶标仪测定在450 nm处的吸光度(OD)值。
1.5 Transwell 实验检测细胞迁移和侵袭 取150µL 细胞悬液接种到Transwell 板的上室中,然后在下室加入600 µL 含血清的DMEM 培养液,置于37 ℃、5%CO2的培养箱中培养24 h。取出Transwell上室用湿棉签将上室上表面的细胞擦除,然后在甲醇中固定30 min,0.1%结晶紫中染色15 min,使用PBS 溶液冲洗Transwell 上室,室温下晾干后,使用显微镜观察并随机计数5 个视野区的细胞迁移数目。细胞侵袭实验在Transwell 板的下室中提前加入Matrigel 基质胶(美国BD 公司),待Matrigel 基质胶凝固后同上述步骤一样检测细胞迁移数目。
1.6 Western blotting 法检测 使用RIPA 裂解法从细胞中提取总蛋白,蛋白样本测浓度后在沸水中变性,然后以50 µg 的上样量进行十二烷基硫酸钠—聚丙烯酰胺凝胶电泳(SDS-PAGE),采用湿转法将电泳分离蛋白转移至PVDF 膜上,用含10%脱脂奶粉的TBST 溶液封膜2 h;将膜分别与STAT3 蛋白一抗稀释液(稀释比例1∶2 000)和β-actin 蛋白一抗稀释液(稀释比例1∶1 000)在4 ℃下过夜孵育,洗膜;与辣根过氧化物酶标记的二抗稀释液(稀释比例1∶1 000)在室温下孵育1 h,洗膜;在化学发光液中孵育2 min,曝光、拍照。STAT3蛋白抗体、β-actin蛋白抗体及辣根过氧化物酶标记的二抗均购自美国Ab‐cam公司。
1.7 双荧光素酶报告基因试验 分别将含有miR-637 结合序列的circ_0000285 序列(circ_0000285-WT)及其突变序列(circ_0000285-MUT)、STAT3 3’UTR 序 列(STAT3 3’UTR-WT)及其突变序列(STAT3 3’UTR-MUT)构建双荧光素酶报告基因载体,然后分别与miR-NC 和miR-637 共转染OV‐CAR-3 细胞,转染48 h 后使用双荧光素酶报告基因检测试剂盒检测细胞中荧光素酶活性。
1.8 统计学方法 采用SPSS 22.0 统计软件分析数据,计量资料均以均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析检验,多组间两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 circ_0000285在宫颈癌组织和细胞中高表达 与癌旁正常组织(1.00±0.08)比较,circ_0000285 在宫颈癌组织中表达(2.52±0.37)明显升高(P<0.05);与人正常宫颈癌上皮细胞HOSEpiC(1.00±0.08)比较,circ_0000285 在宫颈癌细胞OV‐CAR-3(3.79±0.51)、A2780(2.98±0.36)和SiHa(2.17±0.29)中表达明显升高(P<0.05)。
2.2 敲减circ_0000285 抑制宫颈癌细胞的增殖、迁移和侵袭 与Blank 组和si-NC 组比较,si-circ_0000285 组细胞中circ_0000285 相对表达量明显降低(P<0.05),说明siRNA circ_0000285 转染成功。细胞功能实验结果显示,与Blank 组和si-NC 组比较,si-circ_0000285 组细胞培养48 h 和72 h 时细胞增殖活性明显降低(P<0.05),细胞培养24 h时细胞迁移和侵袭数目明显减少(P<0.05),见图1、表1。

图1 Transwell检测细胞迁移和侵袭
表1 敲减circ_0000285对宫颈癌细胞增殖、迁移和侵袭的影响 ±s

表1 敲减circ_0000285对宫颈癌细胞增殖、迁移和侵袭的影响 ±s
与Blank组比较,*P<0.05;与si-NC组比较,#P<0.05。
2.3 circ_0000285 靶向miR-637 本研究通过生物信息学网站Circinteractome 预测到circ_0000285 与miR-637 具有结合位点(图2A);双荧光素酶实验结果显示,与miR-NC+circ_0000285 WT 共转染组比较,miR-637+circ_0000285 WT 共转染组细胞中荧光素酶活性明显降低(P<0.05,图2B),说明circ_0000285能够与miR-637靶向结合;qRT-PCR结果显示,与Blank组和si-NC组比较,si-circ_0000285组细胞中miR-637 相对表达量明显升高(P<0.05,图2C),说明敲减circ_0000285 靶向抑制细胞中miR-637的表达。
2.4 circ_0000285 靶向miR-637 调控宫颈癌细胞的增殖、迁移和侵袭 与si-NC组比较,si-circ_0000285组细胞培养48 h 和72 h 时细胞增殖活性明显降低(P<0.05),细胞培养24 h时细胞迁移和侵袭数目明显减少(P<0.05);与si-circ_0000285+anti-NC 组比较,si-circ_0000285+anti-miR-637 组细胞培养48 h和72 h时细胞增殖活性明显增强(P<0.05),细胞培养24 h时细胞迁移和侵袭数目明显增多(P<0.05),见表2,图3。
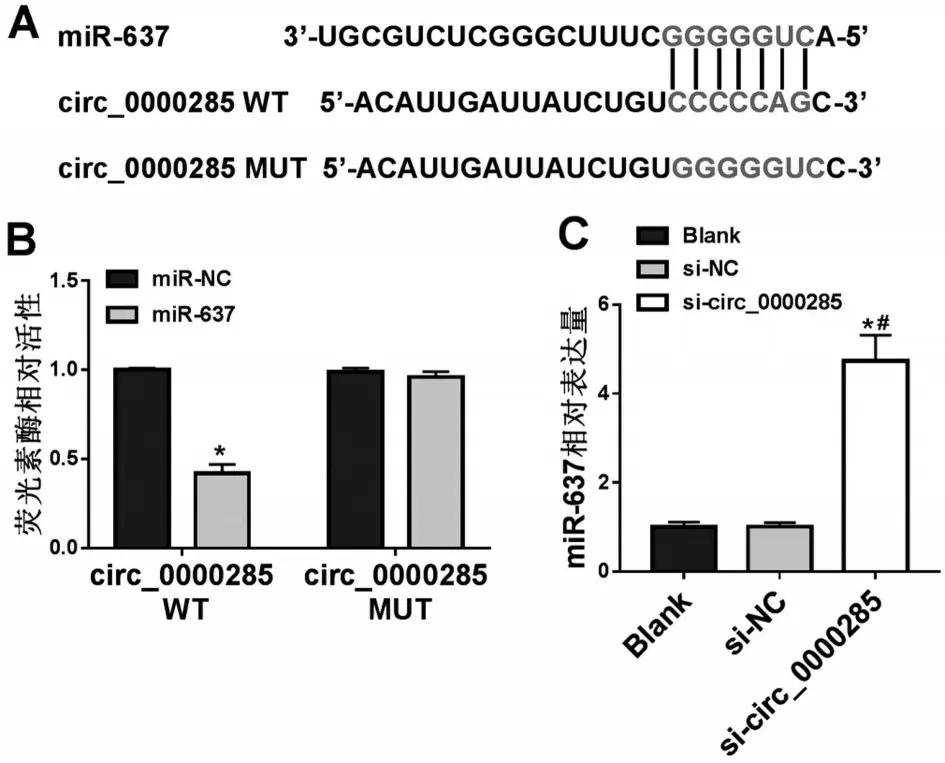
图2 circ_0000285靶向miR-637
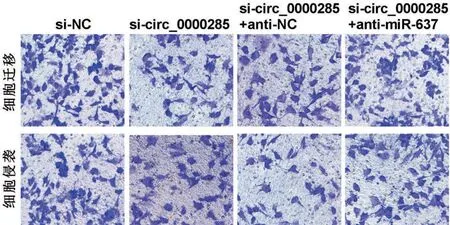
图3 Transwell检测细胞迁移和侵袭
2.5 circ_0000285靶向miR-637调控STAT3的表达 本研究通过生物信息学网站TargetScan 预测到miR-637 与STAT3 3’UTR 具有结合位点(图4A);双荧光素酶实验结果显示,与miR-NC+STAT3 3’UTR WT 共转染组比较,miR-637+STAT3 3’UTR WT 共转染组细胞中荧光素酶活性明显降低(P<0.05,图4B),说明miR-637 能够与STAT3 的3’UTR靶向结合;RT-qPCR 和Western blot 结果显示,与si-NC 组比较,si-circ_0000285组细胞STAT3 mRNA 和蛋白相对表达量明显降低,与si-circ_0000285+anti-NC 组比较,si-circ_0000285+anti-miR-637 组细胞中STAT3 mRNA 和蛋白相对表达量明显升高(P<0.05),见表3、图5。
表2 细胞增殖、迁移和侵袭检测 ±s
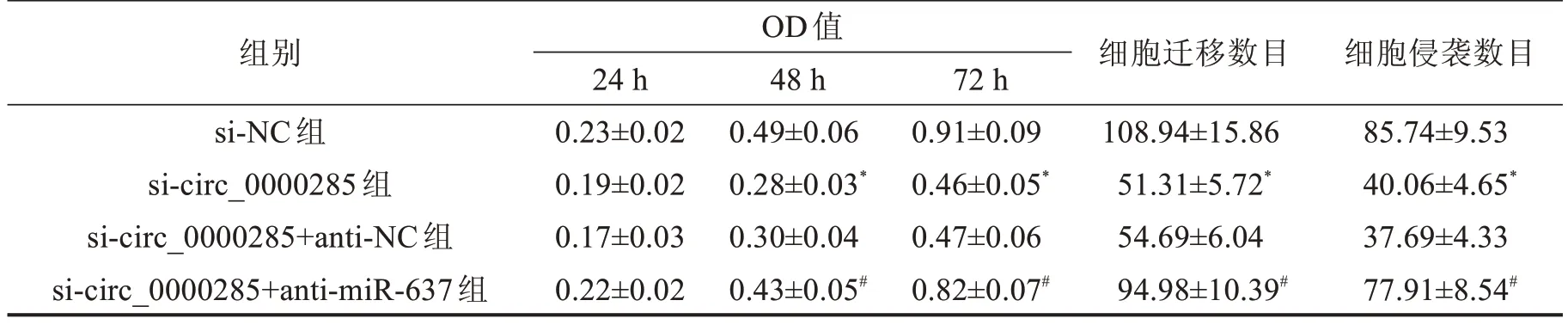
表2 细胞增殖、迁移和侵袭检测 ±s
与si-NC组比较,*P<0.05;与si-circ_0000285+anti-NC组比较,#P<0.05。
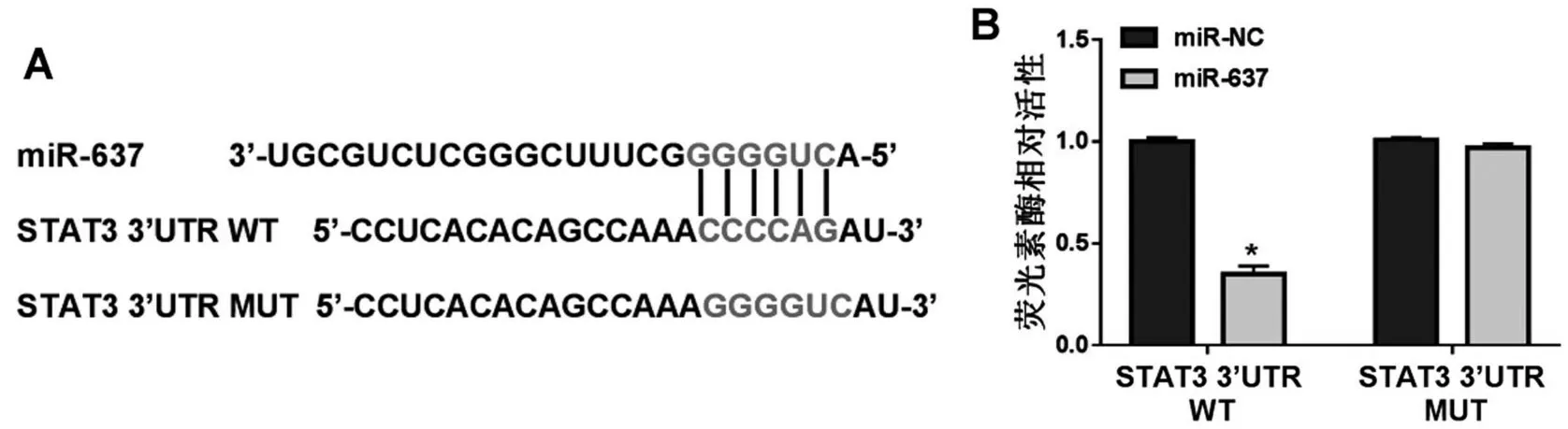
图4 miR-637靶向STAT3

图5 Western blotting检测细胞中STAT3蛋白表达
2.6 miR-637 靶向STAT3 调控宫颈癌细胞的增殖、迁移和侵袭 Western blotting 实验结果显示,与miR-NC组比较,miR-637组细胞中STAT3 mRNA和蛋白表达水平均明显降低(P<0.05);与miR-637+pcDNA 组比较,miR-637+pcDNA-STAT3 组细胞中STAT3 mRNA 和表蛋白达水平均明显升高(P<0.05),见图6,表4。
表3 circ_0000285通过miR-637调控STAT3的表达 ±s
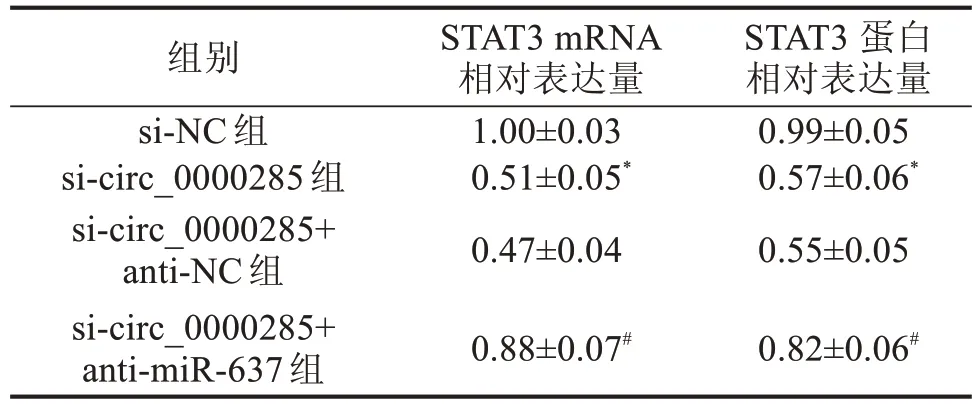
表3 circ_0000285通过miR-637调控STAT3的表达 ±s
与si-NC 组比较,*P<0.05;与si-circ_0000285+anti-NC 组比较,#P<0.05。
与miR-NC组比较,miR-637组细胞培养48 h和72 h时细胞增殖活性明显降低(P<0.05),细胞培养24 h时细胞迁移和侵袭数目明显减少(P<0.05);与miR-637+pcDNA 组 比 较,miR-637+pcDNA-STAT3组细胞培养48 h 和72 h 时细胞增殖活性明显增强(P<0.05),细胞培养24 h时细胞迁移和侵袭数目明显增多(P<0.05),见图7,表5。
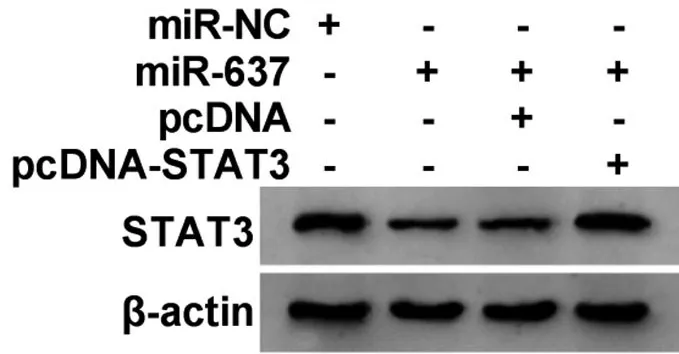
图6 Western blotting检测细胞中STAT3蛋白表达
表4 miR-637调控STAT3的表达 ±s
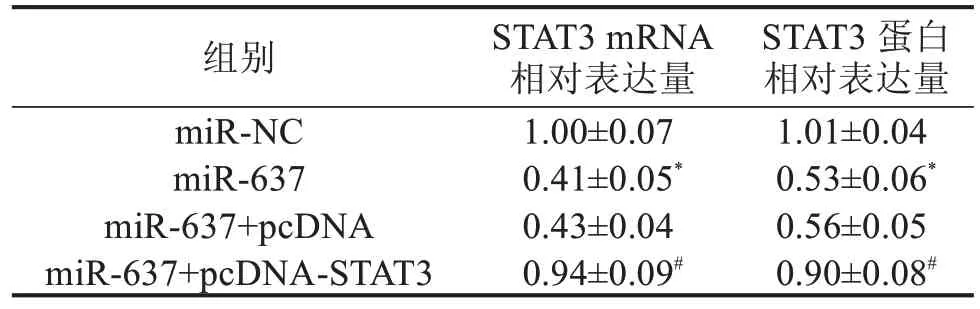
表4 miR-637调控STAT3的表达 ±s
与miR-NC 组比较,*P<0.05;与miR-637+pcDNA 组比较,#P<0.05。
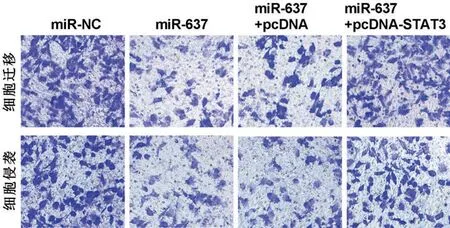
图7 Transwell检测细胞迁移和侵袭
表5 miR-637通过STAT3对宫颈癌细胞增殖、迁移和侵袭的影响 ±s

表5 miR-637通过STAT3对宫颈癌细胞增殖、迁移和侵袭的影响 ±s
与miR-NC组比较,*P<0.05;与miR-637+pcDNA组比较,#P<0.05。
3 讨论
近年来越来越多的证据表明,circRNA 与脑血管性疾病、炎症性疾病、神经性疾病等多种人类疾病有关,尤其与恶性肿瘤的发生密切相关[6-8]。circ_0000285 是一种癌相关的circRNA,Yang、Qin 等[9-10]报道,circ_0000285 在甲状腺癌和喉癌中高表达,其过表达可增强癌细胞的增殖转移能力。但目前circ_0000285 在宫颈癌中病理作用机制尚不完全清楚。本研究结果证实circ_0000285 在宫颈癌组织和细胞中高表达,与Chen 等[12]研究结果一致。细胞功能实验结果表明,敲除circ_0000285 能够抑制宫颈癌细胞的增殖、迁移和侵袭,证实了circ_0000285在宫颈癌进展中发挥癌基因的作用。
功能研究表明,circRNA 作为miRNA 海绵是其参与肿瘤发生发展的重要机制,如Song 等[11]报道,下调circ_101996 通过调控miR-8075 及其靶基因表达,抑制宫颈癌进展;Chen等[12]报道,下调circMTO1通过miR-6893 及其靶基因抑制宫颈癌细胞的转移和化疗耐药性。miR-637 是一种抑癌相关的miR‐NA,被报道在宫颈癌中发挥抑癌作用[13]。本研究通过在线生物信息学数据库预测到circ_0000285 与miR-637 具有结合位点,并针对该结合位点设计合成双荧光素酶质粒,结果证实circ_0000285 可与miR-637靶向结合,在宫颈癌细胞中过表达miR-637后,细胞的增殖、迁移和侵袭均得到抑制,与敲除circ_0000285的作用效果一致,而抑制miR-637则能逆转circ_0000285 的功能,提示circ_0000285 通过竞争性结合miR-637影响宫颈癌细胞的恶性生物学行为。
STAT3是一类DNA结合蛋白,因其能够介导细胞的恶性转化而被认为是一种癌基因[14]。功能研究表明,miRNA 可通过与靶基因3’UTR 区结合实现对靶基因的转录后调控,从而调控相关疾病的发生和进展[15]。本研究结合生物信息学分析与荧光素酶实验证实miR-637 可与STAT3 的3’UTR 靶向结合,并证实宫颈癌细胞中敲除circ_0000285 或过表达miR-637 均能够抑制STAT3 的mRNA 和蛋白表达,而抑制miR-637 则能逆转circ_0000285 对STAT3 mRNA 和蛋白表达的影响,说明circ_0000285 可通过靶向miR-637调控细胞中STAT3基因表达。细胞功能实验结果,过表达STAT3 能够逆转miR-637 对细胞增殖、迁移和侵袭的影响。提示circ_0000285作为miR-637 的海绵,通过进一步调控其靶基因STAT3 的表达,影响宫颈癌细胞的增殖、迁移和侵袭。
综上所述,本研究证实了circ_0000285 可通过竞争性结合miR-637,间接调控其靶基因STAT3 的表达,调控宫颈癌细胞的增殖、迁移和侵袭过程。circ_0000285/miR-637/STAT3 轴为宫颈癌的发生机制提供了新的思路,提示circ_0000285 作为宫颈癌潜在治疗靶点的可能性。
猜你喜欢
杂志排行
广西医科大学学报的其它文章
- Effect of miR-200a-3p targeting transthyretin(TTR)on the biological behavior of placental trophoblasts in hypertensive disorder complicating pregnancy
- 沙利度胺对重型β地中海贫血患者红系细胞γ珠蛋白基因表达及分化的作用研究*
- CEMIP调控Src/AKT/STAT3信号通路对非小细胞肺癌上皮间质转化及细胞侵袭、迁移的影响*
- 乳铁蛋白对正畸复发移动过程中牙周改建的影响*
- 秦皮苷对脂多糖诱导的软骨细胞氧化应激和炎症因子的影响*
- miR-133b-3p对大鼠脑缺血/再灌注损伤的影响及其作用机制*
