川芎嗪眼用脂质体温敏凝胶的制备及体内外特性评价
2021-03-02李维陈梁尹丹杨昊周佳仪宋雨张艳邹亮
李维 陈梁 尹丹 杨昊 周佳仪 宋雨 张艳 邹亮

摘 要 目的:制備川芎嗪眼用脂质体温敏凝胶,考察其体内外特性。方法:采用硫酸铵梯度法制备川芎嗪脂质体,以正交试验优化制备工艺,并以泊洛沙姆P407为凝胶基质进一步制成温敏凝胶。采用无膜溶出模型对该凝胶的溶蚀性和体外释药特性进行研究;采用改良Franz扩散池考察其角膜透过性,并进一步测定角膜水化值;采用MTT法评价该凝胶对人角膜上皮细胞HCE-T增殖的影响;采用苏木素-伊红染色法和Draize眼部刺激评分考察该凝胶对家兔角膜的刺激性,并观察其眼部组织学变化。结果:川芎嗪脂质体的最优制备工艺为药脂比1 ∶ 10(m/m)、硫酸铵溶液浓度0.2 mol/L、磷脂与胆固醇质量比4 ∶ 1、孵育温度45 ℃;再以23%质量分数的泊洛沙姆P407作为凝胶基质制得川芎嗪眼用脂质体温敏凝胶。该凝胶具有良好的胶凝温度;其溶蚀和体外释药均呈零级动力学特征,且体外释药主要与溶蚀相关(R2=0.993 4)。该凝胶6 h内累计透过量为43.3%;角膜水化值为72.98%。低、中质量浓度(1、5 mg/L)的川芎嗪眼用脂质体温敏凝胶对HCE-T细胞无明显增殖毒性,但其在高质量浓度(10 mg/L)时显示出一定的细胞毒性。该凝胶对家兔角膜的Draize眼部刺激平均评分属于无刺激范围,且家兔角膜组织学未见异常变化。结论:所制备的川芎嗪眼用脂质体温敏凝胶具有适宜的胶凝温度,对角膜渗透性好、刺激性小。
关键词 川芎嗪眼用脂质体;温敏凝胶;制备工艺;体外释药特性;人角膜上皮细胞HCE-T;眼部刺激性;角膜组织学
中图分类号 R943;R285.5 文献标志码 A 文章编号 1001-0408(2021)03-0320-08
DOI 10.6039/j.issn.1001-0408.2021.03.12
ABSTRACT OBJECTIVE: To prepare Liguatrazine ophthalmic liposome thermosensitive gel, and to investigate its in vivo and in vitro characteristics. METHODS: The ammonium sulfate gradient method was used to prepare Liguatrazine liposomes. The preparation technology was optimized by using orthogonal test. Using poloxamer P407 as gel matrix, Liguatrazine liposomes were prepared into thermosensitive gel. A membraneless model was used to study the dissolution and in vitro drug release of the gel. The modified Franz diffusion cell was used to investigate corneal permeability and further determine corneal hydration value. The effects of the gel on the proliferation of human corneal epithelial cell HCE-T. HE staining and Draize test were used to investigate the stimulatory effects of the gel on corneal cells of the rabbit, and the histological changes of the eyes were observed. RESULTS: The optimal preparation technology of Liguatrazine liposome was drug-lipid ratio of 1 ∶ 10(m/m), the ammonium sulfate concentration of 0.2 mol/L, phospholipid-cholesterol ratio of 4 ∶ 1 (m/m), incubation temperature of 45 ℃. Then ligustrazine ophthalmic liposome thermosensitive gel was prepared with 23% poloxamer P407 as gel matrix. The gel had good gelatinization temperature. The in vitro drug release and dissolution showed zero-order kinetic characteristics, and in vitro drug release of the gel was mainly related to dissolution (R2=0.993 4). The cumulative transcorneal permeability of the gel was 43.3% within 6 hours and corneal hydration value was 72.98%. Low and medium concentrations (1, 5 mg/L) of Ligustrazine ophthalmic liposome thermosensitive gel had no obvious proliferation toxicity to HCE-T cells, but it showed cytotoxicity at high concentration (10 mg/L). The mean Draize eye irritation score of the gel on rabbit cornea was within non-stimulation, and there was no abnormal change in rabbit corneal histology. CONCLUSIONS: Prepared Ligustrazine ophthalmic liposome thermosensitive gel has a suitable phase transition temperature, good corneal permeability, and low corneal irritation.
KEYWORDS Ligustrazine ophthalmic liposome; Thermosensitive gel; Preparation technology; in vitro drug release; Human corneal epithelial cell HCE-T; Eye irritation; Corneal histology
川芎嗪(Ligustrazine)即四甲基吡嗪(Tetramethylpyrazine,TMP),是中药川芎(Ligusticum chuanxiong Hort.)的主要有效成分。传统医学认为,川芎味辛,性温,归肝、胆、心经,具有活血祛瘀、行气开郁的功效;其药效主要包括活血与行气两方面,其中活血功效最为关键,符合中医眼疾治则,而其有效成分制剂川芎嗪注射液可用于临床治疗视网膜相关疾病[1]。现代药理研究表明,川芎嗪具有抗炎、抗氧化、增强心肌收缩力、减少脑损伤、保护冠状动脉、抗血栓等多种药理活性[2-7]。近年来,研究人员发现川芎嗪具有抗血管内皮生长因子(VEGF)、抑制眼部新生血管等作用[8-9],可用于眼部新生血管疾病的防治。然而,眼是一个相对独立的器官,其解剖结构含有无血成分和中枢神经系统成分等,其特殊的生理屏障大大限制了药物的有效传递[10],因此亟需寻找一种新型眼用给药系统来提高眼部递药效率和生物利用度。
有研究者制备了川芎嗪脂质体并发现其可持续释放药物到达角膜或结膜,但由于角膜屏障的存在,同时受泪液冲刷的影响,大多数药物会随着眼泪排出,余下药物则部分进入鼻泪管、部分经过结膜入血进入体循环[11]。因此,单独使用脂质体递药存在眼部滞留时间短、生物利用度低等问题,只能通过增加给药次数和提高药物浓度来达到治疗效果[12],患者使用不便,易产生全身毒副作用[13]。脂质体温敏凝胶剂(Liposome thermosensitive gel)是一种新型复合剂型,是将脂质体分散在凝胶基质中形成的新型复合凝胶,常温下为液态,若给药部位温度高于胶凝温度,可立即转为非化学交联的半固定凝胶,这样不仅能保持脂质体自身固有特性,还能延长脂质体在角膜上的滞留时间,从而延缓药物释放、增强药物吸收[14]。泊洛沙姆P407是一种具有良好的生物相容性和缓释性、局部惰性、低毒性并易与其它剂型配伍的温度敏感材料,常在外用溶液中作为凝胶基质使用[15]。笔者以泊洛沙姆P407作为凝胶基质制备川芎嗪眼用脂质体温敏凝胶,以期提高药物在眼部的传递效率,延长药物作用时间,减少给药次数,改善患者顺应性,提高药物的生物利用度。
1 材料
1.1 主要仪器
本研究使用的主要仪器有:1100型高效液相色谱(HPLC)仪(美国Agilent公司)、ZEN3600型纳米粒度仪(英国Malvern公司)、改良Franz扩散池(上海锴凯科技贸易有限公司)、CPA225D型十万分之一电子分析天平(德国Sartorius公司)、KMH1型超声波清洗机(宁波新芝生物科技股份有限公司)、HH-4型数显恒温水浴锅(常州澳华仪器有限公司)、DF-101S型集热式恒温加热磁力搅拌器(郑州汇成科工贸有限公司)、RE-2000B型旋转蒸发仪(上海亚荣生化仪器厂)、Ymnl-1000Y型超声波细胞粉碎机(南京以马内利仪器设备有限公司)、UPH-Ⅱ-10T型超纯水制造系统(四川优普超纯科技有限公司)、Tecnai G2 F20 S型透射电镜(TEM,美国FEI公司)。
1.2 主要药品与试剂
本研究使用的主要药品与试剂有:川芎嗪对照品[萨恩化学技术(上海)有限公司,批号EH230112,纯度≥99%],卵磷脂[分析纯,阿拉丁试剂(上海)有限公司,批号D1918047],胆固醇、泊洛沙姆P407(分析纯,大连美仑生物技术有限公司,批号分别为F0119A、J0102A), L-氧化型谷胱甘肽、二水氯化鈣(上海源叶生物科技有限公司,批号分别为Q14D9J77577、Z01M10Y81919),磷酸盐缓冲溶液(PBS,pH 6.8)、胰蛋白酶、DMEM高糖培养基[赛默飞世尔科技(中国)有限公司,批号分别为8119056、8119244、8119181],胎牛血清(FBS)、青霉素-链霉素双抗(浙江天杭生物科技股份有限公司,批号分别为19030604、J180025),MTT试剂盒(上海碧云天生物技术有限公司,批号042319190619),2%磷钨酸负染色液(北京索莱宝科技有限公司),苏木素-伊红(HE)染色液(北京世济合力生物科技有限公司),二甲基亚砜(武汉博士德生物工程有限公司),硫酸铵、氯化钠、氯化镁、三氯甲烷、葡萄糖、碳酸氢钠、氯化钾、磷酸二氢钾、生理盐水、二甲苯、无水乙醇等(成都市科隆化学品有限公司),超纯水。
1.3 动物
本研究所用动物为新西兰大白兔,雄性,体质量2.0~2.5 kg,由成都达硕实验动物有限公司提供,动物生产许可证号为SCXK(川)2020-030。
1.4 细胞
本研究所用细胞为人角膜上皮细胞HCE-T,由北京北纳创联生物技术研究院提供。
2 方法与结果
2.1 川芎嗪的含量测定
2.1.1 色谱条件 色谱柱为Agilent Zorbax SB-C18(250 mm×4.6 mm,5 μm),流动相为乙腈-水(90 ∶ 10,V/V),检测波长为280 nm,流速为0.8 mL/min,柱温为30 ℃,进样量为10 μL。
2.1.2 含量测定 精密称取川芎嗪对照品10.23 mg,置于10 mL量瓶中,加甲醇超声(频率40 kHz,功率100 W)溶解并定容,得川芎嗪对照品贮备液。分别精密量取0.05、0.10、0.15、0.20、0.25、0.30 mL对照品贮备液置于10 mL量瓶中,加甲醇定容,制成系列对照品溶液;摇匀,各取1 mL,以0.22 ?m微孔滤膜滤过后取续滤液10 ?L,按上述色谱条件进样测定,记录峰面积。以峰面积(Y)对川芎嗪质量浓度(X)进行线性回归,得回归方程为Y=13 532X-10 531(R2=0.999 5)。结果表明,川芎嗪的质量浓度在5.08~30.48 ?g/mL范围内与其峰面积线性关系良好。
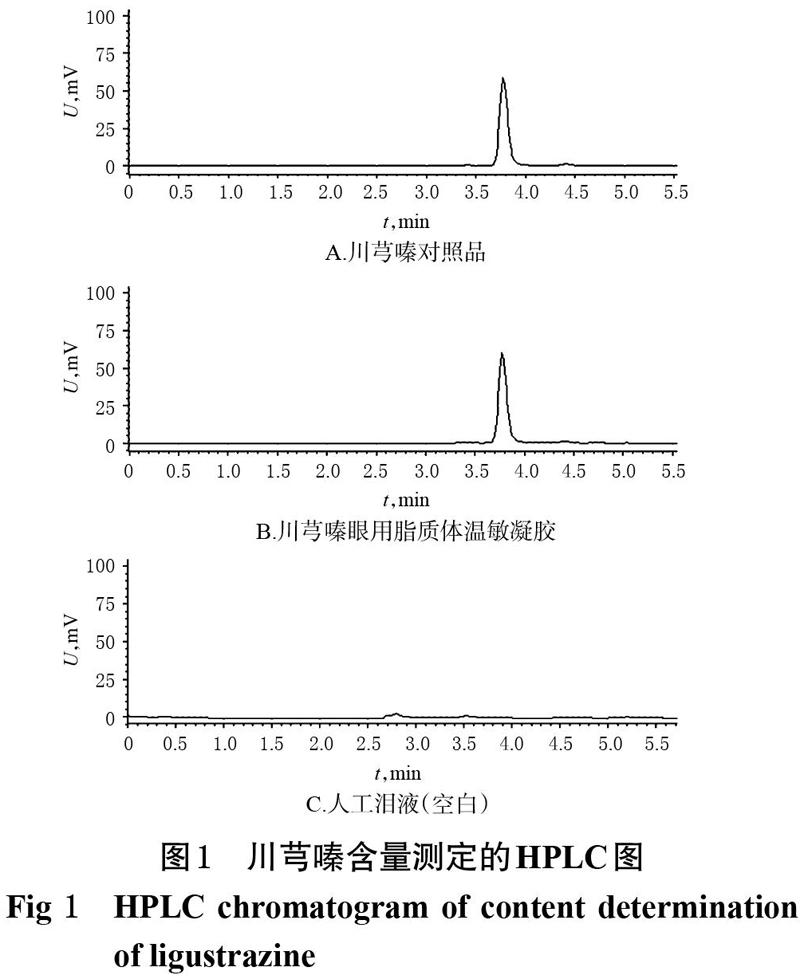
分别取川芎嗪对照品溶液、川芎嗪眼用脂质体温敏凝胶、人工泪液(空白)各1 mL,以0.22 ?m微孔滤膜滤过后取续滤液10 ?L,按上述色谱条件进样测定,记录色谱图。结果可得,川芎嗪的保留时间约为3.8 min,理论板数按川芎嗪峰计算应不低于3 000,空白无干扰,详见图1。
2.2 川芎嗪脂质体的制备
根据川芎嗪的理化性质,采用硫酸铵梯度法制备川芎嗪脂质体[16-17]。精密称取处方量的卵磷脂、胆固醇置于250 mL茄形瓶中,加入约10 mL三氯甲烷溶解,于37 ℃水浴减压旋蒸形成均匀薄膜,再加入8 mL 0.2 mol/L的硫酸铵溶液,水化脱膜形成多室脂质体后置于冰浴(0±0.5) ℃中超声2 min(功率400 W,频率40 kHz,每超声3 s后暂停3 s),然后装入透析袋于生理盐水中透析24 h,每隔4 h更换生理盐水,得到空白脂质体。在空白脂质体中按一定药脂比[即川芎嗪与脂类(磷脂和胆固醇)的质量比]加入川芎嗪对照品溶液,于45 ℃下孵育20 min,得到川芎嗪脂质体。
2.3 川芎嗪脂质体制备工艺考察
2.3.1 单因素试验 以包封率为指标,按“2.2”项下方法考察药脂比(1 ∶ 5、1 ∶ 10、1 ∶ 15、1 ∶ 20,m/m)、孵育温度(25、35、45、55 ℃)、孵育时间(10、20、30、40 min)、硫酸铵溶液浓度(0.1、0.2、0.3、0.4 mol/L)、卵磷脂与胆固醇质量比(1 ∶ 1、2 ∶ 1、3 ∶ 1、4 ∶ 1)、磷脂质量分数(0.8%、1.0%、1.2%、1.5%)、超声功率(300、400、500、600 W)和超声时间(2、4、6、8 min)等因素对川芎嗪脂质体包封率的影响[包封率(%)=W包封/W总量×100%,式中W包封为被脂质体包封的药物量,W总量为实际加入的总药物量]。结果,在药脂比为1 ∶ 15(m/m)、孵育温度为45 ℃、孵育时间为20 min、硫酸铵溶液浓度为0.3 mol/L、卵磷脂与胆固醇质量比为4 ∶ 1、磷脂质量分数为1.2%、超声功率为400 W、超声时间为2 min时,所制脂质体包封率较高。
2.3.2 正交试验 根据单因素试验结果,选择对包封率影响较大的因素[药脂比(A)、硫酸铵浓度(B)、卵磷脂与胆固醇质量比(C)、孵育温度(D)]设计 L9(34)正交试验。川芎嗪脂质体制备工艺的正交试验因素与水平见表1;正交试验设计及结果见表2;方差分析结果见表3。
由表1、表2可知,各因素对川芎嗪包封率影响的大小顺序为:B>C>A>D,即硫酸铵浓度>卵磷脂与胆固醇质量比>药脂比>孵育温度。由表3可知,4种因素对川芎嗪包封率均无显著性影响(P>0.05)。结合表1~表3结果,综合考虑得最优工艺为A1B2C3D3,即药脂比为1 ∶ 10、硫酸铵浓度为0.2 mol/L、磷脂与胆固醇质量比为4 ∶ 1、孵育温度为45 ℃。
2.3.3 验证试验 依据“2.3.2”项下确定的最优工艺,按“2.2”项下方法平行制备川芎嗪脂质体3批,测定其包封率。结果,3批样品的平均包封率为(15.82±0.06)%(n=3),表明优化后的工艺稳定、可行。
2.4 川芎嗪脂质体的表征及评价
2.4.1 粒径测定 取川芎嗪脂质体适量,加水1 mL稀释,采用纳米粒度仪测量其粒径,重复3次。结果,川芎嗪脂质体的平均粒径为(185.6±5.0) nm(n=3),多分散度指数(PDI)为0.22±0.03(n=3),详见图2A。根据文献报道,粒径小于200 nm的脂质体有利于眼部药物递送[18],因此本研究制备的川芎嗪脂质体可进一步用于非侵入性眼部给药。
2.4.2 粒子形态观察 取川芎嗪脂质体适量,加适量水稀释,沾取少量置于铜网上,以滤纸吸走多余水分,2%磷钨酸负染色液负染2~3 min,自然干燥后置于TEM下观察、拍照。结果,镜下可见川芎嗪脂质体粒子较圆整、呈均匀球形、大小较平均,该结果与粒径测定结果相符合,详见图2B。
2.4.3 pH值测定 取川芎嗪脂质体5 mL,加入5 mL新煮沸并冷却至室温的水,搅拌均匀,在室温下测定其pH值,平行测定3批。结果,3批样品的平均pH值为7.10±0.12(n=3),符合眼用制剂pH值要求(pH 6.0~8.0)[19]。
2.5 川芎嗪眼用脂质体温敏凝胶的制备
取5 g泊洛沙姆P407加至10 mL水中,于4 ℃冷藏,使基质充分溶胀、溶解均匀,得到凝胶基质溶液。在冰水浴中向川芎嗪脂质体加入适量凝胶基质溶液,使得泊洛沙姆P407占温敏凝胶的质量分数为23%,搅拌混合均匀,即得川芎嗪眼用脂质体温敏凝胶,备用。
2.6 川芎嗪眼用脂质体温敏凝胶胶凝温度的测定
2.6.1 人工泪液的配制 取氯化钠6.78 g、碳酸氢钠2.18 g、二水氯化钙0.084 g、氯化钾1.38 g,置于同一 1 000 mL量瓶中,以水溶解并定容至1 000 mL,于4 ℃冷藏,备用。
2.6.2 测定方法及结果 采用倾斜试管法测定胶凝温度[20]。取2.0 mL川芎嗪眼用脂质体温敏凝胶,置于西林瓶中,插入温度计至液面以下1/3高度处。将西林瓶置于恒温水浴锅中,以1 ℃/min缓慢升温,每隔1 min将西林瓶取出,倾斜90°,观察内容物状态,当瓶内液体不流动时的温度即为胶凝温度。平行测定5次,取平均值。另取川芎嗪脂质体温敏凝胶适量,滴加至人工泪液(已于35 ℃恒温30 min)中,观察胶凝状态,并考察不同质量分数的泊洛沙姆P407对该凝胶胶凝状态的影响,结果见表4。由表4可知,当川芎嗪眼用脂质体温敏凝胶中泊洛沙姆P407的质量达到该凝胶总质量的23%时,在24.30 ℃可形成凝膠;将其直接滴入35 ℃恒温人工泪液中,能够较好地形成凝胶,符合实际给药要求。
2.7 川芎嗪眼用脂质体温敏凝胶的溶蚀性和体外释药特性考察
采用无膜溶出模型考察川芎嗪眼用脂质体温敏凝胶的溶蚀性和体外释药特性[21]。将5 g川芎嗪眼用脂质体温敏凝胶置于已称定质量的西林瓶中,记录初始质量,然后置于(35.0±0.5) ℃恒温水浴锅中加热至其完全胶凝。向该西林瓶中加入同温度的人工泪液2 mL,在一定频率(10 kHz)下恒温振荡20 min后立即取出,倒出人工泪液,将瓶拭干后迅速称质量。重新将西林瓶放入恒温水浴锅中平衡温度,补充同温度的人工泪液至初始质量,继续振荡20 min。如此反复操作,直至剩余凝胶质量不足起始量的10%为止。平行测定3次。相邻时间点的瓶内剩余凝胶质量差即为此期间凝胶溶蚀量,凝胶溶蚀率=凝胶溶蚀量/初始质量。以凝胶溶蚀率(Y)为纵坐标、时间(X)为横坐标绘制凝胶溶蚀曲线,详见图3。由图3可知,川芎嗪眼用脂质体温敏凝胶的溶蚀呈零级动力学特征,计算得回归方程为Y=0.280 5X+2.100 8(R2=0.998 6)。
分别吸取上述凝胶溶蚀曲线每个时间点对应的人工泪液1 mL至10 mL量瓶中,以甲醇超声(频率40 kHz,功率100 W)破乳并定容,经0.22 μm微孔滤膜滤过,按“2.1.1”项下色谱条件测定人工泪液中川芎嗪的含量,平行测定3次。以某时间点累计释放药物总量除以加入药物总量可得该时间点的体外累计释放率,再以体外累计释放率(Y)为纵坐标、时间(X)为横坐标绘制体外释药曲线,详见图4。由图4可知,川芎嗪眼用脂质体温敏凝胶的体外释药亦呈零级动力学特征,计算得回归方程为Y=0.256 8X+7.630 8(R2=0.987 6)。
以凝胶溶蚀率(Y)对体外累计释放率(X)进行线性回归,得回归方程为Y=0.917 7X+5.605 2(R2=0.993 4),说明两者相关性良好,该凝胶的体外释药主要与其溶蚀相关。
2.8 不同川芎嗪制剂的离体角膜透过性实验
2.8.1 谷胱甘肽-碳酸氢钠林格溶液(GBR溶液)的配制 A溶液:称取氯化钠12.49 g、氯化钾0.716 g、磷酸二氢钾0.206 g、碳酸氢钠4.908 g,加水溶解并定容至1 000 mL;B溶液:称取氯化钙0.23 g、氯化镁 0.318 g、葡萄糖 1.80 g、L-氧化型谷胱甘肽 0.184 g,加水溶解并定容至 1 000 mL;A、B溶液均于4 ℃貯存,临用时按1 ∶ 1(V/V)比例配制成GBR溶液,现配现用[22]。
2.8.2 离体角膜的准备 耳缘静脉注射空气处死家兔后20 min内开始实验:摘除眼球,冲去表面附着的血块,置于35 ℃的GBR溶液(于水浴锅中放置30 min使温度维持在35 ℃)中以保存离体角膜活性;清除巩膜表面的动眼肌和睑结膜附属组织,由视神经纵向前剖开眼球,至距角膜边缘约2 mm的巩膜处横切,分离角膜,除去晶状体、玻璃体等眼球后部组织,用眼科镊子轻轻剥离虹膜、睫状体,得到带有2 mm巩膜环的角膜,用GBR溶液淋洗3次,备用。
2.8.3 离体角膜透过性实验 取“2.8.2”项下准备好的离体角膜,固定于改良Franz扩散池的供给池和接受池之间,将角膜上皮层面向供给池;接受池内装满人工泪液(内含一个搅拌子)。在供给池内先加入恒温35 ℃的人工泪液50 μL以模拟眼部湿润环境,再分别加入pH 6.8的川芎嗪水溶液(取川芎嗪对照品适量加入含0.1%二甲亚砜的PBS溶液,制得1.00 mg/mL的川芎嗪水溶液)、川芎嗪脂质体、川芎嗪眼用脂质体温敏凝胶各0.5 mL,将整个装置置于(35±1) ℃的恒温磁力搅拌器上搅拌并开始计时,分别于1、2、3、4、5、6 h时从接受池取样0.65 mL(同时补加等体积同温度的人工泪液)。从接受池取出的样品经甲醇(取样液与甲醇体积比为1 ∶ 1)破乳并经0.22 μm微孔滤膜滤过后,按“2.1.1”项下色谱条件进样分析,平行3次,记录峰面积,代入“2.1.2”项下回归方程计算待测样品中川芎嗪的质量浓度,再分别按下述公式计算各样品的累计透过量(Qn):
式中,V0为接受池中溶液体积,cn 为t时间下测定的药物浓度,V为取样体积,ci 为第i个(i=n-1)时间点测定的药物浓度。以累计透过量对时间作图,详见图5。由图5可知,川芎嗪水溶液在前3 h透过离体角膜较快,3 h后透过速率降低,6 h内累计透过量为56.8%;川芎嗪脂质体总体上以恒定的速率(即曲线斜率)透过离体角膜;川芎嗪眼用脂质体温敏凝胶的透过速率较脂质体和水溶液更慢,6 h内累计透过量为43.3%,且实验结束时供给池内仍有约1/2凝胶尚未溶蚀。
2.8.4 角膜水化值考察 取“2.8.3”项下川芎嗪水溶液组、川芎嗪脂质体组和川芎嗪眼用脂质体温敏凝胶组离体角膜,剪去未暴露于GBR溶液的角膜区域。称取暴露于GBR溶液的角膜区域质量,记为Wb;将其于65 ℃干燥12 h后再次称质量,记为Wa,计算角膜水化值[角膜水化值=(Wb-Wa)/Wb],结果见表5。
角膜水化值是体外评价物质对角膜组织刺激性的重要指标,若大于83%即可判定角膜受到一定程度的损伤[23]。由表5可知,川芎嗪脂质体和川芎嗪眼用脂质体温敏凝胶的角膜水化值都小于83%,对角膜刺激性小;但川芎嗪水溶液的角膜水化值大于83%,表明其对角膜的刺激性大,究其原因,可能是因为未包封的川芎嗪原型药物直接与角膜上皮细胞接触,破坏了角膜上皮和内皮细胞的紧密连接,进而使得角膜的水通透性增加。
2.9 不同川芎嗪制剂对HCE-T细胞增殖的影响
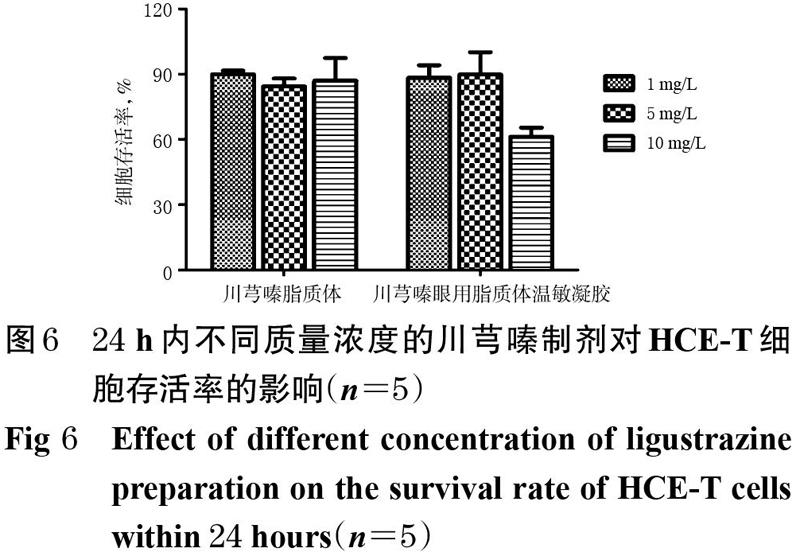
将HCE-T细胞采用DMEM高糖培养基于37 ℃、5% CO2条件下培养。当HCE-T细胞培养到70%~80%融合程度后用PBS清洗2次,加入1 mL胰蛋白酶消化2 min。当细胞变圆并开始脱落时加入DMEM高糖培养基5 mL终止消化且吹打均匀,采用15 mL的离心管收集混悬的细胞液,以1 000 r/min离心 5 min,弃去上清液,加入DMEM高糖培养基2 mL,轻轻吹打混匀,制得细胞悬液。将细胞悬液以5×103个/孔接种于96孔板中,分为给药组(不同浓度药物+细胞)、空白组(含细胞不含药物)和调零组(只含培养基),放入培养箱中培养16 h使细胞贴壁后弃去培养液,再分别加入低、中、高质量浓度的药物溶液[川芎嗪脂质体和川芎嗪眼用脂质体温敏凝胶,均分别为1、5、10 mg/L(以川芎嗪计)],继续培养24 h。弃去培养液,加入含MTT的PBS溶液后放置4 h,弃去含MTT的培养液,每孔加入150 μL二甲基亚砜,振荡20 min后采用酶标仪在490 nm波长处测定吸光度(A),按下述公式计算细胞存活率:细胞存活率=(A给药- A调零)/(A空白-A调零) 。式中,A给药、A调零、A空白分别表示给药组、调零组、空白组的吸光度。试验重复5次。24 h内不同质量浓度的川芎嗪制剂对HCE-T细胞存活率的影响见图6。
由图6可知,低、中、高质量浓度(1、5、10 mg/L)的川芎嗪脂质体和低、中质量浓度(1、5 mg/L)的川芎嗪眼用脂质体温敏凝胶对HCE-T细胞无明显的增殖毒性(细胞存活率>85%);高质量浓度(10 mg/L)的川芎嗪眼用脂质体温敏凝胶对HCE-T细胞显示出了一定的毒性,可能是由于高质量浓度脂质体温敏凝胶基质材料较多,改变了培养基的状态,影响了细胞的正常生长。
2.10 川芎嗪眼用脂质体温敏凝胶的眼部刺激性考察
取家兔6只,将其右眼作为实验眼,给予适量川芎嗪眼用脂质体温敏凝胶;左眼作为对照眼,给予等量生理盐水。分别记录单次给药后2、6、12、24、72、96、120、144、168 h时兔眼的角膜、结膜、虹膜及其他前节组织情况,按照Draize眼刺激实验评分标准[24-25]进行眼部刺激性考察,详见表6、表7。结果显示,实验眼的结膜多数在第1次给药后产生少量分泌物,平均评分为(0.83±0.75)分,其余时间点两组兔眼前节组织评分均为0分,均在0~3分的無刺激性范围内。
2.11 川芎嗪眼用脂质体温敏凝胶对兔眼角膜组织学的影响
取“2.10”项下实验家兔,于最后一次实验眼的眼表滴入川芎嗪眼用脂质体温敏凝胶后12 h分离出角膜组织,以10%中性福尔马林固定、梯度乙醇脱水、二甲苯清洗、石蜡固定、切片(厚度为3 μm),再以HE染色,用显微镜观察兔眼角膜及视网膜组织学改变;取另一只滴入生理盐水的对照眼同法操作,作为对照,结果见图7。由图7可知,滴入川芎嗪眼用脂质体温敏凝胶的兔眼角膜上皮细胞分层良好,基质层纤维排列规则,均未见炎性细胞;角膜上皮、前界层、角膜基质、后界层和角膜内皮细胞结构完整、排列整齐,各层细胞分界清晰,与对照眼比较无明显差异,表明川芎嗪眼用脂质体温敏凝胶对角膜无刺激性。
3 讨论
泊洛沙姆P407为聚氧乙烯-聚氧丙烯醚-聚氧乙烯三嵌段共聚物,在低温或低浓度条件下为液体,升温至胶束温度且达到临界胶束浓度时可发生胶凝[26]。由于其毒性低、刺激性小、缓/控释作用突出,故成为了目前较为常用的眼、鼻以及直肠给药载体[27-29]。而脂质体亲和性好、渗透性优、安全无毒,已广泛地应用在制剂领域。本研究将两种载体相结合,将脂质体均匀地分布在泊洛沙姆P407中,能防止其聚集、融合,可进一步地提高其稳定性。普通滴眼液与脂质体入眼后,很快地被泪液稀释冲蚀,在角膜滞留时间短,以致用于眼部病患处的药物量常常不足。而脂质体温敏凝胶以溶液状态给药,能迅速形成凝胶黏附于角膜,可缓慢地透过角膜屏障递送药物,避免了持续大剂量给药引起的多种不良反应[30-31]。
本研究首先考察了川芎嗪眼用脂质体温敏凝胶的制备工艺,再从其体外释药特性和对角膜的刺激性两方面对制剂质量进行了评价。结果显示,所制备的川芎嗪眼用脂质体温敏凝胶给药方便、胶凝温度适宜,能在眼部湿润条件下产生相变从而黏附在角膜上持续给药。通过凝胶溶蚀和体外释药实验可知,川芎嗪眼用脂质体温敏凝胶的释放主要与其溶蚀相关。在离体角膜实验中,川芎嗪眼用脂质体温敏凝胶的6 h累计透过量为43.3%,展现了较好的生物相容性。川芎嗪眼用脂质体温敏凝胶相较于川芎嗪脂质体显示了缓释的优势,其药物的释放很大程度上依赖于凝胶的溶蚀。在6 h角膜透过实验中,能明显看见供给池中还有约1/2的凝胶未被溶蚀,且角膜水化值小于83%,可见川芎嗪眼用脂质体温敏凝胶缓释性好。通过离体角膜水化值测定、体外细胞增殖毒性实验、家兔角膜刺激性考察和角膜组织学观察,进一步证实了川芎嗪眼用脂质体温敏凝胶安全性较高、刺激性较小,体现了脂质体凝胶作为一种生物利用度高且安全刺激性小的新型局部给药系统,对眼部疾病的防治具有现实意义。
综上所述,本研究所制备的川芎嗪眼用脂质体温敏凝胶具有适宜的胶凝温度,对角膜渗透性好、刺激性小。本研究可为川芎嗪眼部制剂的进一步研发提供依据,但也存在不足之处:所制备的川芎嗪脂质体的包封率有待进一步提高;由于体外药物释放特性与体内药物释放特性具有一定差异,而本研究只考察了该凝胶的体外药物释放特性,因此有关川芎嗪脂质体和川芎嗪眼用脂质体温敏凝胶的跨膜转运机制及药效学作用有待进一步研究。
参考文献
[ 1 ] 雍智谋,李春林.不同剂量川芎嗪治疗非增殖期糖尿病视网膜病变的疗效[J].国际眼科杂志,2019,19(3):380- 383.
[ 2 ] GAO B,LIN XS,JING H,et al. Local delivery of tetramethylpyrazine eliminates the senescent phenotype of bone marrow mesenchymal stromal cells and creates an anti-inflammatory and angiogenic environment in aging mice[J]. Aging Cell,2018,17(3):e12741.
[ 3 ] GONG XZ,IVANOV VN,DAVIDSON MM,et al. Tetramethylpyrazine (TMP) protects against sodium arsenite- induced nephrotoxicity by suppressing ROS production,mitochondrial dysfunction,pro-inflammatory signaling pathways and programed cell death[J]. Arch Toxicol,2015,89(7):1057-1070.
[ 4 ] 孙旋,冯卓蕾,陈娜.川芎嗪对过氧化氢致大鼠视网膜神经节细胞氧化损伤的抑制作用及机制[J].眼科新进展,2019,39(6):515-518.
[ 5 ] 袁蓉,陈敏,信琪琪,等.川芎嗪对动脉粥样硬化小鼠血管新生的影响[J].中华中医药杂志,2019,34(5):2250- 2254.
[ 6 ] 朱海泉,刘子敏,孟祥圣,等.川芎嗪抑制NF-κB p65磷酸化对LPS诱导的骨关节炎软骨细胞凋亡和炎症反应的调节作用[J].中国免疫学杂志,2019,35(2):181-185.
[ 7 ] 尹淑杰,柳朝阳,任永波,等.川芎嗪抗β淀粉样蛋白25~35诱导的SH-SY5Y细胞凋亡作用的机制[J].中国老年学杂志,2016,36(17):4151-4153.
[ 8 ] 易细香,徐敏,傅培.眼部不同方式注射川芎嗪抑制小鼠视网膜新生血管形成的比较研究[J].湖南中医药大学学报,2013,33(5):45-48.
[ 9 ] LIANG XL,ZHOU HJ,DING YG,et al. TMP prevents retinal neovascularization and imparts neuroprotection in an oxygen-induced retinopathy model[J]. Invest Ophthalmol Vis Sci,2012,53(4):2157-2169.
[10] AL-KINANI AA,ZIDAN G,ELSAID N,et al. Ophthalmic gels:past,present and future[J]. Adv Drug Deliv Rev,2018,126:113-126.
[11] JANAGAM DR,WU LF,LOWE TL,Nanoparticles for drug delivery to the anterior segment of the eye[J]. Adv Drug Deliv Rev,2017,122:31-64.
[12] MENG T,KULKARNI V,SIMMERS R,et al. Therapeutic implications of nanomedicine for ocular drug deli- very[J]. Drug Discovery Today,2019,24(8):1524-1538.
[13] LAI SS,WEI YY,WU QW,et al. Liposomes for effective drug delivery to the ocular posterior chamber[J]. J Nanobiotechnology,2019,17(1):64.
[14] MURA P,MENNINI N,NATIVI C,et al. In situ mucoadhesive-thermosensitive liposomal gel as a novel vehicle for nasal extended delivery of opiorphin[J]. Eur J Pharm Biopharm,2018,122:54-61.
[15] 叢志新,李爽,黄晶,等.氢溴酸西酞普兰鼻用温敏凝胶的处方优化及体外性质评价[J].中国药学杂志,2020,55(5):375-382.
[16] 姜爱玲,吴敏.硫酸铵梯度法提高双重载药纳米粒中小檗碱的载药量与包封率[J].西北药学杂志,2020,35(4):554-560.
[17] 万方劼,陈斌龙,杨林洁,等.主动包载维替泊芬阳离子脂质体用于新生血管和肿瘤靶向光动力治疗[J].药学学报,2020,55(7):1680-1690.
[18] 戴助,祝红达.非侵入性眼后段给药的纳米药物递送策略研究进展[J].中国医药导报,2019,16(16):46-49.
[19] 黄平情,高利利,于颖超,等.左卡尼汀温敏原位凝胶的制备及质量评价[J].药学学报,2019,54(6):1115-1122.
[20] ARBELAEZ-CAMARGO D,SU??-NEGRE JM,ROIG- CARRERAS M,et al. Preformulation and characterization of a lidocaine hydrochloride and dexamethasone sodium phosphate thermo-reversible and bioadhesive long- acting gel for intraperitoneal administration[J]. Int J Pharm,2016,498(1/2):142-152.
[21] WEI YD,LI CH,ZHU Q,et al. Comparison of thermosensitive in situ gels and drug-resin complex for ocular drug delivery:in vitro drug release and in vivo tissue distribution[J]. Int J Pharm,2020,578:119184.
[22] 李翔,罗莹,廖正根,等.壳聚糖及其衍生物包覆对载姜黄素脂质体角膜透过作用的影响[J].中国医药工业杂志,2015,46(3):265-269.
[23] CLAYSON K,SANDWISCH T,MA Y,et al. Corneal hydration control during ex vivo experimentation using poloxamers[J]. Curr Eye Res,2020,45(2):111-117.
[24] BENGANI LC,KOBASHI H,ROSS AE,et al. Steroi- deluting contact lenses for corneal and intraocular inflammation[J]. Acta Biomater,2020,116:149-161.
[25] 王庆利,彭健. Draize 眼刺激性试验的评价[J].中药新药与临床药理,2005,16(4):301-304.
[26] SANTIMETANEEDOL A,WANG Z,ARTEAGA DN, et al. Small molecule delivery across a perforated artificial membrane by thermoreversible hydrogel poloxamer 407[J]. Colloids Surf B Biointerfaces,2019. DOI:org/10. 1016/j.colsurfb.2019.06.030.
[27] 侯雄军,周莉华,汤韶明,等.氟尿嘧啶泊洛沙姆407聚合物胶束在大鼠体内的药代动力学研究[J].中国临床药理学杂志,2019,35(3):276-279.
[28] 马盼盼,冯青云,马政瑶,等.星点设计-效应面法优化舒肺原位凝膠的制备工艺及体外评价[J].中草药,2018,49(12):2826-2832.
[29] 薛棱芬,殷雅卓,谢兴亮,等.苦参碱直肠原位温敏凝胶的制备及性能评价[J].中草药,2018,49(6):1311-1316.
[30] ZHANG ZJ,OSMALEK T,MICHNIAK-KOHN B. Deformable liposomal hydrogel for dermal and transdermal delivery of meloxicam[J]. Int J Nanomedicine,2020,15:9319-9335.
[31] YOON HY,CHANG IH,GOO YT,et al. Intravesical delivery of rapamycin via folate-modified liposomes dispersed in thermo-reversible hydrogel[J]. Int J Nanomedicine,2019,14:6249-6268.
(收稿日期:2020-08-11 修回日期:2020-12-25)
(编辑:胡晓霖)
