基于AMPK/SIRT1/PGC-1α信号通路研究香青兰总黄酮对大鼠心肌缺血再灌注损伤的保护机制
2021-03-02赵云丽袁勇马晓莉黄川生文志萍郭新红王新春
赵云丽 袁勇 马晓莉 黄川生 文志萍 郭新红 王新春

摘 要 目的:研究香青兰总黄酮(TFDM)对腺苷酸活化蛋白激酶(AMPK)/沉默信息调节因子1(SIRT1)/过氧化物酶体增殖物激活受体γ辅激活因子1α(PGC-1α)信号通路的影响,探究其保护大鼠心肌缺血再灌注损伤(MIRI)的作用机制。方法:将50只健康雄性SD大鼠随机分为假手术组、模型组、TFDM组[60 mg/(kg·d),以提取物计]、Compound C+TFDM组[灌胃60 mg/(kg·d)TFDM+再灌注前15 min尾静脉注射250 μg/kg Compound C (AMPK抑制剂)]、EX-527+TFDM组[灌胃60 mg/(kg·d)TFDM+再灌注前20 min腹腔注射5 mg/kg EX-527(SIRT1抑制剂)],每组10只。每天灌胃给药1次,连续7 d。末次灌胃给药后,假手术组大鼠行假手术,其余4组大鼠均采用结扎冠状动脉左前降支缺血30 min、再灌注2 h构建MIRI模型。再灌注结束后,采用苏木精-伊红染色法观察大鼠心肌组织病理学变化;采用反相高效液相色谱法测定其心肌组织中腺苷三磷酸(ATP)、腺苷二磷酸(ADP)、腺苷一磷酸(AMP)及烟酰胺腺嘌呤二核苷酸(NAD+)的含量;采用实时荧光定量-聚合酶链式反应法检测大鼠心肌组织中AMPK、SIRT1和PGC-1α mRNA表达水平;采用Western blotting法检测大鼠心肌组织中AMPK蛋白的磷酸化水平和SIRT1、PGC-1α蛋白表达水平。结果:与假手术组比較,模型组大鼠心肌纤维排列紊乱、横向条纹消失,细胞肿胀破裂、坏死,细胞核变形移位;心肌组织中ATP、NAD+含量和AMPK、SIRT1、PGC-1α mRNA表达水平以及SIRT1、PGC-1α蛋白表达水平均显著降低(P<0.05或P<0.01),ADP、AMP含量及AMPK蛋白的磷酸化水平均显著升高(P<0.01)。与模型组比较,TFDM组大鼠心肌病理学形态明显改善;心肌组织中ATP、NAD+含量和AMPK、SIRT1、PGC-1α mRNA表达水平以及AMPK蛋白的磷酸化水平和SIRT1、PGC-1α蛋白表达水平均显著升高(P<0.05或P<0.01),ADP、AMP含量均显著降低(P<0.01)。与TFDM组比较,Compound C+TFDM组和EX-527+TFDM组大鼠上述指标的改善作用均被逆转(P<0.05或P<0.01)。结论:TFDM可能是通过激活AMPK/SIRT1/PGC-1α信号通路,调节能量代谢,从而发挥其对心肌的保护作用。
关键词 香青兰总黄酮;能量代谢;腺苷酸活化蛋白激酶;沉默信息调节因子1;过氧化物酶体增殖物激活受体γ辅激活因子1α;机制
中图分类号 R285 文献标志码 A 文章编号 1001-0408(2021)03-0278-06
DOI 10.6039/j.issn.1001-0408.2021.03.05
ABSTRACT OBJECTIVE: To study the effects of Dracocephalum moldavica total flavonoids (TFDM) on AMPK/SIRT1/PGC-1α signaling pathway, and to explore the mechanism of its protective effect on myocardial ischemia reperfusion injury (MIRI) rats. METHODS: Totally 50 healthy male SD rats were randomly divided into sham operation group, model group, TFDM group [60 mg/(kg·d), by extract], Compound C+TFDM group [ig administration of 60 mg/(kg·d) TFDM+intravenous injection of 250 μg/kg Compound C (AMPK inhibitor) via tail vein 15 min before reperfusion], EX-527+TFDM group [ig administration of 60 mg/(kg·d) TFDM+ip injection of 5 mg/kg EX-527 (SIRT1 inhibitor) 20 min before reperfusion], with 10 rats in each group. They were given relevant medicine intragastrically, once a day, for consecutive 7 days. After last ig administration, sham operation group underwent sham operation, other 4 groups were established MIRI model by ligating left anterior descending coronary artery, ischemia for 30 min and reperfusion for 2 h. After reperfusion, the myocardial histopathological changes were observed by HE staining; RP-HPLC method was used to determine the contents of ATP, ADP, AMP and NAD+ in cardiac tissue. mRNA expressions of AMPK, SIRT1 and PGC-1α were detected by quantitative real-time PCR assay. Western blotting assay was used to detect the phosphorylation level of AMPK protein and the expressions of SIRT1 and PGC-1α protein in myocardium. RESULTS: Compared with sham operation group, model group showed myocardial fibers arranged disorder and horizontal stripes disappearance, cell swelling burst and necrosis, and nuclei deformation displacement; the contents of ATP and NAD+, mRNA expression of AMPK, SIRT1 and PGC-1α, protein expression of SIRT1 and PGC-1α in cardiac tissue were decreased significantly (P<0.05 or P<0.01); the contents of ADP and AMP, the phosphorylation level of AMPK protein were increased significantly (P<0.01). Compared with model group, myocardial pathological morphology were improved significantly in TFDM group; the contents of ATP and NAD+ in cardiac tissue, mRNA expression of AMPK, SIRT1 and PGC-1α, the phosphorylation level of AMPK protein, the protein expression of SIRT1 and PGC-1α were increased significantly (P<0.05 or P<0.01), while the contents of ADP and AMP were decreased significantly (P<0.01). Compared with TFDM group, improvement effects of Compound C+TFDM group and EX-527+TFDM group on above indexes were reversed (P<0.05 or P<0.01). CONCLUSIONS: TFDM may play a protective role on myocardium by activating AMPK/SIRT1/PGC-1α signaling pathway and regulating energy metabolism.
KEYWORDS Dracocephalum moldavica total flavonoids; Energy metabolism; AMPK; SIRT1; PGC-1α; Mechanism
心肌缺血再灌注损伤(Myocardial ischemia-reperfusion injury,MIRI)是心脑血管疾病患者的主要死亡原因之一,会严重影响缺血性心脏疾病患者的预后;而且,MIRI的发病机制复杂,包括能量代谢障碍、自由基损伤、钙超载和细胞凋亡等[1],而能量代谢又被认为是心肌细胞活动的物质基础[2]。腺苷酸活化蛋白激酶(AMPK)是调节能量代谢的核心分子,参与了多种代谢过程的调节[3]。沉默信息调节因子1(SIRT1)是一种具有组蛋白脱乙酰化酶活性的转录调节因子,可感受机体的能量状态,调节其他转录因子的表达,也参与了调节细胞代谢稳态和氧化应激损伤的过程[4]。过氧化物酶体增殖物激活受体γ辅激活因子1α(PGC-1α)是AMPK和SIRT1的下游靶蛋白,是线粒体生物合成、氧化代谢及细胞能量稳态的关键调节分子[5-6]。
香青兰总黄酮(Dracocephalum moldavica L. total flavonoids,简称“TFDM”)是从新疆特色资源香青兰植物中提取得到的一类天然黄酮类活性成分,具有抗氧化及防治心脑血管疾病等作用[7-9]。本课题组前期研究发现,TFDM对MIRI模型大鼠有明显的保护作用[7],可提高其心肌组织中腺苷三磷酸(ATP)的含量[8],增强其线粒体活力以及改善其能量代谢紊乱、线粒体结构和功能[9]。而AMPK/SIRT1/PGC-1α作为一条能量感应网络,可以通过感应机体能量及氧化应激状态从而在能量代谢中发挥重要作用[10-11]。因此,本研究通过考察TFDM对MIRI模型大鼠AMPK/SIRT1/PGC-1α信号通路的影响,探讨TFDM治疗MIRI的作用机制,为TFDM防治MIRI提供潜在的治疗靶点及理论依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有:HX-300型动物呼吸机(成都泰盟科技有限公司),Pico-17型台式低温离心机(美国Thermo Fisher Scientific公司),e2695型高效液相色谱(HPLC)仪、Alliance 2695型二极管阵列检测器(美国Waters公司),XL-200型低速离心仪器(江苏海门其林贝尔仪器厂),EM-UC6型超薄型切片仪(美国Leica公司),VE-180型垂直电泳及电转仪(上海天能科技有限公司),ChemiDoc XRS+型凝胶成像系统(美国Bio Rad公司),Rotor-Gene Q型实时荧光定量-聚合酶链式反应(PCR)仪(德国Qiangen公司)。
1.2 主要药品与试剂
本研究所用主要药品与试剂有:TFDM提取物(批号20141008,纯度57%,其中田蓟苷的含量为82.53 mg/g)由新疆药物研究所提供;Compound C(AMPK抑制剂,批号S7840,纯度≥99%)、EX-527(SIRT1抑制剂,批号S1541,纯度≥99%)均购自美国Selleck公司;乌拉坦(批号20151106,纯度95%)購自武汉远城科技发展有限公司;ATP二钠盐对照品(批号SLBT6850,纯度≥99%)、腺苷二磷酸(ADP)二钠盐对照品(批号SLBM5638V,纯度≥95%)、腺苷一磷酸(AMP)钠盐对照品(批号BCBT3249,纯度≥99%)、烟酰胺腺嘌呤二核苷酸(NAD+)对照品(批号SLBT3662,纯度≥96.5%)均购自美国Sigma公司;兔源AMPK多克隆抗体(批号ab131512)、兔源磷酸化AMPK(p-AMPK)多克隆抗体(批号ab23875)、鼠源SIRT1单克隆抗体(批号ab110304)、兔源PGC-1α多克隆抗体(批号ab191838)均购自美国Abcam公司;兔源甘油醛-3-磷酸脱氢酶(GAPDH)多克隆抗体(批号10494-1-AP)购自武汉三鹰生物技术有限公司;辣根酶素标记山羊抗小鼠免疫球蛋白G(IgG)二抗(批号141987)、辣根酶素标记山羊抗兔IgG二抗(批号140193)购自北京中杉金桥生物技术有限公司;二喹啉甲酸(BCA)蛋白定量测试盒(批号A045-4)购自南京建成生物工程研究所;聚偏二氟乙烯(PVDF)膜(批号R8PA2084)、ECL发光液(批号1923101)均购自美国Millopore公司;cDNA逆转录试剂盒(批号00422714)购自美国Thermo Fisher Scientific公司;组织总RNA抽提试剂盒(批号DP431)、QuantiNovaTM SYBR? Green PCR Kit荧光定量PCR试剂盒(批号154045739)均购自德国Qiangen公司;PCR试验中的引物序列均由上海生工生物公司设计及合成;其余试剂均为分析纯或实验室常用规格,水为蒸馏水。
1.3 动物
SPF级健康SD大鼠50只,雄性,体质量230~280 g,由新疆维吾尔自治区实验动物研究中心提供[动物使用合格证号为SYXK(新)2016-0001]。所有大鼠均自由摄食、饮水,并分笼饲养于温度为22~25 ℃、相对湿度为40%~60%的环境中,适应性饲养1周后用于实验。本研究实验过程满足动物实验“3R”原则。
2 方法
2.1 分组与给药
将50只SD大鼠随机分为假手术组、模型组、TFDM组、Compound C+TFDM组和EX-527+TFDM组,每组10只。假手术组和模型组大鼠灌胃等体积生理盐水;TFDM组大鼠灌胃60 mg/(kg·d)TFDM(以提取物计,下同)[8,12];Compound C+TFDM组大鼠灌胃TFDM 60 mg/(kg·d),并于再灌注前15 min尾静脉注射250 μg/kg Compound C[13];EX-527+TFDM组大鼠灌胃TFDM 60 mg/(kg·d),并于再灌注前20 min腹腔注射5 mg/kg EX-527[14]。药物均使用生理盐水溶解,灌胃体积均为2.5 mL/kg,每天灌胃给药1次,连续7 d。给药结束后,除假手术组外的其余4组大鼠均建立MIRI模型。
2.2 大鼠MIRI模型的建立及取材
腹腔注射25%乌拉坦(5 mL/kg)将大鼠麻醉后,将其仰位固定,进行气管插管;沿胸骨左缘3~4肋间开胸后,立刻连接呼吸机(呼吸频率60次/min,潮气量60 mL/kg,呼吸比3 ∶ 2),暴露心脏,迅速结扎左冠状动脉前降支,结扎完成后立刻让心脏回位;缺血30 min后,剪断结扎线,再灌注120 min[9]。再灌注结束后,迅速剪取心脏,置于冰生理盐水中,轻柔洗去心腔内血液,将整颗心脏置于-80 ℃冰箱中冻存,待测。假手术组大鼠进行同样实验操作,但不结扎左冠状动脉前降支。
2.3 大鼠心肌组织病理学形态观察
采用苏木精-伊红(HE)染色法观察大鼠心肌组织病理学形态变化。取大鼠心脏心尖及左心室壁进行常规石蜡包埋、切片(厚度为5 μm)。将组织切片经二甲苯及梯度乙醇脱蜡后,以苏木精染色3 min,再以1%盐酸乙醇分化30 s,然后以0.5%伊红染色3 min,接着依次经梯度乙醇和二甲苯进行脱水透明,于通风橱中晾干后,用中性树胶封片,显微镜下拍照并观察大鼠心肌组织的病理学形态变化。
2.4 大鼠心肌组织中ATP、ADP、AMP和NAD+含量测定
按照前期建立的反相HPLC法测定大鼠心肌组织中ATP、ADP、AMP、NAD+的含量[15]。取大鼠心肌组织适量,迅速称质量,冰浴下按3 mL/kg的量分次加入预冷的0.5 mol/L HClO4溶液,低温下制备组织匀浆,再于冰上静置5 min,使蛋白充分沉淀。然后将组织匀浆液在4 ℃下以12 000 r/min离心5 min,取上清,再用2.5 mol/L K2CO3溶液调节组织上清液的pH至中性,再次在4 ℃下以12 000 r/min离心5 min,以0.22 ?m微孔滤膜过滤,取滤液,然后按文献[15]色谱条件进样分析。
2.5 大鼠心肌组织中AMPK、SIRT1和PGC-1α mRNA表达水平测定
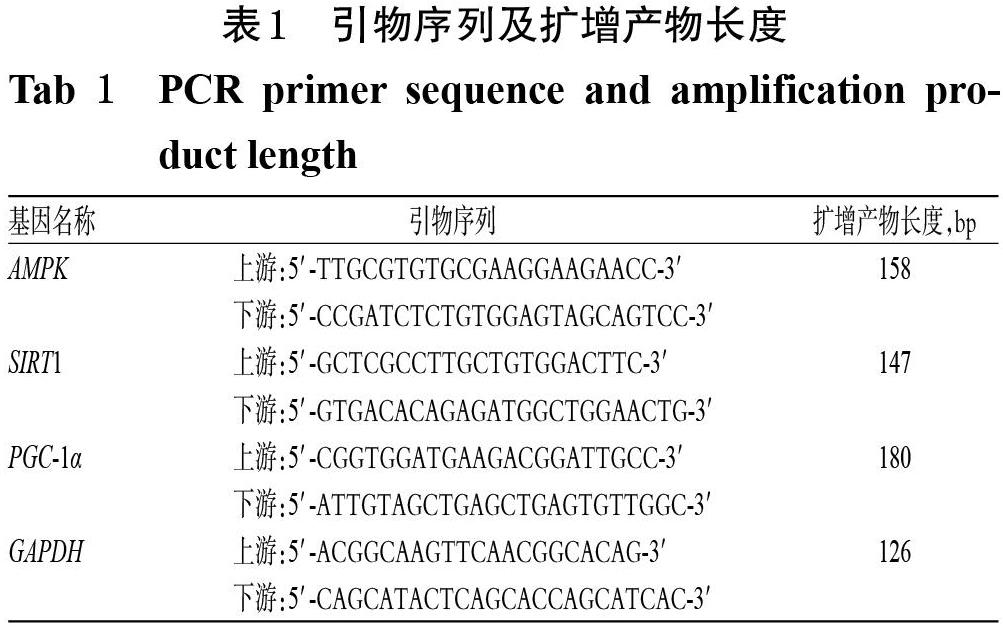
采用实时荧光定量-PCR法测定大鼠心肌组织中AMPK、SIRT1和PGC-1α mRNA表达水平。取大鼠心肌组织适量,使用组织总RNA抽提试剂盒提取其总RNA,验证其纯度后,按cDNA逆转录试剂盒方法合成cDNA,并以cDNA为模板进行PCR扩增。反应体系(共20 μL)包括2×QuantiNova SYBR Green PCR Master mix 10 μL,上、下游引物各1 μL,cDNA模板 2 μL,ddH2O 6 μL。PCR反应条件为95 ℃预变性 1 min;95 ℃ 变性10 s,60 ℃退火/延伸15 s,共40个循环。以GAPDH为内参,采用2-ΔΔCt法计算各目的基因的表达水平。引物序列及扩增产物长度见表1。
2.6 大鼠心肌组织中AMPK蛋白磷酸化水平及SITR1和PGC-1α 蛋白表达水平检测
采用Western blotting法检测大鼠心肌组织中AMPK蛋白的磷酸化水平及SITR1、PGC-1α蛋白表達水平。取大鼠心肌组织80 mg,用含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液提取其总蛋白,采用BCA法测定蛋白浓度。蛋白经变性处理(99 ℃,10 min)后,取50 μg在80 V电压下经10%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离90 min,湿法转膜(200 mA,120 min)至PVDF膜上;将膜用5%脱脂奶粉封闭1 h,然后分别加入AMPK一抗(稀释比例为1 ∶ 500)、p-AMPK一抗(稀释比例为1:1 000)、SIRT1一抗(稀释比例为1 ∶ 1 000)、PGC-1α一抗(稀释比例为1 ∶ 1 000)、GAPDH一抗(稀释比例为1 ∶ 5 000),4 °C孵育过夜;以TBST缓冲液洗膜10 min×3次,然后加入相应二抗(稀释比例均为1 ∶ 20 000),室温孵育1 h;以TBST缓冲液洗膜10 min×3次,采用ECL化学发光液显影后,经凝胶成像系统成像。采用Image J 1.6.0软件对蛋白条带进行灰度值分析,以p-AMPK与AMPK条带灰度值的比值表示AMPK蛋白的磷酸化水平,以其余目标蛋白与内参GAPDH条带的灰度值比值表示目标蛋白的相对表达水平。
2.7 统计学方法
采用SPSS 22.0软件进行统计分析。数据结果以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验。P<0.05表示差异具有统计学意义。
3 结果
3.1 TFDM对MIRI模型大鼠心肌组织病理学形态的影响
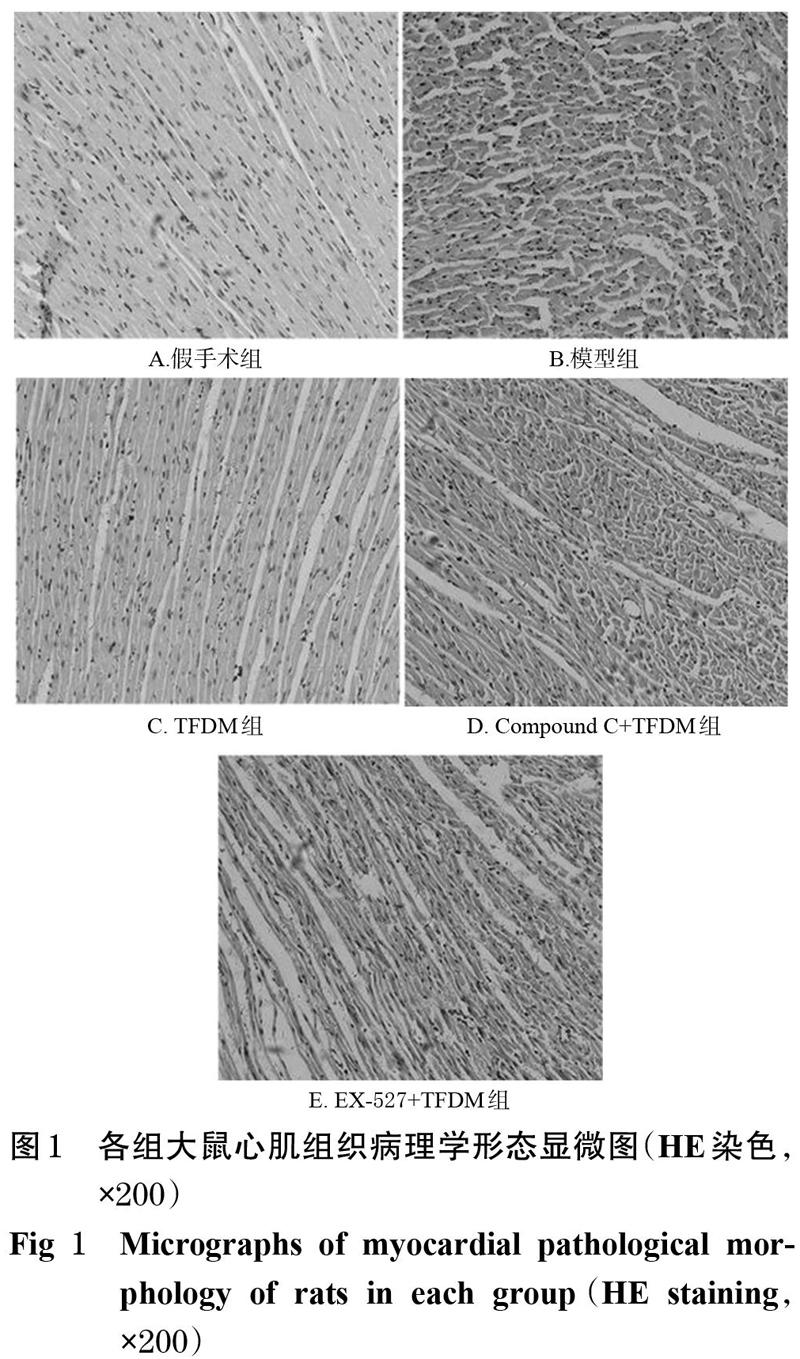
HE染色结果显示,假手术组大鼠心肌膜完整,心肌纤维排列整齐、界限清晰、呈束状分布,细胞核形态规则、分布均匀;模型组大鼠心肌纤维排列紊乱、横向条纹消失,细胞肿胀破裂、坏死,细胞核变形移位;TFDM组大鼠心肌纤维排列相对整齐、界限较清晰、呈束状分布;而Compound C+TFDM组和EX-527+TFDM组大鼠心肌组织心肌膜不完整,心肌纤维排列不紧密。各组大鼠心肌组织病理学形态显微图见图1。
3.2 TFDM对MIRI模型大鼠心肌组织中ATP、ADP、AMP和NAD+含量的影响
与假手术组比较,模型组大鼠心肌组织中ATP、NAD+含量显著降低(P<0.01),而ADP、AMP含量显著升高(P<0.01);与模型组比较,TFDM组大鼠心肌组织中ATP、NAD+含量显著升高(P<0.01),ADP、AMP含量显著降低(P<0.01);与TFDM组比较,Compound C+TFDM组和EX-527+TFDM组大鼠心肌组织中的ATP、NAD+含量均显著降低(P<0.01),ADP、AMP含量均显著升高(P<0.05或P<0.01)。各组大鼠心肌组织中ATP、ADP、AMP和NAD+含量测定结果见表2。
3.3 TFDM对MIRI模型大鼠心肌组织中AMPK、SIRT1和PGC-1α mRNA表达的影响
与假手术组比较,模型组大鼠心肌组织中AMPK、SIRT1和PGC-1α mRNA的表达水平均显著降低(P<0.05或P<0.01);与模型组比较,TFDM组大鼠心肌组织中AMPK、SIRT1和PGC-1α mRNA的表达水平均显著升高(P<0.05或P<0.01);与TFDM组比较,Compound C+TFDM组和EX-527+TFDM组大鼠心肌组织中AMPK、SIRT1和PGC-1 α mRNA的表达水平均显著降低(P<0.01)。各组大鼠心肌组织中AMPK、SIRT1、PGC-1α mRNA的表达水平测定结果见表3。
3.4 TFDM对MIRI模型大鼠心肌组织中AMPK蛋白磷酸化及SIRT1、PGC-1α 蛋白表达的影响
与假手术组比较,模型组大鼠心肌组织中AMPK蛋白的磷酸化水平显著升高(P<0.01),SIRT1、PGC-1α蛋白表达水平均显著降低(P<0.05或P<0.01);与模型组比较,TFDM组大鼠心肌组织中AMPK蛋白的磷酸化水平和SIRT1、PGC-1α蛋白表达水平均显著升高(P<0.01);与TFDM组比较,Compound C+TFDM组和EX-527+TFDM组大鼠心肌组织中AMPK蛋白的磷酸化水平和SIRT1、PGC-1α 蛋白表达水平均显著降低(P<0.05或P<0.01)。各组大鼠心肌组织中p-AMPK、AMPK、SIRT1、PGC-1α蛋白表达的电泳图见图2,AMPK蛋白磷酸化水平及SIRT1、PGC-1α蛋白表达水平测定结果见表4。
4 讨论
AMPK属于丝氨酸/苏氨酸蛋白激酶,是一种调节生物能量代谢的核心分子,可参与多种代谢的调节过程[3,16]。相关研究显示,心肌缺血再灌注后大鼠心肌组织明显受损,细胞处于缺血缺氧的应激状态,氧供缺乏,导致体内ATP生成不足、AMP含量增加,从而使AMPK被磷酸化激活[17]。活化的AMPK(即p-AMPK)可作用于多种下游底物,抑制ATP的消耗,并启动生成ATP的途径以维持机體能量代谢平衡,增加细胞内NAD+的含量,继而使依赖NAD+的SIRT1被激活而发挥其相应生物学效应[18]。AMPK和SIRT1分别可以通过磷酸化和去乙酰化作用调控PGC-1α的表达;而PGC-1α可调节抗氧化酶的活性,减少MDA+及活性氧(ROS)的含量,发挥抗氧化应激作用,从而保护心肌缺血性损伤[19-21]。
本研究结果显示,模型组大鼠心肌组织明显受损,病理形态学方面主要表现为心肌纤维排列紊乱、横向条纹消失,细胞肿胀破裂、坏死,细胞核变形移位,表明MIRI模型造模成功;而TFDM组大鼠心肌组织的上述症状明显改善,且TFDM能明显提高大鼠心肌组织中ATP、NAD+的含量,降低ADP、AMP的含量,表明TFDM可通过改善缺血心肌细胞ATP的能量代谢,从而保护受损心肌。在心肌缺血缺氧时,AMPK作为“细胞能量感应器”,可被迅速磷酸化从而发挥其调节作用[18]。本研究发现,模型组大鼠心肌组织中AMPK mRNA的表达水平显著降低、AMPK蛋白的磷酸化水平显著升高,这可能是机体代偿性地产生了p-AMPK,以维持能量稳定、减少损伤;此外,SIRT1、PGC-1α mRNA及其蛋白的表达水平均显著下降,表明SIRT1、PGC-1α参与了MIRI模型大鼠心肌损伤的过程。而与模型组比较,TFDM组大鼠心肌组织中AMPK mRNA表达水平、AMPK蛋白的磷酸化水平进一步升高,同时SIRT1、PGC-1α mRNA及其蛋白表达水平也均显著升高,这说明TFDM可激活AMPK通路,并上调SIRT1、PGC-1α mRNA及其蛋白的表达。
另外,本研究进一步发现,给予抑制剂Compound C和EX-527后,可显著逆转TFDM对上述指标的调节作用。Compound C是AMPK的抑制剂,有学者在前期动物实验和细胞试验中已验证过其安全性和有效性,有一定研究基础[15];EX-527是SIRT1的抑制剂,其不影响细胞生长、细胞活力和p53调控的基因的表达,对SIRT1具有较高的选择性[20]。本研究采用这2个通路抑制剂分别进行处理,首先能够更加明确、直观地反映TFDM对AMPK/SIRT1/PGC-1α信号转导通路的影响;其次是预测AMPK和SIRT1在对PGC-1α活性的调节中谁占据主导作用。本研究结果提示AMPK/SIRT1/PGC-1α信号通路参与了TFDM给药后对MIRI模型大鼠的保护作用,但AMPK和SIRT1在此作用机制中谁占主导位置尚未得到明确结论。
综上所述,TFDM在MIRI过程中可以激活AMPK/SIRT1/PGC-1α信号通路,调节能量代谢,从而发挥其对心肌组织的保护作用。
参考文献
[ 1 ] LI L,PAN CS,YAN L,et al. Ginsenoside Rg1 ameliorates rat myocardial ischemia-reperfusion injury by modulating energy metabolism pathways[J]. Front Physiol,2018. DOI:10.3389/fphys.2018.00078.
[ 2 ] WANG S,YE L,WANG L. Protective mechanism of Shen- mai on myocardial ischemia-reperfusion through the energy metabolism pathway[J]. Am J Transl Res,2019,11(7):4046-4062.
[ 3 ] QI D,YONG LH. AMPK:energy sensor and survival me- chanism in the ischemic heart[J]. Trends Endocrinol Metab,2015,26(8):422-429.
[ 4 ] MA S,FENG J,ZHANG R,et al. SIRT1 activation by resveratrol alleviates cardiac dysfunction via mitochondrial regulation in diabetic cardiomyopathy mice[J]. Oxid Med Cell Longev,2017. DOI:10.1155/2017/4602715.
[ 5 ] LIMING Y,BING G,WEIXUN D,et al. Melatonin ameliorates myocardial ischemia/reperfusion injury in type 1 diabetic rats by preserving mitochondrial function:role of AMPK-PGC-1α-SIRT3 signaling[J]. Sci Rep,2017. DOI:10.1038/srep41337.
[ 6 ] NAAZ S,MISHRA S,PAL PK,et al. Activation of SIRT1/PGC1α/SIRT3 pathway by melatonin provides protection against mitochondrial dysfunction in isoproterenol induced myocardial injury[J]. Heliyon,2020. DOI:10.1016/j.heliyon.2020.e05159.
[ 7 ] 樊鑫梅,曹文疆,邢建国,等.香青兰总黄酮对大鼠心肌缺血再灌注损伤保护作用的研究[J].中成药,2013,35(8):1625-1629.
[ 8 ] 姚佳茗,曹文疆,袁勇,等.香青兰总黄酮对心肌缺血-再灌注损伤线粒体保护作用的研究[J].石河子大学学报(自然科学版),2015,33(5):599-603.
[ 9 ] YUAN Y,CAO W,HONG Y,et al. Tilianin pretreatment prevents myocardial ischemia-reperfusion injury via pre- servation of mitochondrial function in rat heart[J]. Phytomedicine,2017. DOI:10.1016/j.phymed.2017.08.007.
[10] CHOI YK,KIM JH,LEE DK,et al. Carbon monoxide potentiation of L-type Ca(2+)channel activity increases HIF-1α-independent VEGF expression via an AMPKα/SIRT1-mediated PGC-1α/ERRα axis[J]. Antioxid Redox Signal,2017,27(1):21-36.
[11] YUAN Y,SHI M,LI L,et al. Mesenchymal stem cell-conditioned media ameliorate diabetic endothelial dysfunction by improving mitochondrial bioenergetics via the Sirt1/AMPK/PGC-1alpha pathway[J]. Clin Sci(Lond),2016,130(23):2181-2198.
[12] 袁勇,邢建国,王立萍,等.香青兰总黄酮在大鼠体内的药代动力学研究[J].石河子大学学报(自然科学版),2014,32(1):69-72.
[13] 徐青荣.硫化氢缓释供体ADT后处理对大鼠在体心肌缺血再灌注损伤的保护:AMPK介导的自噬流在其中的作用[D].苏州:苏州大学,2015.
[14] 付雯雯.基于SIRT1信号通路的人参皂苷Rb2和Rg2预处理对心肌损伤的保护作用及机制研究[D].长春:吉林大学,2017.
[15] TIAN L,CAO W,YUE R,et al. Pretreatment with tilianin improves mitochondrial energy metabolism and oxidative stress in rats with myocardial ischemia/reperfusion injury via AMPK/SIRT1/PGC-1α signaling pathway[J]. J Pharmacol Sci,2019. DOI:10.1016/j.jphs.2019.02.008.
[16] VELAGAPUDI R,EL-BAKOUSH A,LEPIARZ I,et al. AMPK and SIRT1 activation contribute to inhibition of neuroinflammation by thymoquinone in BV2 microglia
[J]. Mol Cell Biochem,2017,435(1/2):149-162.
[17] SALT IP,HARDIE DG. AMP-activated protein kinase:an ubiquitous signaling pathway with key roles in the cardiovascular system[J]. Circ Res,2017,120(11):1825-1841.
[18] CATTELAN A,CEOLOTTO G,BOVA S,et al. NAD(+)-dependent SIRT1 deactivation has a key role on ischemia-reperfusion-induced apoptosis[J]. Vascul Pharmacol,2015. DOI:10.1016/j.vph.2015.02.004.
[19] YU L,LIANG H,DONG X,et al. Reduced silent information regulator 1 signaling exacerbates myocardial ische- mia-reperfusion injury in type 2 diabetic rats and the protective effect of melatonin[J]. J Pineal Res,2015,59(3):376-390.
[20] SOLOMON JM,PASUPULETI R,XU L,et al. Inhibition of SIRT1 catalytic activity increases p53 acetylation but does not alter cell survival following DNA damage[J]. Mol Cell Biol,2006,26(1):28-38.
[21] SONG MY,JUNG HW,KANG SY,et al. Atractylenolide Ⅲ enhances energy metabolism by increasing the SIRT-1 and PGC1α expression with AMPK phosphorylation in C2C12 mouse skeletal muscle cells[J]. Biol Pharm Bull,2017,40(3):339-344.
(收稿日期:2020-11-03 修回日期:2020-12-22)
(編辑:林 静)
