基于药品缺陷的药品上市许可持有人风险控制和转移机制研究
2021-03-02赵静
赵静


摘 要 目的:基于药品缺陷探索建立药品上市许可持有人(MAH)风险控制和转移机制,促进MAH制度在我国顺利实施。方法:首先分析药品全生命周期中的药品缺陷类型;继而分析在MAH制度下,在产业链开放式委托的环境下不同类型药品缺陷的来源和“过错方”;在此基础上,结合国外经验和我国实际情况,提出建立持有人风险控制和转移机制的建议。结果与结论:药品缺陷分为设计缺陷、生产经营储运质量缺陷和使用缺陷,其中设计缺陷和生产经营储运质量缺陷是最主要的缺陷。设计缺陷主要有人为因素造成的设计缺陷和当前科学技术水平不能发现的设计缺陷,“过错方”依照不同情形既可能是研发机构也可能是持有人;生产经营储运质量缺陷的过错方是药品生产、经营及储运企业。对于设计缺陷,建议通过保险+救济相结合的方式建立我国药品不良反应补偿机制;对于生产经营储运质量缺陷,建议以药品质量责任保险为主、合同约定为补充的方式,让“过错方”担负起应有责任。
关键词 药品上市许可持有人;风险控制;风险转移;药品缺陷
中图分类号 R951 文献标志码 A 文章编号 1001-0408(2021)03-0261-07
DOI 10.6039/j.issn.1001-0408.2021.03.02
ABSTRACT OBJECTIVE: To explore the mechanism of risk control and transfer of drug marketing authorization holders (MAH) based on drug defects, and to promote the smooth implementation of MAH system in China. METHODS: Firstly, the types of drug defects in the whole drug life cycle were analyzed, and then the sources and “fault party” of different types of drug defects in the open commissioning environment of the industry chain under the MAH system were also analyzed. Based on it, the mechanism of risk control and transfer of MAH was established combined with foreign experience and Chinas actual situation. RESULTS & CONCLUSIONS: Drug defects were divided into design defects, manufacturing & operation & storage & transportation quality defects and use defects, among which design defects and manufacturing & operation & storage & transportation quality defects were the two most important defects. Design defects mainly included those caused by human factors and those could not be found by current level of science and technology,the “fault party” according to different circumstances may be both the research and development institutions and may be the MAH. The “fault party” of production & operation & storage & transportation quality defects was the drug production & operation & storage & transportation enterprises. For design defects, it was recommended to establish Chinas adverse drug reaction compensation mechanism through a combination of insurance and relief. For production & operation & storage & transportation quality defects, it was recommended that the drug quality liability insurance as the main, contractual agreement as the supplement, so that the “fault party” should assume due responsibility.
KEYWORDS Marketing authorization holders; Risk control; Risk transfer; Drug defects
藥品上市许可持有人(Marketing authorization holders,MAH)制度是涉及药品产权根本变革的制度,其将药品的上市许可与生产许可“解绑”,允许科研单位等不具备生产条件和未取得药品生产许可证的机构,经申请药品上市许可成为MAH[1]。该制度的实施一方面可以激发科研机构创新的活力,另一方面委托生产的放开也有利于减少行业低水平重复建设、促进资源整合[2]。然而,MAH制度在允许持有人获得药品所有权益的同时,也要求持有人对药品质量全面负责[3]。众所周知,药品是高风险产品,从临床前研究、临床研究到生产和上市销售,以及储运和使用的整个生命周期都存在一定程度的安全风险[4]。并且,在MAH制度的全产业链开放式委托的环境下,由于产业链上参与主体众多而使药品安全风险凸显,“负全责”对持有人提出了巨大挑战。因此,如何建立持有人对药品全生命周期风险的控制与转移机制,是MAH制度能够落地的当务之急。
药品缺陷是指合法药品存在危及人身、财产安全不合理的危险,以及假劣药品所致的人身、财产安全损害[5]。即使按照国家药品标准检验合格的药品仍可能存在缺陷,其是药品安全风险的来源。本文主要从药品研制(含临床前研究和临床研究)、生产、经营、储运和使用的全生命周期中分析药品缺陷的类型;继而分析在MAH制度的全产业链开放式委托的环境下不同类型药品缺陷的来源和“过错方”;在此基礎上,结合国外经验和我国实际情况,在持有人对药品质量“负全责”的前提下,针对不同药品缺陷,探索建立持有人对药品安全风险控制与转移的机制。
1 药品缺陷类型
在药品从研制到使用的全过程中,影响药品安全的因素众多,有些是可控的(如人为因素造成的药品质量缺陷,带来药品安全的人为风险),有些则是不可控因素(如在药品研发设计中可能存在的目前认知和科技水平下难以发现的设计缺陷,造成药品安全的天然风险)。一直以来,我国《药品管理法》及相关文件都未对药品缺陷有明确定义,有关药品缺陷致人损害适用的法律法规主要是《民法通则》中的侵权责任、《产品质量法》和《侵权责任法》中的产品责任以及《侵权责任法》中的医疗损害责任等3种[6]。《民法通则》和《产品质量法》中的产品缺陷主要是指由于产品质量不合格、不符合相应国家或行业标准而致人损害[7-8]。然而,药品的科学性和高技术性导致其存在受当前科技水平制约而不能发现的缺陷,即使药品质量符合相应的国家标准和行业标准并且检验合格,仍可能存在缺陷,故《民法通则》《产品质量法》对一般产品缺陷的界定未必能适用于药品这一特殊产品。《侵权责任法》对产品缺陷实行严格责任,即不论行为人有无过错均应对缺陷产品所致损害承担责任[9],但药品受当前科技水平制约而不能发现的缺陷使其在适用《侵权责任法》的严格责任方面还有待商榷。
目前,学术界对药品缺陷的分类标准主要有两类:一类是依其产销管理的次序分为设计缺陷、制造缺陷、说明缺陷和观察缺陷4种类型[10];另一类是按照产品缺陷的类型分为设计缺陷、制造缺陷和警示缺陷[11]。本文为便于追溯MAH制度下不同类型药品缺陷的“过错方”,在参照药品产销次序分类的基础上,结合缺陷的性质和产生原因,将药品缺陷分为设计缺陷、生产经营储运质量缺陷和使用缺陷三大类,由此形成药品全生命周期风险的来源,其中设计缺陷和生产经营储运质量缺陷(特别是生产质量缺陷)是最主要的缺陷,详见图1。
1.1 设计缺陷
药品设计缺陷主要突出的是药品存在不合理的危险,即使是质量检验合格的药品也无法排除所有的危险[5]。近年来,随着我国新药开发力度的加大和不良反应监测体系的完善,由设计缺陷导致不良反应的报告率也一直攀升。2019年全国药品不良反应报告/事件约有151.4万份,其中新的、严重的不良反应报告/事件约有47.7万份(占31.5%)[12]。
药品在上市审批时,是基于“效益大于风险”的原则审批上市,没有绝对安全的药品[10]。这种天然风险,一部分可以在上市前的研究过程中被发现,是已有认知内可预期的风险,即常见的不良反应,通常会在说明书中予以明示。另一部分是非预期风险,造成的原因主要有3个方面:(1)由于研发人员过失或有意违反相关法律法规及合同要求造成的产品设计缺陷。(2)由于药物设计无标准可循,研发人员对药品的配方、结构、工艺等缺乏充分考虑,导致药物的结构、剂型、成分、配方等存在缺陷[11]。(3)排除上述因素,客观上目前科学技术和认知水平尚不能发现的设计缺陷,例如基于当前的科学技术水平以及上市前有限的安全性研究未能发现的技术、工艺缺陷;又如由于临床研究周期和样本的限制造成的临床研究结果受限,而随着产品的长期和广泛应用而逐渐暴露的缺陷;最后,还包括由于个体基础疾病、联合用药、联合治疗等带来的个体用药安全风险。
1.2 生产经营储运质量缺陷
药品生产经营储运质量缺陷是指药品质量不达标而产生的危险,由于质量不符合相应的标准等导致药品存在缺陷[11]。由于国家对药品生产、经营及储运等实施有别于一般产品的特别管理,此处质量不达标主要指合法的主体未按照规范和规定的标准生产、经营以及储运所导致的质量缺陷[10](本文将药品获批上市后在生产、经营及储运过程未良好执行规范和标准而造成的质量不达标统一为药品生产经营储运质量缺陷)。药品上市后,质量缺陷是重要的风险来源,特别是生产阶段的质量缺陷,如“齐二药事件”(以工业用二甘醇替代丙二醇作溶剂)和“欣弗事件”(未按照批准的工艺参数灭菌)等都是由于生产过程违规操作导致对患者产生严重损害[10]。在药品生产、经营及储运过程中,不具备药品生产、经营及储运资质的主体非法生产、经营及储运药品所造成的损害,不属于药品本身的缺陷。
1.3 使用缺陷
药品使用缺陷是指在药品使用环节存在的警示缺陷和观察缺陷。警示缺陷是指药品说明书未能充分提示和说明预期的不良反应而导致患者出现损害;观察缺陷是指在药品使用过程中发生其他不良反应可能会造成人身损害,对于这种潜在危险,责任主体未积极予以控制而造成患者损害[11]。药品使用过程中由于医护人员的不合理、错误的用药指导以及患者使用因素带来的损害,不属于药品缺陷。
2 MAH制度下药品缺陷的来源与“过错方”
以往,药品缺陷的责任主体都是药品生产企业,而在MAH制度及全产业链开放式委托的环境下,在产业链上参与主体更多、关系更复杂的情形下,在持有人对药品质量“负全责”的前提下,各类药品缺陷的“过错方”仍需进一步明确。
2.1 药品设计缺陷的来源与“过错方”
“质量源于设计”,MAH制度的优势之一是让研发机构成为持有人,促使研发者更重视产品设计,从而更好地规避研发设计中的缺陷,包括可预期的缺陷以及研发机构违规和未充分考虑这两种人为因素导致的非预期缺陷。
对于现有认知内可预期的风险,即常见可预期的不良反应,在经过严格的安全性上市审评后,一般人体可以接受。有些药品即使有严重的不良反应(如用于治疗癌症的化疗药物),在效益大于风险时,也属正常范围[13]。而对于非预期设计缺陷,以委托研发模式为例[即如果持有人是投资机构或者有销售渠道优势的药品经营企业,而作为研发者的合同研究组织(CRO)和临床试验研究机构均可与MAH 合作,订立药品研发合同或临床试验合同,以帮助MAH 实现药品研发或临床试验外包[14],其药品设计缺陷的“过错方”主要包括以下3种情况:第一种是药物设计开发人员以及临床研究人员违规行为或者伪造、编造、改换数据等隐瞒真实情况以达到合同要求或通过药监部门审评造成的非预期缺陷。这种情形理论上可按照《侵权责任法》中的过错原则由受托研究机构承担责任,而持有人则需要视其是否知情、默许或合谋等情形而定。第二种是设计开发人员未能充分考虑导致的设计缺陷。由于药物研发无标准可循,这种情形的损害责任应由双方的合作方式决定:(1)受托研发机构只负责研发,持有人以“买断”所有权的方式获得技术成果,对产品的评估及是否上市由持有人自行决定,且后果自负,则产品上市后设计缺陷的损害责任应由持有人承担;(2)受托研发机构对研发的产品保留一定权利,在产品上市后,持有人和研发机构共享销售利益、共担风险,结成“利益共同体”,则此种情况下设计缺陷的责任应由双方在合同中约定——由持有人承担或由持有人承担后向研发机构追偿或双方共同承担。对于非预期风险的第三种——目前科学技术水平尚不能发现的设计缺陷——不同国家在是否承认科技抗辩方面存在差异。我国须首先明确在药品领域是否承认科技抗辩,才能明确由谁来承担责任。委托研发模式下药品设计缺陷的类型及“过错方”详见图2。
2.2 药品生产经营储运质量缺陷的来源与“过错方”
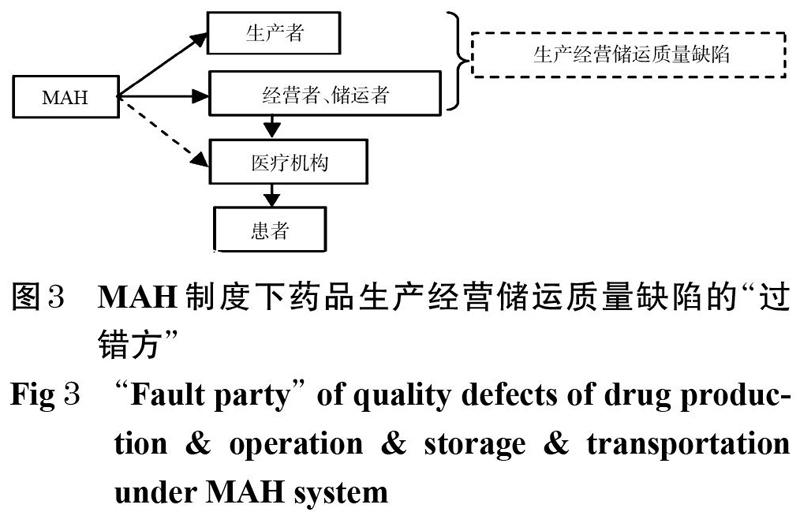
在MAH制度下,研发、生产、经营、储运都可委托给不同的主体,产业链更加扁平化。由于医疗机构销售渠道“两票制”政策的限制,在药品生产出来后,MAH可直接委托经营者销售,也可以自己作为投标主体,中标后向医疗机构供货。生产、经营及储运等环节违规行为造成的质量缺陷,属于本可避免而未避免、本可管理而未管理的风险,可以明确依照《侵权责任法》中的过错责任原则,由过错方承担违约责任,即生产者、经营者及储运者分别是生产经营储运环节药品质量缺陷的“过错方”,详见图3(注:此处省略了委托研发环节)。
2.3 药品使用缺陷的来源与“过错方”
对于警示缺陷,由于持有人是药品的上市申请人,而说明书和标签本身属于药品的组成部分,因而警示缺陷所造成的损害责任应由持有人承担。对于观察缺陷,由于持有人是药品上市后不良反应监测及采取风险控制措施的主体,如果药品存在质量问题或者其他安全隐患的,持有人负有停止产品销售并实施产品召回的义务[3],因此观察缺陷造成的损害责任,也应由持有人承担。
3 对建立持有人风险控制和转移机制的建议
目前,国际上对MAH风险的控制和转移的方式不尽相同,我国持有人风险的控制和转移机制尚未形成。笔者借鉴国际经验,结合国内实际,对建立我国药品上市持有人风险控制和转移机制提出建议。
当前,关于持有人风险控制和转移的方式讨论最多的是以保险的形式,即参照欧美模式,以商业保险来转移持有人的风险。2016年国务院出台的《药品上市许可持有人制度试点方案》(以下简称《试点方案》)提出研发机构型持有人应当在药品上市前,向省级药品监督管理局提交保险合同或担保协议,对注射剂类药品应提交保险合同[15]。2020年3月,国家药品监督管理局发布《药品上市许可持有人检查要点(征求意见稿)》(以下简称《检查要点》)。这是继新版《药品管理法》(以下简称“新法”)后国家药品监督管理局对持有人的检查指南,其中关于“责任赔偿”的检查要点,主要是持有人对应药品侵权责任的商业保险购买情况、对应药品侵权责任的担保情况和在委托协议中规定药品侵权赔偿责任(仅限以委托方式生产或经营的持有人)[16]。无论是《试点方案》,还是《检查要点》,均要求持有人提交保险合同或担保协议,但保障的是哪类药品缺陷带来的风险、委托协议中该如何就不同类型缺陷在持有人和委托方之间进行责任约定等问题在上述文件中都未明确。本文主要针对药品设计缺陷和生产经营储运质量缺陷,在上述政策的原则性指导下进行探讨。
3.1 对药品设计缺陷带来风险的控制和转移
20世纪以来,我国药害事件并不多发。国际上著名的药害事件几乎都发生在国外,究其原因是一直以来我国药品以及生产工艺主要以仿制国外已上市且过了专利保护期的新药为主,安全性较高。我国真正具有自主知识产权的新药并不多,而预期外的不良反应发生主要集中在新药领域。这也使得我国药害事件并不突出[17]。由于我国《药品管理法》中缺乏药品缺陷的相关规定,而《侵权责任法》和《产品质量法》等一般的产品责任制度中难以找到适用于药品设计缺陷的法律依据,故实践中往往在缺陷药品致人损害后,生产者可依照《产品质量法》主张产品是符合国家标准或行业标准的、质量是合格的,以申请免责,或者依据“公平原则”由各方分摊责任,仅在“道义上”对受害者进行一定补偿[13]。这种责任主体无违法行为就不承担药品损害责任,不仅对受害者不利,也会弱化责任人的责任意识。因此,我国亟需明确不同设计缺陷责任认定的法律适用。
同时,我国也尚未形成相应的药品不良反应补偿机制[18]。对于设计缺陷导致的药品严重不良反应,国际上主要有保险和救济两种方式,欧美主要是保险模式。例如德国要求药品上市持有人必须自行为其产品购买商业保险或提供金融担保,政府没有为企业提供该类保险的义务,并且设置了赔付限额[19]。美国是市场化的保险模式,政府的不良反应行政补偿主要是针对疫苗这一公益性和战略性产品,美国于1986 年制订了《国家儿童疫苗伤害法》,以法律的形式对疫苗受害者补偿制度作出了规定;政府建立了基金配合制度,一方面通过划拨国库的部分资金建立了专项疫苗损害补偿信托基金,另一方面针对处于补偿范围内的疫苗生产企业和进口企业强制征收疫苗税[20]。日本和我国台湾地区采取的是不良反应基金救济模式,以政府为主导,赔偿机制为赔偿加补偿,救济基金由政府拨款和企业缴费组成,救济的认定、发放和发放标准均由政府部门决定及实施[21]。由于药品责任认定困难,日本救济基金制度在药害事件无法确认具体责任及责任人时还具有为制药企业“兜底”的作用[19]。针对药品不同的设计缺陷,结合我国国情,笔者提出以保险+救济相结合的方式建立我国药品不良反应补偿机制。
3.1.1 人为因素导致设计缺陷的法律适用与保险模式 对于非预期风险的前两种——人为因素造成的设计缺陷引发的严重不良反应,在委托研发模式下,由于MAH是“资源整合者”,是唯一从药物开发到完成临床研究并申报上市的全程“跟踪者”,是药品申报的主体,同时也是上市药品的所有权人,建议可适用《侵权责任法》的无过错责任原则,实行严格责任,由持有人承担。
针对非预期设计缺陷的第一种——受托研究机构违规行为造成的设计缺陷,虽然受托机构是“过错方”,然而,一方面,药物由实验室研发到临床研究的过程中,违规主体可能是受托的实验室研发机构、临床试验CRO、临床试验机构等,主体多元,环节长,如果要求各受托方都购买不良反应保险并不现实;另一方面,由于研发机构多是轻资产单位,且具有技术资产上的优势,以及國内临床试验机构的地位优势(目前国内临床试验机构数量少,供不应求),要求受托机构投保恐难成行;最后,由于持有人是产品上市申请人,也应是其所申报上市药品的数据真实性审核和相应药品安全责任的第一责任人,因此,可由持有人投保药品不良反应保险,在持有人承担责任后,再进一步向受托机构追偿。持有人可事前通过合同约定,以保证金、资产质押等方式,确保受托研究机构具有一定的赔付能力,同时提高其责任意识,以上也应反映在双方的质量协议中。同时,持有人也会对受托机构的责任承担能力进行事前评估以降低赔付风险。由持有人投保,也一定程度上能规避持有人知情、默许或合谋等情形的发生。
针对非预期设计缺陷的第二种——药物设计开发人员未充分考虑造成的缺陷的情形(1)——“买断”方式下,应由持有人购买不良反应保险;对于情形(2)——“利益捆绑”方式下,可由持有人在投保时,将自身作为被保险人、受托研发机构作为附加被保险人,保费以约定的方式由双方共担。
根据我国医药企业规模小、实力弱且不良反应保险在我国处于起步阶段的国情,笔者建议我国可依照风险管理的思想,以不良反应发生率较高的产品品种(如创新药品、处方药)和剂型(如注射剂)等作为试点,探索实施强制不良反应保险。其他品种暂时可以采用自愿投保的方式或者提供担保、保证金等方式保障持有人及受托机构的赔付能力。
3.1.2 “例外情况”的法律适用与补偿模式 对于“例外情况”即非预期风险的第三种——目前科学技术水平尚不能发现的设计缺陷,德国《药品法》以无过失责任、强制保险和不承认科技抗辩的三阶结构来平衡生产企业和消费者的权益[19]。无过失责任即损害发生后,企业即使无过失也要担责,即在德国,药品不同于一般商品,实行严格责任,不承认科技抗辩。日本没有专门针对药品损害的法律,主要适用《民法》和《产品责任法》中的侵权责任与产品责任,承认科技抗辩[19]。由于药品是人类生存必需品且本身风险又难以避免,若一概以无过错责任原则进行责任认定,或难“合乎情理”,也不利于产业的创新发展。建议我国可依据《产品质量法》第四十一条第三款规定“将产品投入流通时的科学技术水平尚不能发现缺陷的存在的,生产者不承担赔偿责任”[8],承認科技抗辩。
同时,可建立我国的不良反应补偿制度,由政府补助经费和接受社会捐助为主进行补偿,或者将救治的医疗费用纳入社会保险,由社会共同承担。这既符合社会公平责任原则与社会伦理道德的要求,也能鼓励行业创新[22]。此外,还可对一些因基础疾病、联合用药、联合治疗等个体用药安全风险导致的损害进行人道主义的补助。2019年《疫苗管理法》对预防接种异常反应(严重不良反应)实行补偿制度,免疫规划疫苗补偿费用由省级政府在预防接种经费中安排,非免疫规划疫苗补偿费用由上市持有人承担[23]。这是我国第一次在药品领域实行不良反应政府补偿,证明我国在这方面迈出了一步。因此,推动我国建立由于目前科技水平无法发现的设计缺陷导致的严重不良反应的补偿制度,很有必要且具有可行性。
探索出台不良反应补偿制度,由我国药品不良反应监测体系在监测不良事件的同时,组织专家对药害事件进行鉴定,明确缺陷类型、损害原因以及责任主体;无论是保险还是政府补偿,建议参照日本和我国台湾地区模式,明确药害损害程度分级标准、不良反应补偿范围、补偿标准等,避免在实践中由于缺少标准造成补偿不到位以及企业逃避责任等问题;对于一些药品如癌症用药,其严重不良反应发生率极高,但攻克癌症又是当前的社会重大课题,属于行业技术尖端领域,故出于对行业创新的鼓励,可以制定相应目录,将治疗特殊疾病(如癌症)的药品纳入目录,实行保费补贴等政策[21]。
针对设计缺陷的不同类型,分别采用无过错责任原则和承认科技抗辩,既能严格主体责任、规范主体行为、保障药品的“源头质量”,又彰显法律的“合乎情理”。基于此,可在我国推行不良反应保险+救济的模式,两种方式相辅相成,可覆盖各类药品设计缺陷,从而为药品研发创新“保驾护航”。
3.2 对药品生产经营储运质量缺陷带来风险的控制和转移
3.2.1 药品生产经营储运质量责任保险 新法规定了MAH、药品生产企业、药品经营企业或医疗机构违反本法规定,给用药者造成损害的,依法承担赔偿责任[3]。但新法虽规定持有人对药品质量全面负责,《试点方案》中也要求研究机构型上市许可申请人提供担保协议或保险合同,却未对生产、经营及储运方提出具体要求。这在强化持有人责任的同时,一定程度上淡化了受托生产者、经营者等的责任;并且,非生产企业型持有人由于缺乏药品生产管理经验,与受托生产方之间缺乏有效、专业的沟通及监督,易使受托方安全责任意识薄弱,加大了违规风险。
商业责任保险是经济发展和法制完善到一定水平时,以市场第三方介入的形式管理社会经济活动的方式。应用责任保险的典型国家是美国,其责任保险模式主要依靠市场手段,政府不强制要求制药企业购买产品责任保险,但合作的第三方机构,如批发商、受托研究机构和临床试验机构,在签订的委托协议中一般都有购买产品责任保险的内容[24]。我国企业的产品出口美国,通常也需要提供保险合同。美国责任保险之所以高度发展,是基于美国严格的产品责任法律制度,如对于销售的商品,只要科学技术能够发现其缺陷,无论产品生产时间是何时,厂商都对产品负有责任;无论实际上是过失还是故意造成的损害,生产者负有产品安全的绝对义务。同时,其在一般赔偿之外,还设有高昂的惩罚性赔偿,使得违规成本巨大。在美国,即使是大型企业或集团也一般都会积极购买责任保险,通过保险公司转移风险[24]。此外,美国责任保险市场的庞大,还源于在保险领域有严密完善的法律体系作支撑。
在药品全生命周期中,生产、经营及储运的参与方都负有产品质量责任,理论上都可以或都应该投保以转移自身风险。但是在我国,当前相关民事侵权法律体系尚不完备,一般性赔偿范围较窄以及惩罚性赔偿力度不大,都不足以严格生产者等的责任,难以对其形成威慑,这也是我国药品质量事件频发的重要原因。违法成本过低,企业就缺少通过保险转移风险的动力,致使投保率不高。
2019年《疫苗管理法》第六十八条规定国家实行疫苗强制责任险制度,疫苗上市持有人应当按照规定投保;因疫苗质量问题造成受种者损害的,保险公司在承保的责任限额内予以赔付[23]。这体现了国家对疫苗这一公益性、战略性产品质量安全的重视,也体现了国家对保险在药品领域应用的重视。鉴于生产是高风险环节,建议国家依照风险管理的思路,对生产环节高风险的剂型(如注射剂)和品种(如生物制品等),在新法的后续文件中规定实施强制责任保险,或开展强制责任保险试点,逐步扩大到所有品种和剂型。同时,在新法中应配套更高的惩罚性赔偿金标准,以约束生产者的行为。
药品质量强制责任保险的投保人是MAH还是受托生产企业?笔者认为,生产责任险的保险标的是药品质量缺陷造成的患者损害,过错方是受托生产企业,并且持有人可以多点委托生产,故应参照美国的责任保险制度,由生产厂家进行投保。如果由持有人进行投保,将会导致生产企业产生自身“无责”的意识,缺少对生产企业的约束,也会加大持有人的风险压力和经济负担。而由生产企业投保,由于持有人是产品的所有权人,药品的质量好坏直接关系产品的市场生存,持有人也不会对生产过程“坐视不管”。在受托生产企业自律和持有人监督的合力下,更有利于严格控制药品质量。保险是确保生产企业对其损害责任有赔付能力,而超出保险赔付限额的部分应由生产企业自行赔付,持有人承担连带责任,这也会促使持有人监督受托生产企业是否投保。并且,保险公司更重要的是要考察生产企业的质量保障能力,对其进行风险评估。如果由持有人投保,在多点委托生产的模式下,保险公司需要评估多家生产企业的质量保证能力,以及持有人的质量保证体系,涉及主体众多,保险设计会非常复杂。另一种做法是将持有人作为投保人、受托生产企业作为附加被保险人,保险公司同时考察持有人的质量保证体系和受托生产企业的质量保障能力,也依然会存在上述问题,并且保费如何分担也有待商榷。我国《疫苗管理法》要求疫苗持有人投保疫苗强制责任保险,但疫苗持有人同时也是疫苗生产企业,并且一般情况下疫苗不委托生产,也不存在多点委托的情况,故不存在上述问题。
对于药品质量强制责任保险,由政府制定赔付限额,如单次赔付限额、总赔付限额等类似车险的限额支付,超出部分由违规企业支付,既能保护受害者权益,也能对违规生产企业形成惩戒,亦能提高保险公司的积极性。有责任风险才有责任保险,除对生产企业高风险品种、剂型强制投保质量责任险外,也可同步试点,探索对经营、储运环节的高风险品种、剂型投保经营、储运质量责任保险。
3.2.2 合同约定 合同约定是以市场化手段解决在商业契约中双方的责任问题。MAH制度下,对未实施责任保险的品种和剂型,探索由受托生产企业、经营企业提供保证金、资产质押,由母公司为子公司关联担保等方式控制风险,并进行合同約定,以保障受托方的赔付能力,提高受托方的责任意识。药品监督管理部门明确不同品种、剂型药品保证金的最低额度以及质押、关联担保的形式与要求,并反映在质量协议模板中,为我国当前尚不够成熟的商业环境和契约精神保驾护航。同时,为了防范受托企业在保险范围之外造成的患者损害,如故意违反相关规范造成的药品质量缺陷致人损害,以及承担违反合同中的保证义务造成的损失以及超出保险限额部分的损失,也应探索以保证金等方式进行合同约定,增强受托企业及持有人的风险承担能力。
通过以药品质量责任保险为主、合同约定为补充的方式,能够覆盖生产、经营及储运等各环节的药品风险,以商业化的手段实现持有人风险的控制和转移,让“过错方”担负起应有的责任,提升对药品的质量控制水平。
3.3 其他
MAH制度打破了原有 “国产药品”“进口药品”的概念,促使产业分工和资源整合。我国允许境外机构或企业成为持有人,生产场地亦可选择境外,对于境外机构,保障其具备责任承担能力更为重要。建议可探索国内外药品责任保险、药品不良反应保险的衔接机制,如国内上市持有人委托境外的药品生产企业生产时,由境外生产企业投保责任险,且须办理与境内相关保险公司的接轨手续,或寻找中国的保险公司在当地开设的分公司进行对接;或者在当前我国药品保险刚起步、产品不成熟以及保险公司在境内外因政策、法规等不同造成险种不一致的情形下,可由境外企业提供保证金,保障其具备责任赔付能力。
此外,我国还应发展药品召回保险,对由于药品设计缺陷、生产经营储运质量缺陷和使用缺陷,由持有人投保药品召回保险,在持有人启动召回时,由保险公司承保产品的召回费用,同时在委托关系中,根据过错原则,在相应受托研究机构和受托生产经营及储运企业缴纳的保证金之中,纳入产品召回费用的保证金等。最后,针对我国医药企业规模小、实力弱的现状,为减轻持有人和生产企业的保费压力,政府可出台相关税收优惠政策,允许企业保险保费自缴部分计入企业技术开发费用,鼓励企业投保。
4 结语
本研究将药品全生命周期中的缺陷分为设计缺陷、生产经营储运质量缺陷和使用缺陷三大类,其中设计缺陷和生产经营储运质量缺陷(特别是生产质量缺陷)是最主要的缺陷,也是药品安全风险的主要来源。在MAH制度的产业链开放式的委托环境下,设计缺陷主要有人为因素造成的设计缺陷和当前科学技术水平不能发现的设计缺陷,“过错方”依照不同情形既可能是研发者也可能是持有人,建议通过保险+救济相结合的方式实现持有人风险的控制和转移;生产经营储运质量缺陷的过错方是药品生产、经营及储运企业,建议以药品质量责任保险为主、合同约定为补充的方式,让“过错方”担负起应有的责任。
MAH制度下,药品安全风险不容忽视,限于研究所限,本文还未能涉及生产中的原辅料质量问题造成的药品安全风险控制的研究,有待后续研究进一步完善。
参考文献
[ 1 ] 谢金平,孙圆圆,彭楠,等. 药品上市许可持有人(MAH)制度对现行监管制度的影响及衔接建议[J].中国卫生政策研究,2018,11(12):1-6.
[ 2 ] 顾彦.CRO、CMO破解研发难新药研发迎来最好时代[J].中国战略新兴产业,2017,5(33):46-48.
[ 3 ] 全国人民代表大会.中华人民共和国药品管理法[EB/OL].(2019-08-26) [2020-07-25].http://www.npc.gov.cn/npc/c30834/201908/26a6b28dd83546d79d17f90c62e59461.shtml.
[ 4 ] 武志昂.从风险管理的角度看药品全程监管[J].药物警戒,2008,5(6):321-330.
[ 5 ] 宋民宪,赵因,李婷,等.药品缺陷概念研究[J].医学与哲学,2012,33(9A):45-47.
[ 6 ] 邹宜諠,陈云,柳鹏程,等.日本药品上市许可持有人制度下的临床试验保险设置研究对中国的启示[J].中国新药杂志,2018,27(4):369-372.
[ 7 ] 全国人民代表大会.中华人民共和国民法通则:2009年修正[EB/OL].(2009-08-27)[2020-07-25].http://www.npc.gov.cn/npc/c30834/201901/7f507d5963074e9ebc73c986- e155b931.shtml.
[ 8 ] 全国人民代表大会.中华人民共和国产品质量法(2018年修正)[EB/OL].(2019-01-07)[2020-07-25].http://www.npc.gov.cn/npc/c30834/201901/7f507d5963074e9ebc73c- 986e155b931.shtml.
[ 9 ] 宋民憲,梁萍,李婷,等.缺陷药品侵权责任与药品生产、经营、使用违法行为侵权责任之比较研究[J].医学与法学,2013,5(2):59-61.
[10] 宋跃晋.药品缺陷的法律分析[J].河北法学,2010,28(11):134-138.
[11] 彭楠,柳鹏程,邵蓉.药品上市许可持有人制度下保险赔偿范围设计研究[J].广东药科大学学报,2019,35(1):102-106.
[12] 国家药品不良反应监测中心.国家药品不良反应监测年度报告:2019年[EB/OL].(2020-04-10)[2020-09-03].http://www.cdr-adr.org.cn/tzgg_home/202004/t20200410_47300.html.
[13] 刘丽萍,刘晓军.药品不良反应的法律责任及对策[J].中国执业药师,2008,5 (12):28-30.
[14] 邵蓉,郑澜,胡晨希,等.药品上市许可人制度下的药品安全责任分配体系[J].中国医药工业杂志,2013,44(6):634-638.
[15] 国务院.国务院办公厅关于印发药品上市许可持有人制度试点方案的通知[EB/OL]. (2016-06-06)[2020-07-25].http://www.gov.cn/zhengce/content/2016-06/06/content_5079954.html.
[16] 国家药品监督管理局.国家药监局综合司公开征求《药品上市许可持有人检查工作程序(征求意见稿)》《药品上市许可持有人检查要点(征求意见稿)》意见[EB/OL].(2020-02-25)[2020-07-25].http://www.nmpa.gov.cn/WS04/ CL2138/375216.html.
[17] 叶正明.国外药品不良反应损害救济制度述评及其对我们的启示[J].时代法学,2005 (1):93-97.
[18] 国家食品药品监督管理总局.药品不良反应报告和监测管理办法[EB/OL].(2011-05-04)[2020-07-25].http://www.gov.cn/flfg/2011-05/24/content_1870110.html.
[19] 邹宜諠,陈云,柳鹏程,等.德国和日本药品上市许可持有人制度下的药品损害事件风险管理研究[J].中国药事,2018,32(3):362-366.
[20] SMITH R. Compensation for drug injury. Problems both sides of the Atlantic[J]. Br Med J,1981,282(6274):1443- 1445.
[21] 张枫,徐晓媛.日本与我国台湾地区药品不良反应损害救济基金制度的比较及对我国的启示[J].中国药房,2017,28(22):3036-3039.
[22] 郭记敏.我国药品不良反应损害救济模式构建的研究[J].中国药房,2016,27(15):2024-2027.
[23] 全国人民代表大会.中华人民共和国疫苗管理法[EB/OL].(2019-06-29)[2020-07-25].http://www.npc.gov.cn/npc/c30834/201907/11447c85e05840b9b12c62b5b645fe9d. shtml.
[24] 朱佳娴,施绿燕,颛孙燕.欧盟、美国、日本药品上市许可持有人制度分析及启示[J].上海医药,2020,41(1):47- 50.
(收稿日期:2020-07-28 修回日期:2021-01-11)
(编辑:罗 瑞)
