清肺保元胶囊对COPD模型大鼠气道炎症的抑制作用及对NLRP3信号通路的影响
2021-03-02胡万福刘明杨燕李玲李广松
胡万福 刘明 杨燕 李玲 李广松


摘 要 目的:探討清肺保元胶囊对慢性阻塞性肺疾病(COPD)模型大鼠气道炎症的抑制作用,以及对NOD样受体蛋白3(NLRP3)信号通路的影响。方法:将60只SD雄性大鼠随机分为空白对照组、模型组、地塞米松组(阳性对照,0.2 mg/kg)和清肺保元胶囊高、中、低剂量组(1 232.0、616.0、308.0 mg/kg),每组10只。除空白对照组外,其余各组大鼠经烟熏28 d和气管内滴注脂多糖2次以复制COPD模型。自实验第29天起,空白对照组和模型组大鼠灌胃等体积生理盐水,各给药组大鼠灌胃相应药物;给药体积均为10 mL/kg,每日1次,连续28 d。末次给药后,检测各组大鼠肺功能;采用苏木精-伊红染色法观察其肺组织病理学变化,采用酶联免疫吸附测定法检测其支气管肺泡灌洗液中白细胞介素1β(IL-1β)的含量并进行白细胞计数;采用Western blotting法检测其肺组织中NLRP3、剪切的胱天蛋白酶1(Cleaved caspase-1)蛋白的相对表达量。结果:模型组、地塞米松组和清肺保元胶囊高、中、低剂量组分别有3、2、1、1、2只大鼠死亡。与空白对照组比较,模型组大鼠第0.3秒用力呼气容积/用力肺活量比值(FEV0.3/FVC)显著降低(P<0.01);其肺组织可见大量炎性细胞浸润,病变明显;其支气管肺泡灌洗液中IL-1β含量和白细胞计数以及肺组织中NLRP3、Cleaved caspase-1蛋白的相对表达量均显著升高(P<0.05或P<0.01)。与模型组比较,各给药组大鼠FEV0.3/FVC均显著升高(P<0.05或P<0.01);其肺组织病变不同程度地改善;其肺泡灌洗液中IL-1β含量和白细胞计数,肺组织中NLRP3蛋白(清肺保元胶囊低剂量组除外)和Cleaved caspase-1蛋白(清肺保元胶囊中、低剂量组除外)的相对表达量均显著降低(P<0.05或P<0.01)。结论:清肺保元胶囊可减轻COPD模型大鼠的肺组织病理损伤、改善其肺功能,这种作用可能与抑制NLRP3信号通路进而抑制炎症反应有关。
关键词 清肺保元胶囊;慢性阻塞性肺疾病;气道炎症;NOD样受体蛋白3信号通路;大鼠
中图分类号 R285.5 文献标志码 A 文章编号 1001-0408(2021)03-0309-05
DOI 10.6039/j.issn.1001-0408.2021.03.10
ABSTRACT OBJECTIVE: To investigate inhibitory effects of Qingfei baoyuan capsule on airway inflammation in rats with chronic obstructive pulmonary disease (COPD), and its effects on NLRP3 signaling pathway. METHODS: Totally 60 SD male rats were randomly divided into blank control group, model group, dexamethasone group (positive control, 0.2 mg/kg), Qingfei baoyuan capsule high-dose, medium-dose and low-dose groups (1 232.0, 616.0, 308.0 mg/kg), with 10 rats in each group. Except for blank control group, other groups were fumigated for 28 days and given intratracheal dripping of lipopolysaccharide twice to induce COPD model. Since the 29th day after modeling, blank control group and model group were given constant volume of normal saline intragastrically, and administration groups were given related medicine intragastrically. The administration volume was 10 mL/kg, once a day, for consecutive 28 days. After last administration, the lung function was detected. The pathological changes of lung tissue were observed by HE staining. The content of interleukin-1β (IL-1β) in bronchoalveolar lavage fluid (BALF) were detected by ELISA, and the number of leukocytes was counted; the expression of NLRP3 and Cleaved caspase-1 in lung tissue of rats were detected by Western blotting assay. RESULTS: Three, two, one, one and two rats died in model group, dexamethasone group, Qingfei baoyuan capsule high-dose, medium-dose and low-dose groups, respectively. Compared with blank control group, FEV0.3/FVC of rats in model group was significantly decreased (P<0.01). A large number of inflammatory cells infiltration were found in the lung tissue, and lung tissue lesion was obvious. The content of IL-1β and white blood cell count in BALF, relative expression of NLRP3 and Cleaved caspase-1 protein in lung tissue were increased significantly (P<0.05 or P<0.01). Compared with model group, FEV0.3/FVC of administration groups were increased significantly (P<0.05 or P<0.01); lung tissue lesion of them were improved to different extents. The content of IL-1β and white cell count in BALF, relative expression of NLRP3 protein (except for Qingfei baoyuan capsule low-dose group) and Cleaved caspase-1 protein (except for Qingfei baoyuan capsule medium-dose and low-dose groups) in lung tissue were decreased significantly (P<0.05 or P<0.01). CONCLUSIONS: Qingfei baoyuan capsule can relieve lung tissue lesion and improve lung function in COPD model rats, the effects of which may be associated with inhibiting inflammation reaction by inhibiting NLRP3 signaling pathway.
KEYWORDS Qingfei baoyuan capsule; Chronic obstructive pulmonary disease; Airway inflammation; NLRP3 signaling pathway; Rat
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD),因其高发病率和病死率,已成为全球重大的健康问题[1]。吸烟是COPD重要的危险因素,由于吸烟引起的慢性气道炎症进一步加重了小气道异常和实质损伤[2-3]。近年许多研究表明,NOD样受体蛋白3(NLRP3)通路参与了COPD的气道炎症进程[4-5],故其已成为COPD治疗的新靶点。清肺保元胶囊处方源于贵州中医药大学第一附属医院呼吸内科使用的中药复方“清肺保元汤”,由紫花地丁、茯苓、当归等药材组成,具有清热化痰、宣肺止咳、活血化淤的功效[6]。为便于患者使用,该院将其开发成医院制剂“清肺保元胶囊”,临床实践证实该药治疗COPD的效果较好[7],具有開发成上市药品的潜力,但其抗COPD的药理作用及其具体机制尚不清楚。基于此,本研究拟利用烟熏加脂多糖复制COPD大鼠模型,观察清肺保元胶囊对NLRP3通路相关蛋白[NLRP3、剪切的胱天蛋白酶1(Cleaved caspase-1)]、白细胞介素1β(IL-1β)等表达的影响从而探讨其对COPD模型大鼠气道炎症的改善作用机制,为该药治疗COPD提供实验依据。
1 材料
1.1 主要仪器
实验用主要仪器包括动物熏烟箱(自制,60 cm×50 cm×40 cm)、AniRes 2005型动物肺功能分析系统(北京贝兰博科技有限公司)、RM2245型石蜡切片机(德国Leica公司)、DYCZ-40型电泳仪(北京六一仪器厂)、BX51T- PHD-J11型显微镜(日本Olympus公司)、MK3型全功能酶标仪(美国Thermo Fisher Scientific公司)、S10型高速均质器(上海利闻科学仪器有限公司)、Tanno 5200型化学发光凝胶成像仪(上海天能科技有限公司)。
1.2 主要药品与试剂
实验用主要药品与试剂有:清肺保元胶囊(贵州中医药大学第一附属医院药剂科生产,批号20181108,规格每粒装0.44 g;用法用量为口服,每次4粒,每日3次),醋酸地塞米松片(浙江仙琚制药股份有限公司,批号180316,规格0.75 mg),黄果树牌香烟(贵州中烟工业有限责任公司),脂多糖(美国Sigma公司,批号026M4015V),吉姆萨染色液试剂盒(安徽雷根生物技术有限公司,批号20190121),生理盐水(贵州鑫源生物科技有限公司,批号180413),水合氯醛(天津市大茂化学试剂厂,批号20180123),大鼠IL-1β免疫酶联吸附测定法(ELISA)试剂盒、兔抗大鼠NLRP3抗体、兔抗大鼠Cleaved caspase- 1抗体、DAB显色试剂盒(武汉博士德生物工程有限公司,批号分别为12621873002、12CM405B、12J18、12I16B26),兔β-actin抗体(英国Abcam公司,批号ab8216),生物素标记的山羊抗兔免疫球蛋白G(IgG)二抗(上海碧云天生物技术有限公司,批号12AB512C),微量BCA蛋白定量试剂盒(北京康为世纪生物科技有限公司,批号MS190124),苏木精-伊红(HE)染色试剂盒(上海碧云天生物技术有限公司,批号201812017),十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)制备试剂盒(北京索莱宝生物科技有限公司,批号20181125);甲醇为色谱纯,其余试剂均为分析纯或实验室常用规格,水为蒸馏水。
1.3 动物
实验用SPF级SD大鼠60只,雄性,体质量180~220 g,购自长沙市天勤生物技术有限公司,动物生产许可证号为SCXK(湘)2014-0011。所有大鼠均于温度21~24 ℃、湿度50%~55%、12 h光照/12 h黑暗交替的环境下进行饲养。
2 方法
2.1 分组、造模与给药
大鼠适应性喂养1周后,将其随机分成空白对照组、模型组、地塞米松组(0.2 mg/kg,按临床用量的7倍折算)和清肺保元胶囊高、中、低剂量组(1 232.0、616.0、308.0 mg/kg,分别按临床用量的14、7、3.5倍折算),每组10只。采用气管内滴注脂多糖生理盐水溶液(200 μg/μL)联合烟熏法制作COPD大鼠模型[8-9]:分别于实验第1、14天时在大鼠气管内滴注上述溶液(空白对照组大鼠气管内滴注生理盐水);于实验第2~28天(除第14天外),使其被动吸烟30 min,1支/只(空白对照组大鼠不作处理)。自实验第29天开始,各药物组大鼠灌胃相应药物,空白对照组和模型组大鼠灌胃等体积生理盐水;给药体积均为10 mL/kg,每日1次,连续28 d。
2.2 肺功能检测
参照文献[9-10],于末次给药后,腹腔注射10%水合氯醛溶液(3 mL/kg)对大鼠进行麻醉,将其以仰卧位固定,切开颈部皮肤、肌肉后暴露气管,朝心方向剪一小口,行气管插管约2 cm,结扎固定。气管插管另一端与动物肺功能分析系统连接,检测大鼠的用力肺活量(FVC)和第0.3秒用力呼气容积(FEV0.3),并以两者比值(FEV0.3/FVC)作为评价大鼠肺功能的指标。
2.3 标本制备
肺功能检测结束后,在大鼠处于麻醉状态下于其腹主动脉取血后,切开胸部,结扎右肺门,于颈部气管下端作一T形切口,行气管插管,以磷酸盐缓冲液(PBS,pH 7.4)进行肺泡灌洗。收集支气管肺泡灌洗液,以2 000 r/min离心10 min,取上清液,置于-80 ℃冰箱中保存,用于IL-1β含量、白细胞计数的检测。处死大鼠,取右肺组织适量,立即置于液氮中冷冻,随后转移至-80 ℃冰箱中保存,用于NLRP3通路相关蛋白表达的检测;取左肺组织适量,于4%多聚甲醛溶液中固定,用于肺组织形态学观察。
2.4 指标检测
2.4.1 肺组织病理观察 采用HE染色法。取“2.3”项下固定于4%多聚甲醛溶液中的大鼠左肺组织适量,经常规乙醇梯度洗脱、石蜡包埋后,切片(厚度约5 μm),再经HE染色后,于显微镜下观察大鼠肺组织病理改变。
2.4.2 支气管肺泡灌洗液中IL-1β含量 采用ELISA法。取“2.3”项下大鼠支气管肺泡灌洗液适量,使用全功能酶标仪检测其中IL-1β的含量,严格按照相应试剂盒说明书方法操作。
2.4.3 支气管肺泡灌洗液中白细胞计数 采用吉姆萨染色法检测。取“2.3”项下支气管肺泡灌洗液10 μL,涂抹于玻片上,晾干后滴加少量甲醇固定,将玻片置于吉姆萨染色液中浸染,用水冲洗后自然干燥,于显微镜下观察被染成紫色或蓝紫色的白细胞并计数,严格按照相应试剂盒说明书方法操作。
2.4.4 肺組织中NLRP3、Cleaved caspase-1蛋白的表达情况 采用Western blotting法检测。取“2.3”项下大鼠右肺组织适量,置于EP管内,于冰上捣碎后匀浆,以13 000 r/min离心5 min,取上清液,采用BCA法测定蛋白含量后,煮沸变性。取变性蛋白适量,行SDS-PAGE分离并转移至PVDF膜上,在室温下以5%脱脂奶粉封闭1 h,分别加入NLRP3、Cleaved Caspase-1、β-actin一抗(稀释度分别为1 ∶ 300、1 ∶ 2 500、1 ∶ 6 000),4 ℃孵育过夜;用TBST溶液缓慢清洗5 min×3次,分别加入二抗(稀释度为1 ∶ 10 000),于室温下孵育2 h;用TBST溶液缓慢清洗5 min×3次,经ECL显影液显影后,置于化学发光凝胶成像仪下成像。使用Image J v1.8.0软件进行分析,以目标蛋白与内参(β-actin)条带的灰度值比值表示目标蛋白的相对表达量。
2.5 统计学方法
采用SPSS 17.0软件对数据进行统计分析。计量资料以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD法(方差齐)或Games-Howell法(方差不齐)。P<0.05为差异有统计学意义。
3 结果
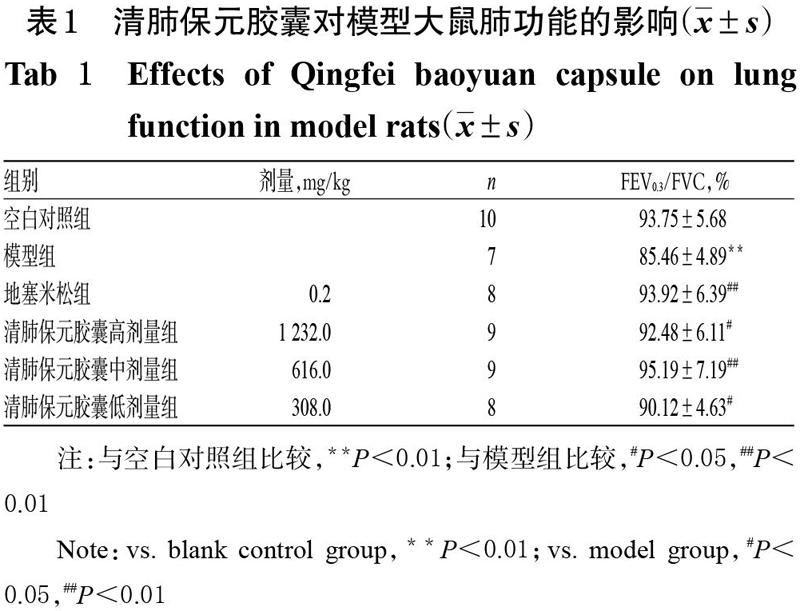
3.1 清肺保元胶囊对模型大鼠肺功能的影响
因造模损伤,除空白对照组外,其余各组均有动物死亡,其中模型组、地塞米松组和清肺保元胶囊高、中、低剂量组分别死亡3、2、1、1、2只,药物组动物死亡较模型组少。
与空白对照组比较,模型组大鼠FEV0.3/FVC显著降低(P<0.01);与模型组比较,各给药组大鼠FEV0.3/FVC均显著升高(P<0.05或P<0.01),详见表1。
3.2 清肺保元胶囊对模型大鼠肺组织病理改变的影响
空白对照组大鼠肺泡腔内未见炎性渗出物,肺泡腔结构正常、无病理性扩大;模型组大鼠肺泡壁增厚、过度膨胀,肺泡数目减少,可见大量炎性细胞浸润,部分可见肺泡融合;地塞米松组和清肺保元胶囊高、中剂量组大鼠肺泡结构基本恢复正常;清肺保元胶囊低剂量组大鼠肺组织可见少量炎性细胞浸润,详见图1。
3.3 清肺保元胶囊对模型大鼠支气管肺泡灌洗液中IL-1β含量和白细胞计数的影响
与空白对照组比较,模型组大鼠支气管肺泡灌洗液中IL-1β含量和白细胞计数均显著升高(P<0.01);与模型组比较,各给药组大鼠支气管肺泡灌洗液中上述指标均显著降低(P<0.05或P<0.01),详见表2。
3.4 清肺保元胶囊对模型大鼠肺组织中NLRP3、Cleaved caspase-1蛋白表达的影响
与空白对照组比较,模型组大鼠肺组织中NLRP3、Cleaved caspase-1蛋白的相对表达量均显著升高(P<0.01);与模型组比较,地塞米松组和清肺保元胶囊中、高剂量组大鼠肺组织中NLRP3蛋白以及地塞米松组和清肺保元胶囊高剂量组大鼠肺组织中Cleaved caspase-1蛋白的相对表达量均显著降低(P<0.05或P<0.01),详见图2、表3。
4 讨论
COPD属于临床常见的慢性炎症性疾病,长期暴露在烟雾环境下是导致其发病的主要原因[9]。本研究将大鼠长期放置于香烟烟雾环境中,并于其气管内滴注脂多糖以制备COPD模型,结果发现模型大鼠肺泡壁增厚,支气管管腔局部变形、上皮细胞脱落,支气管内分泌物增多、可见明显的炎性细胞浸润,且肺泡壁毛细血管及小静脉扩张充盈,显示肺组织存在瘀血、局部存在水肿,提示模型制备后大鼠支气管和肺组织均发生病理性损伤。通过肺功能检测发现,模型组大鼠FEV0.3/FVC显著降低,提示其气道阻力增加,存在气流受限和肺通气功能障碍,即肺功能降低,符合COPD模型的基本特征[9,11],表明造模成功。经清肺保元胶囊干预治疗后,各剂量组大鼠肺组织病理损伤均不同程度地改善,FEV0.3/FVC均显著升高,提示清肺保元胶囊具有改善COPD模型大鼠肺组织病理损伤和肺功能的作用。
越来越多的研究表明,NLRP3炎症小体与一系列慢性炎症性疾病有关[12-14]。炎症小体又叫炎性小体,是由胞浆内模式识别受体参与组装的多蛋白复合物,是天然免疫系统的重要组成部分。炎症小体能识别病原相关分子模式或者宿主来源的危险信号分子,招募和激活促炎症蛋白酶Caspase-1,活化的Caspase-1可切割IL-1β、IL-18前体,从而分泌IL-1β和IL-18;此外,炎症小体的活化还能够诱导细胞的炎症坏死[15]。已发现的炎症小体一般均含有凋亡相关微粒蛋白(ASC)、Caspase家族以及1种NOD样受体(NLR)家族蛋白(如NLRP1)或HIN200家族蛋白(如AIM2)[16-17]。其中,NLRP3炎症小体可通过与ASC、Cleaved caspase-1组成高分子蛋白复合体,进而诱导IL-1β、IL-18、IL-33等相关炎症因子的成熟、释放,从而引起炎症反应,参与疾病的发生与发展,其中IL-1β是该信号通路中研究较多的细胞因子之一[18-19]。基于此,本研究将IL-1β、NLRP3、Cleaved caspase-1作为考察指标。结果显示,COPD模型大鼠支气管肺泡灌洗液中IL-1β含量显著升高,白细胞计数显著增多,表现出了明显的气道炎症反应;同时,其肺组织中NLRP3、Cleaved caspase-1蛋白的相对表达量均显著升高,可见大鼠NLPR3通路相关蛋白表达异常,提示COPD的发生机制可能是因为NLRP3和Cleaved caspase-1的激活诱导了IL-1β的成熟与释放,从而引起COPD气道炎症的发生。经清肺保元胶囊干预治疗后,各剂量组大鼠支气管肺泡灌洗液中IL-1β含量、白细胞计数均显著降低,肺组织中NLRP3(低剂量组除外)、Cleaved caspase-1蛋白(低、中剂量组除外)的相对表达量均显著减少,提示清肺保元胶囊具有抑制COPD模型大鼠气道炎症的作用,其作用机制与下调NLRP3信号通路有关。
综上所述,清肺保元胶囊可减轻COPD模型大鼠的肺组织病理损伤、改善其肺功能,这种作用可能与抑制NLRP3信号通路进而抑制炎症反应有关。然而,COPD的发生机制较复杂,本文仅初步研究了清肺保元膠囊对NLRP3信号通路的调控作用,该药是否还能通过其他途径发挥作用目前尚不清楚,还有待后续深入探究。
参考文献
[ 1 ] PRESS VG,CIFU AS,WHITE SR. Screening for chronic obstructive pulmonary disease[J]. JAMA,2017,318(17):1702-1703.
[ 2 ] BARNES PJ. Chronic obstructive pulmonary disease[J]. N Engl J Med,2000,343(4):269-280.
[ 3 ] EAPEN MS,MYERS S,WALTERS EH,et al. Airway inflammation in chronic obstructive pulmonary disease (COPD):a true paradox[J]. Expert Rev Respir Med,2017,11(10):827-839.
[ 4 ] COLARUSSO C,TERLIZZI M,MOLINO A,et al. Role of the inflammasome in chronic obstructive pulmonary disease (COPD)[J]. Oncotarget,2017,8(47):81813- 81824.
[ 5 ] ZOU Y,CHEN X,LIU J,et al. Serum IL-1β and IL-17 levels in patients with COPD:associations with clinical parameters[J]. Int J Chron Obstruct Pulmon Dis,2017. DOI:10.2147/COPD.S131877.
[ 6 ] 吴俣,刘良丽.清肺保元汤对AECOPD患者SAA水平及临床症状、体征的影响[J].亚太传统医药,2018,14(12):188-189.
[ 7 ] 吴俣,刘良丽.清肺保元胶囊治疗慢性阻塞性肺疾病急性加重期患者临床观察[J].贵阳中医学院学报,2017,39(4):43-46.
[ 8 ] 杜孟娇,钟艳梅,邓善滨,等.盐酸班布特罗改善慢性阻塞性肺疾病模型大鼠的作用机制研究[J].中国药房,2020,31(5):564-570.
[ 9 ] 王玮,王琦,张永生,等.香烟联合脂多糖建立慢性阻塞性肺疾病大鼠模型[J].中华中医药杂志,2018,33(9):3866-3871.
[10] 李配,邓秀兰,刘娟,等.健脾益肺化痰方对慢性阻塞性肺疾病模型大鼠肺功能及血气的影响[J].吉林中医药,2015,35(12):1260-1263.
[11] 周勇,余洋,程文涛,等.虎杖苷对慢性阻塞性肺疾病大鼠气道炎症及 TLR4/NF-κB 信号通路的影响[J].中药药理与临床,2019,35(2):35-40.
[12] MART?NEZ GJ,CELERMAJER DS,PATEL S. The NLRP3 inflammasome and the emerging role of colchicine to inhibit atherosclerosis-associated inflammation[J]. Atherosclerosis,2018. DOI:10.1016/j.atherosclerosis.2017. 12.027.
[13] YU G,BAI Z,CHEN Z,et al. The NLRP3 inflammasome is a potential target of ozone therapy aiming to ease chro- nic renal inflammation in chronic kidney disease[J]. Int Immunopharmacol,2017. DOI:10.1016/j.intimp.2016.12. 022.
[14] 罗亚岚,许才明,李兆霞,等. NLRP3炎性小体:急性肺损伤的发病核心[J].中国急救医学,2019,39(3):285-289.
[15] DAVIS BK,WEN H,TING JPY. The inflammasome NLRs in immunity,inflammation,and associated disea- ses[J]. Anna Rev Immunol,2011. DOI:10.1146/annurev-immunol-031210-101405.
[16] 韩浩贤,王虹艳,董昕. NLRP3炎症小体的研究现状[J].现代医药卫生,2015,31(19):2934-2936.
[17] 潘徐彪,李向玉,王志鑫,等. NLRP3-(Caspase-1)/IL-1β信号通路的研究进展[J].中国医药导报,2019,16(1):41-44.
[18] 何子凡,高岩,王晓玲,等. NLRP3炎性小体在慢性阻塞性肺疾病患者机体炎症反应中作用的研究[J].中国呼吸与危重监护杂志,2018,17(2):119-123.
[19] 刘一鹏,欧宗兴,陈忠仁,等. NLRP3炎性小体对慢性阻塞性肺疾病大鼠肺功能及炎性因子分泌的影响[J].厦门大学学报(自然科学版),2019,58(4):526-531.
(收稿日期:2020-08-08 修回日期:2020-11-30)
(编辑:张元媛)
