橙花破布木染色体制片及核型分析
2021-03-02陈意兰廖海民王峥峰黄向旭刘东明
陈意兰 廖海民 王峥峰 黄向旭 刘东明*
(1. 中国科学院华南植物园,中国科学院南海生态环境工程创新研究院,广州 510650;2. 贵州大学生命科学学院/农业生物工程研究院,山地植物资源保护与保护种质创新教育部重点实验室,山地生态与农业生物工程协同创新中心,贵阳 550025)
橙花破布木(Cordia subcordata)属紫草科(Boraginaceae)破布木属(CordiaL.)植物,乔木或灌木。破布木属在全世界有250~300 种,分布在美洲、非洲、亚洲和大洋洲的热带和亚热带地区[1],我国只有6 个种,分别为越南破布木(C.cochinchinensis)、台湾破布木(C. cumingiana)、破布木(C.dichotoma)、二叉破布木(C. furcans)、毛叶破布木(C.myxa)和橙花破布木(C.subcordata),分布在西南、华南及中国台湾等地,尤以海南岛分布最为普遍[2]。Chromosome Counts Database(CCDB)共报道了全世界35 种破布木属植物的染色体数目为2n=16、18、28、30、32、36、48、50、70、80和104条,均为二倍体植物。其中,破布木的染色体数目为2n=48、50,毛叶破布木的染色体数目为2n=48,其余3种我国有分布的破布木属植物染色体数目未见报道。所有报道过染色体数目的破布木属植物的核型均未见报道。
橙花破布木被列为热带珊瑚岛植被恢复的良好工具种和园林绿化特色种之一[3],其根系发达,对土壤适应能力强,对高温、强光、干旱、贫瘠具有较强的适应能力[4],又具有很强的抗风能力,适合种植在海岛砂质土上绿化环境。此外,橙花破布木全年开花,花序为聚伞花序或圆锥花序,有浅绿色的花萼和橙色的花冠,花色艳丽,树冠宽大而密集,可种植为观赏树和遮荫树[5]。国内外关于橙花破布木的研究大多集中在花粉的形态结构[6~7]、提取物的药用活性[8]、引种栽培[9]、生物学特性[4]等方面,核型分析仍处于空白,遗传背景尚不清楚。
染色体是遗传信息的载体,对染色体的数目、形态、“解剖学”特征和分子特征进行定性、定量的分析称为核型分析[10]。遗传物质在细胞层面上的表型特征反映在核型上,能揭示物种在染色体层面上的所有特性,为研究物种起源、演化、亲缘关系、遗传进化等提供极其重要的细胞学依据[11]。染色体制片技术是核型分析的前提,在染色体制片环节中,取材和预处理至关重要。为了解橙花破布木的遗传信息,本试验以橙花破布木根尖为材料,着重对取材和预处理两个步骤进行探索,选取30个以上染色体分散较好的中期细胞确定染色体数目,并对5 个染色体形态清晰、浓缩程度一致的细胞进行核型分析,以期为破布木属植物染色体制片技术及核型分析提供参考,为橙花破布木基因进行染色体定位等细胞遗传学及表观遗传学研究奠定基础。
1 材料与方法
1.1 材料与试剂
材料:根尖来源于从南海诸岛采摘的橙花破布木种子萌发的胚根或种子萌发生长一年的幼苗白嫩根。
试剂:饱和对二氯苯、0.002 mol·L-18-羟基喹啉、1 mol·L-1HCl、无水乙醇、冰乙酸、卡宝品红染色液。
1.2 仪器与设备
仪器:玻璃棒、烧杯、量筒、镊子、解剖针、刀片、胶头滴管、载玻片、盖玻片、滤纸。
设备:RCQ-360N 人工气候箱、BCD-258WTPZM(E)冰箱、精科HH.S21-N18B 恒温水浴锅、B×43生物显微镜。
1.3 试验方法
1.3.1 染色体制片
取材:用剪刀将橙花破布木干果果皮及硬核夹开剥出种子萌发,待胚根长出后取材或将一年生苗木从种植袋中拔出,用镊子截取白嫩根1cm左右放入预处理液中预处理。取完材料后将幼苗放回袋中种植,日常浇水养护,以便下次取材。取材时间为8:00~11:00和14:00~16:00两个时间段。每次取材时间均根据上一次细胞分裂情况进行调整。
预处理:预处理试剂分别为饱和对二氯苯和0.002 mol·L-18-羟基喹啉。预处理时间均设置3个,分别为饱和对二氯苯预处理1.5 h、2 h、3 h,0.002 mol·L-1、8-羟基喹啉预处理2 h、3 h、4 h。其目的是比较两种预处理试剂对橙花破布木染色体制片效果的影响,比较同种试剂不同预处理时间对橙花破布木染色体制片效果的影响。
固定:固定液为卡诺I(无水乙醇∶冰乙酸=3∶1),冰水混合物中固定30 min。
解离:1 mol·L-1HCl 60℃水浴锅中解离3~4 min。解离前先将HCl预热。
染色:卡宝品红染色液染色大于2 h。
以上环节中,每个处理前均用清水将根尖上的残留液清洗掉,固定完成后可将材料转入70%酒精中保存,但保存时间不宜过长。
压片:将染色好的根尖置于载玻片上,用解剖针刮取少量根尖,加一滴染液,盖上盖玻片压片。若染色时间过长,染色体着色过深,可用45%乙酸压片。
拍照:将玻片置于光学显微镜下进行观察,选取染色体分散良好的细胞进行拍照。
1.3.2 核型分析
根据李懋学和陈瑞阳[12]提出的标准,以30 个细胞以上,其中85%以上的细胞具恒定一致的染色体数,即可认为是该植物的染色体数目,选取5个分散良好、染色体纵向收缩程度均匀一致、缢痕区显示清晰的染色体中期细胞用Photoshop 图像进行核型分析。染色体形态依据Levan 等[13]的方法归类,核型对称性按Stebbins[14]的标准划分。
2 结果与分析
2.1 染色体制片
2.1.1 取材时间对染色体制片效果的影响
结果(见表1,图1)显示,9:30 以前取材的根尖细胞大部分处于有丝分裂间期、前期和前中期,该时间段的细胞分裂不旺盛,染色体呈点状(见图1A)、丝状(见图1B)或开始缩短变粗缠绕在一起(见图1C)。10:30 和14:30 以后取材的根尖细胞大部分处于有丝分裂后期、末期,此时间段的染色体着丝粒分开,染色体向两极移动(见图1E)或已经移动到了两极(见图1F)。9:30~10:00 和14:00~14:30为最佳取材时间,这两个时间段的根尖细胞分裂旺盛,中期细胞多,染色体分散,形态数目清晰(见图1D)。
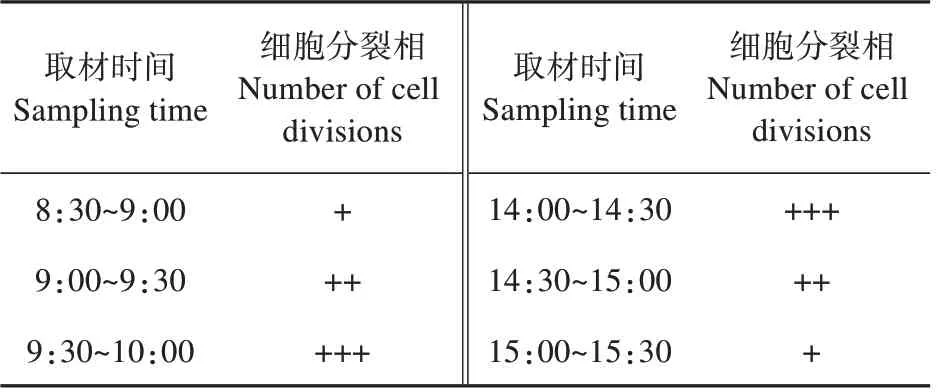
表1 取材时间对染色体制片效果的影响Table 1 Effects of different radicle lengths on chromosome preparation during sampling
2.1.2 预处理试剂及时间对染色体制片效果的影响
结果(见表2,图2)表明,饱和对二氯苯和0.002 mol·L-18-羟基喹啉两种预处理试剂及预处理时间对橙花破布木染色体的分散效果、浓缩程度、清晰度均有一定的影响。预处理时间过长,染色体浓缩严重(见图2:A3),预处理时间不足,染色体粘连不分散(见图2:A1,B1)。饱和对二氯苯和0.002 mol·L-18-羟基喹啉相比,饱和对二氯苯预处理效果较好,染色体浓缩较快,形态结构较清晰(见图2:A2)。0.002 mol·L-18-羟基喹啉预处理效果不佳,预处理3 h、4 h,染色体形态仍然不清晰(见图2:B2~3)。

表2 不同预处理试剂对染色体制片效果的影响Table 2 Effects of different pretreatment reagents on chromosome preparation
2.2 核型分析
通过对橙花破布木中期分裂相的细胞进行观察统计,橙花破布木染色体数目为32,共16 对染色体,为二倍体植物。核型公式为2n=2X=32=32m,全部为中部着丝粒染色体(m),未见随体。染色体组绝对长度变异范围为0.38~0.69 μm,相对长度(%)变化范围为4.48~8.24,相对长度组成为2n=2L+14M1+14M2+2S。最长染色体与最短染色体之比为1.84,臂比变化范围为1.22~1.53,最长染色体与最短染色体之比小于2,臂比小于2,核型属于“1A”型。核型不对称系数(As.K%)为58.40%。染色体形态及核型见图3,核型模式见图4,染色体核型参数见表3。
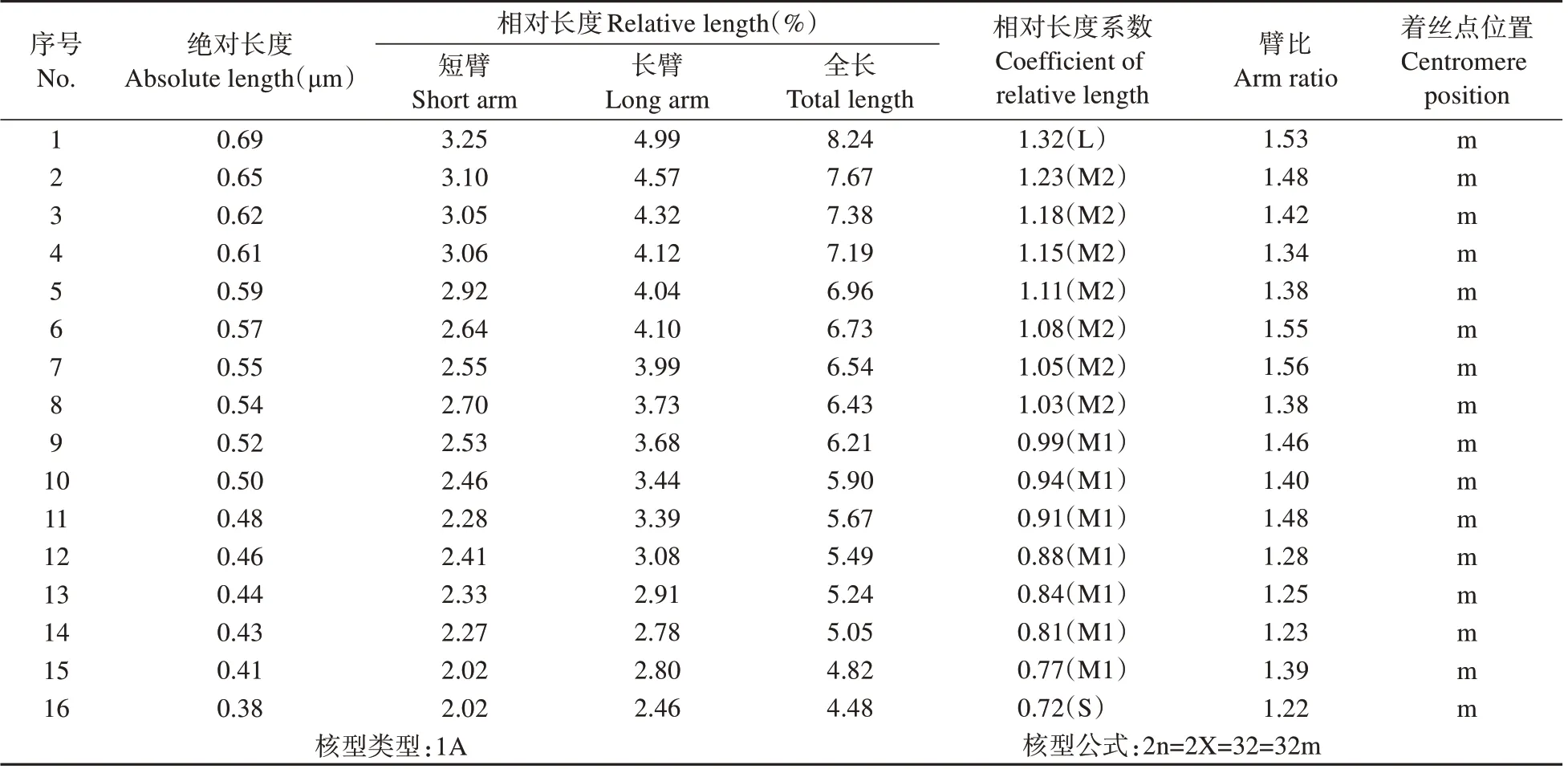
表3 橙花破布木染色体核型参数Table 3 Chromosome karyotype parameters of C.subcordata
3 讨论
取材是染色体制片的基础,预处理是染色体制片的关键。取材时间决定细胞分裂程度以及中期细胞数量,预处理试剂及时间决定染色体的分散效果、浓缩程度以及清晰度。雷文英[15]等在白刺花染色体压片技术优化研究中设置8:00 以前、8:00~9:00、9:00~10:00 共3 个时间段取材,结果表明白刺花最佳取材时间为9:00~10:00。何倚涟[16]等在北柴胡根尖染色体制片技术研究中设置取材时间为8:00~18:00,每1 h 为1 个时间段取材,结果表明北柴胡最佳取材时间为9:00~10:00和16:00~17:00两个时间段。本研究中,8:30~9:00取材,大量细胞还处于间期(见图1A)、前期(见图1B)和前中期(见图1C),15:00~15:30取材,大量细胞处于后期(见图1E)、末期(见图1F),说明8:30~9:00取材时间较早,应往后推迟取材时间,15:00~15:30 取材时间较晚,应提前取材。于是分别将8:30~9:00 和15:00~15:30 两个时间段推迟和提前30 min,然后根据细胞分裂程度及分裂状态又将取材时间分别推迟和提前30 min,最终得出9:30~10:00 和14:00~14:30 为橙花破布木染色体制片最佳取材时间。这两个时间段取材的细胞分裂旺盛,中期细胞多,染色体分散,形态数目清晰(见图1D)。常用的预处理试剂有秋水仙素、饱和对二氯苯和8-羟基喹啉,3种预处理试剂药性最强的是秋水仙素,对具有大型染色体的植物根尖的预处理效果最好[17],其次是饱和对二氯苯,最弱的是8-羟基喹啉,这两种试剂常用于具有中小型染色体的植物根尖预处理,离体处理的效果比较好[18]。橙花破布木染色体较小,应选择药性较温和的预处理试剂。本实验中,饱和对二氯苯和0.002 mol·L-18-羟基喹啉相比,饱和对二氯苯预处理2 h 效果较好,染色体浓缩较快,形态结构较清晰(见图2:A2)。
核型分析可以反映染色体的短臂、长臂、缢痕、随体等特征,主要从核型公式、核型分类、核型不对称系数几个方面体现。核型公式、核型不对称系数、核型类型分别反映染色体组的结构组成、染色体组臂比的变化以及染色体组内各臂比值的比例。核型公式越简单、核型不对称系数越小、各臂比值比例越均等物种进化越原始,反之越进化[19]。本研究首次对橙花破布木的染色体数目及核型进行报道。研究表明,橙花破布木染色体较小,共32 条(见图3),与报道过的Cordia dentata、Cordia boissieri、Cordia angiocarpa、Cordia leucosebestera、Cordia sebestena染色体数目一致[20~22]。核型公式为2n=2X=32=32m,全部为中部着丝粒染色体,未见随体。核型属于“1A”型,核型不对称系数(As.K%)为58.40%。因此,橙花破布木染色体组的结构组成比较简单,臂比值比例比较均等,核型不对称系数较小,对称性较强,说明其进化趋势比较原始。本研究结果可为破布木属植物染色体制片技术及核型分析提供参考,为橙花破布木基因进行染色体定位等细胞遗传学及表观遗传学研究奠定基础。
