miR-155在血管紧张素II诱导的肾小管上皮-间充质转化中的作用及其机制
2021-03-02石哲玮刘胜新秦铖璠章柳萍钱彩珍
石哲玮,刘胜新,秦铖璠,章柳萍,钱彩珍
1.温州医科大学附属诸暨医院 心血管内科,浙江 绍兴 311800;2.温州医科大学 第二临床医学院,浙江 温州 325035;3.诸暨市中医医院 心血管内科,浙江 绍兴 311800
高血压肾病初期主要表现为肾小管稀释功能减退,随着疾病的不断进展,大量正常的肾单位受到破坏,引起肾脏弥漫性纤维化以及慢性肾功能不全,最终引起肾脏硬化萎缩[1]。上皮-间充质转化(epithelial-mesenchymal transition,EMT)是导致高血压肾病患者肾小管浓缩和稀释功能下降的重要原因之一,同时也是诱导肾脏纤维化的重要病理过程[2]。血管紧张素II(angiotensin II,Ang II)是肾素-血管紧张素-醛固酮系统中重要的血管活性成分,是促进肾小管上皮细胞EMT改变以及肾脏纤维化进程的关键调节因子[3]。给予体外培养的NRK-52E肾小管上皮细胞适宜浓度的Ang II处理可促进肾小管上皮细胞形态学以及EMT相关蛋白表达水平改变[4]。因此,本研究通过给予体外培养的NRK-52E肾小管上皮细胞Ang II处理诱导肾小管上皮细胞EMT过程,从而构建高血压肾病细胞模型。
miRNA是短的单链RNA序列,在生物系统中广泛表达,其主要作用为调控基因在多种生理和发育过程中的表达[5]。既往研究表明miR-155在多种心血管相关疾病中发挥重要的调节作用。WANG等[6]的研究表明,下调miR-155表达可以保护C57BL/6小鼠免受脂多糖感染引起的心脏功能障碍并减少心肌细胞凋亡。ZHANG等[7]的研究表明,miR-155可以减少氧化修饰低密度脂蛋白诱导的巨噬细胞凋亡,从而延缓动脉粥样硬化的形成。ZHANG等[8]的研究结果表明,miR-155可作为改善高糖诱导的心脏纤维化的治疗靶点。本研究进一步观察miR-155在调控肾小管上皮细胞EMT过程中的作用并探究其可能的信号转导机制,从而为延缓高血压病诱导的肾脏纤维化以及寻找新的高血压肾病治疗靶点提供思路。
1 材料和方法
1.1 材料
1.1.1 细胞:NRK-52E肾小管上皮细胞购自中国科学院上海细胞所,用含有10%胎牛血清的DMEM高糖培养液培养并置于37 ℃、5% CO2、饱和湿度的细胞培养箱中。定期更换细胞培养液,当细胞密度达到70%~80%时,进行传代。
1.1.2 实验材料和仪器:Ang II购自北京索莱宝科技有限公司;SC79购自美国MedChemExpress公司;DMEM高糖培养基、胎牛血清购自美国Gibco公司;Collagen I、N-cadherin、α-SMA、TGF-β和GAPDH抗体购自美国Abcam公司;BCA蛋白定量试剂盒、CCK8和RIPA细胞裂解液购自上海碧云天生物技术有限公司;ECL超敏发光液购自美国Thermo Fisher公司;反转录试剂盒购自上海东洋纺生物科技有限公司;Mastercycler X50荧光定量PCR仪购于德国 Eppendorf公司;ChemiDoc XRS+System曝光仪购 于美国Bio-Rad公司;BX63 荧光显微镜购于日本Olympus公司。
1.2 方法
1.2.1 模型构建及细胞分组:体外培养NRK-52E肾小管上皮细胞,以每孔5 000个细胞的浓度接种到96孔板中。用10-4、10-5、10-6、10-7、10-8、10-9和10-10mol/L浓度的Ang II处理NRK-52E肾小管上皮细胞48 h,选取最宜浓度进行后续实验。
将细胞分为对照组、Ang II组、NC miRNA处理 组、miR-155 inhibitor处理组、溶剂对照组和蛋白激酶B(AKT)激动剂处理组。对照组NRK-52E肾小管上皮细胞给予单纯更换培养基处理;Ang II组给予10-7mol/L的Ang II处理48 h诱导EMT过程;NC miRNA处理组和miR-155 inhibitor处理组在给予NC miRNA和miR-155 inhibitor预处理6 h后予10-7mol/L的Ang II处理48 h。溶剂对照组在miR-155 inhibitor预处理6 h后,给予含10-7mol/L的Ang II和4 μL/mL DMSO的完全培养基处理48 h。AKT激动剂处理组在miR-155 inhibitor预处理6 h后,给予含10-7mol/L的Ang II和4 μg/mL AKT激动剂SC79的完全培养基处理48 h。
1.2.2 CCK8实验测定细胞增殖活性:将CCK8染料加入96孔板内并孵育3 h,通过检测490 nm处的吸光度来评估存活的细胞数。共重复3次,评估各组细胞增殖能力。
1.2.3 qPCR检测细胞内miR-155表达水平:给予NRK-52E细胞不同处理后,提取细胞内总RNA并测定浓度及纯度,按反转录试剂盒说明书中的操作步骤合成cDNA,通过Eppendorf MAS荧光定量PCR分析系统进行检测,以U6为内参照,miR-155的相对含量以2-ΔΔCt表示,引物序列见表1。

表1 引物序列
1.2.4 Western blot检测细胞内蛋白表达:给予NRK-52E细胞不同处理后,吸去上清液。加入蛋白裂解液,刮取贴壁细胞并吸入离心管中,离心后取上清液并测定总蛋白含量,经凝胶电泳分离和转膜,5%脱脂奶粉室温封闭2 h,TBST洗膜3遍后分别加一抗GAPDH(1:5 000)、Collagen I(1:1 000)、 N-cadherin(1:1 000)、α-SMA(1:1 000)、TGF-β(1:1 000)、p-AKT(1:1 000)和AKT(1:1 000),4 ℃孵育过夜,二抗室温孵育2 h,洗膜3次后用ECL试剂显影曝光。Collagen I、N-cadherin、α-SMA和TGF-β以GAPDH蛋白条带作为参照,p-AKT以AKT蛋白条带作为参照,通过Bio-Rad凝胶成像系统扫描,ImageLab图像软件定量分析每个条带灰度值。
1.2.5 免疫荧光染色检测Collagen I表达:给予NRK-52E细胞不同处理后,弃去原培养液,用PBS洗涤3次,在4 ℃环境中用4%多聚甲醛固定15 min。PBS洗涤3次后,用0.3% TritonX-100溶液破膜15 min。 再用PBS洗涤3次后,用5%牛血清白蛋白封闭1 h,滴加Collagen I(1:100)一抗稀释液后4 ℃过夜。第2天取出孵育盒,用PBS洗涤3次后,给予荧光二抗孵育1 h,再用PBS洗涤3次。最后用DAPI染核10 min 并滴加荧光猝灭剂后荧光显微镜下观察荧光染色结果并拍照。
1.3 统计学处理方法 用SPSS22.0统计软件进行分析。数据采用±s表示,多组间比较采用单因素方差分析,组间两两比较用LSD检验。P<0.05为差异有统计学意义。
2 结果
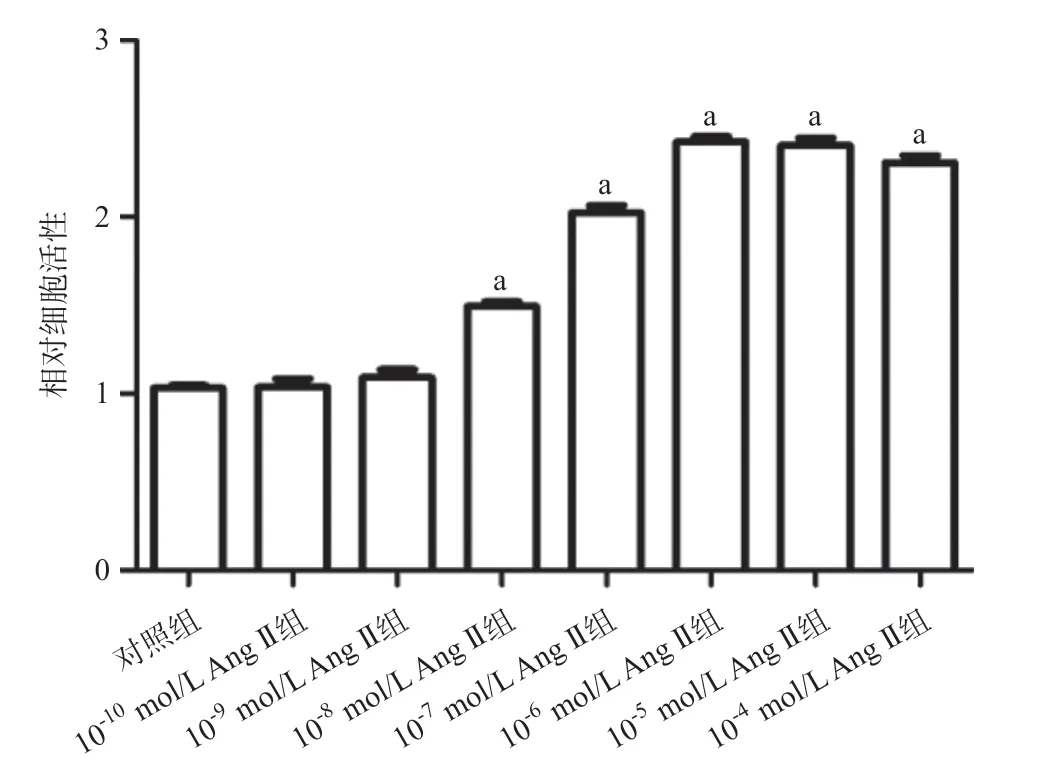
图1 不同浓度Ang II对各组NRK-52E肾小管上皮细胞增殖能力的影响

图2 不同浓度Ang II对NRK-52E肾小管上皮细胞内EMT相关蛋白表达水平的影响
2.1 Ang II上调NRK-52E细胞增殖能力以及细胞内EMT相关蛋白表达水平 与对照组相比,给予NRK-52E细胞>10-8mol/L浓度的Ang II处理可以显著上调细胞增殖能力(P<0.05),且随着Ang II浓度的增加,NRK-52E细胞增殖能力逐渐增强,见图1。由图2可知,与对照组相比,给予NRK-52E细胞>10-8mol/L 的Ang II处理可以显著上调细胞内EMT相关蛋白α-SMA、Collagen I、N-cadherin和TGF-β蛋白表达水平(P<0.05),且随着Ang II浓度的增加,蛋白表达水平逐渐增加。以上研究结果表明给予10-7mol/L Ang II处理时NRK-52E细胞增殖能力以及细胞内EMT相关蛋白表达水平已显著上调,且该刺激浓度较其他刺激浓度更为经济实惠,因此,本课题组通过给予NRK-52E细胞10-7mol/L Ang II处理构建高血压肾病细胞模型。
2.2 Ang II可上调NRK-52E细胞内miR-155表达水平 与对照组相比,给予NRK-52E细胞不同浓度的Ang II处理可以显著上调细胞内miR-155表达水平 (P<0.05),且随着Ang II浓度的增加,细胞内miR-155表达水平逐渐增加,见图3。
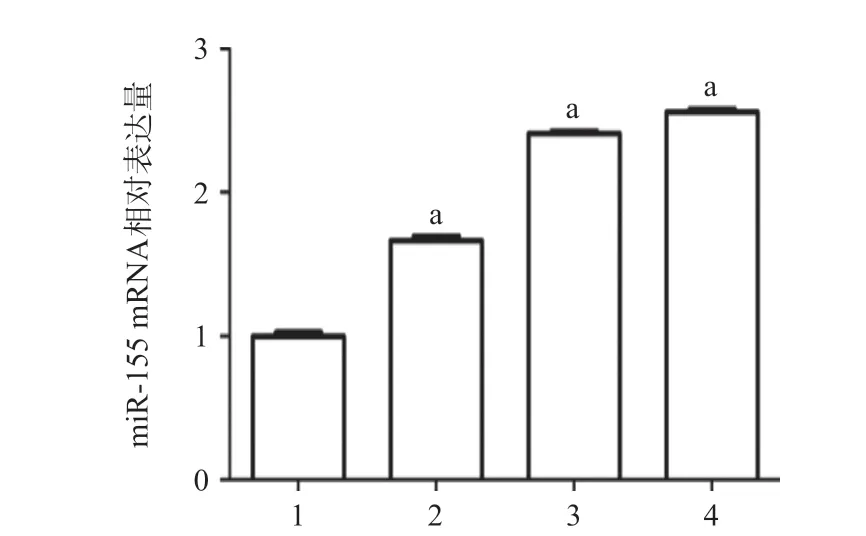
图3 不同浓度Ang II对NRK-52E肾小管上皮细胞内miR-155表达水平的影响
2.3 下调miR-155表达可以抑制NRK-52E细胞内EMT相关蛋白表达水平 与对照组相比,Ang II组NRK-52E细胞内α-SMA、Collagen I、N-cadherin蛋白以及miR-155表达水平均显著增加(均P<0.05);与Ang II组相比,NC miRNA处理组NRK-52细胞内α-SMA、Collagen I、N-cadherin蛋白以及miR-155表达水平差异无统计学意义(P>0.05);与Ang II组相比,miR-155 inhibitor处理组NRK-52E细胞内α-SMA、Collagen I、N-cadherin蛋白以及miR-155表达水平均显著降低(均P<0.05),见图4。
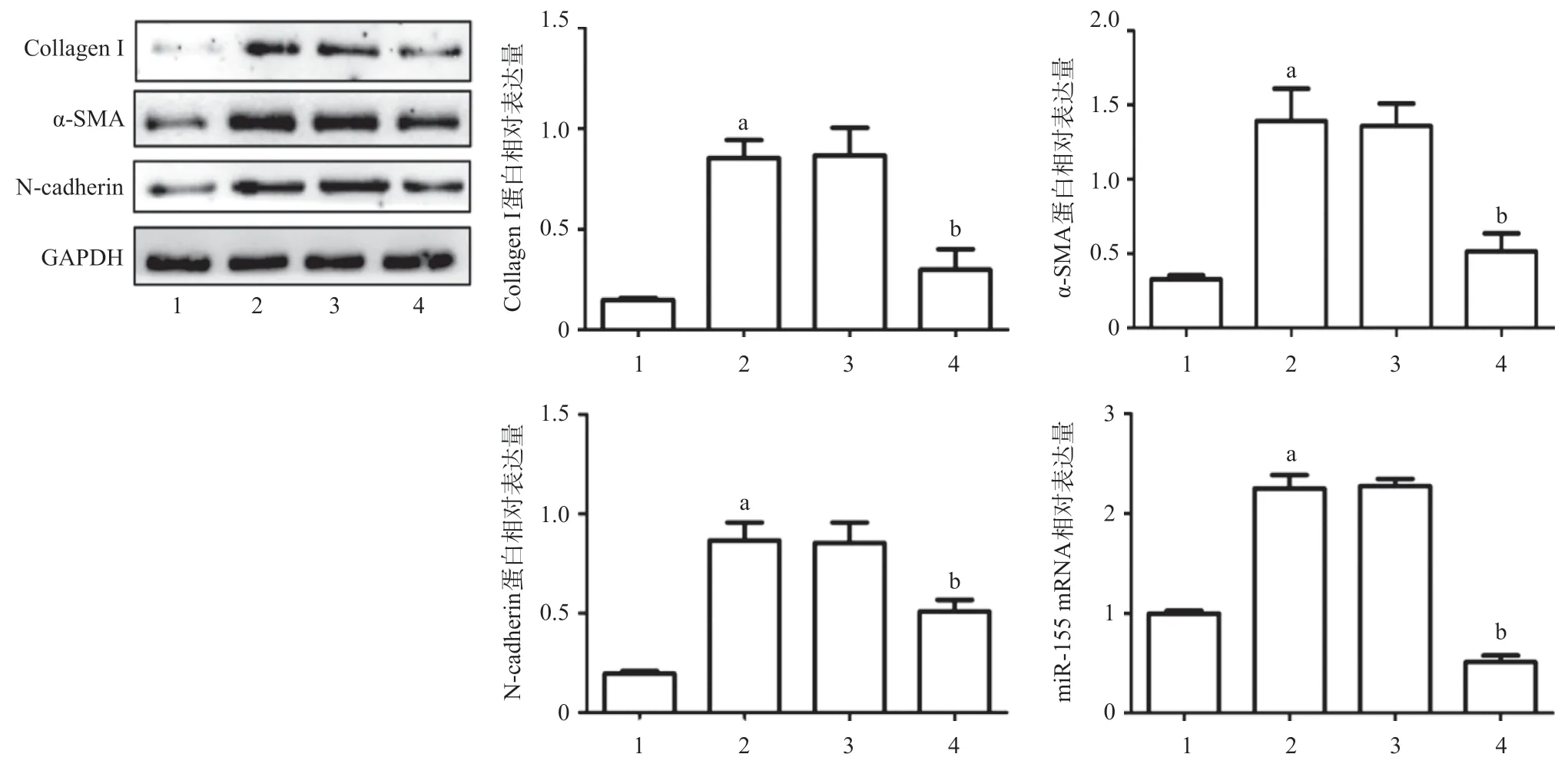
图4 下调miR-155表达对NRK-52E肾小管上皮细胞内EMT相关蛋白表达水平的影响
2.4 下调miR-155表达可以抑制NRK-52E细胞内AKT蛋白磷酸化水平 与对照组相比,Ang II组NRK-52E细胞内AKT蛋白磷酸化水平显著增加(P<0.05);与Ang II组相比,NC miRNA处理组NRK-52E细胞内AKT蛋白磷酸化水平差异无统计学意义(P>0.05);与Ang II组相比,miR-155 inhibitor处理组NRK-52E细胞内AKT蛋白磷酸化水平显著降低(P<0.05),见图5。
2.5 上调AKT蛋白磷酸化水平可下调miR-155 inhibitor对NRK-52E细胞EMT过程的抑制作用 与miR-155 inhibitor处理组相比,溶剂对照组NRK-52E细胞内α-SMA、Collagen I、N-cadherin、AKT蛋白表达水平差异无统计学意义(P>0.05),AKT激动剂处理组NRK-52E细胞内α-SMA、Collagen I、Ncadherin蛋白表达以及AKT蛋白磷酸化水平显著增加(均P<0.05),见图6。
3 讨论

图5 下调miR-155表达对NRK-52E肾小管上皮细胞内AKT蛋白磷酸化水平的影响

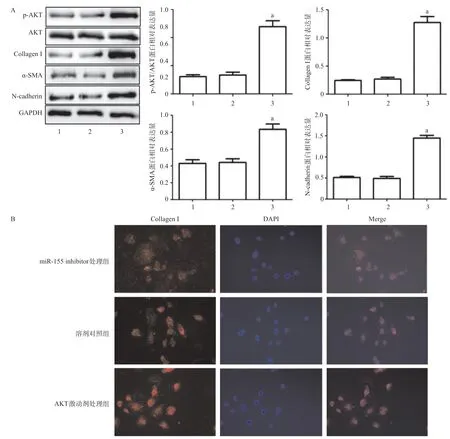
图6 上调AKT同时抑制miR-155表达对NRK-52E肾小管上皮细胞内EMT相关蛋白表达水平的影响
高血压是指以体循环动脉血压增高为主要表现,同时可伴有心脏、脑和肾脏等全身器官功能性或器质性损害的临床综合征[9]。原发性高血压患者的体循环动脉血压增高会引起肾小管功能损伤,导致肾小管浓缩以及稀释功能下降,最终导致肾脏功能衰竭。
Ang II为强效血管收缩剂,在高血压的病理生理过程中起着重要的调节作用。当Ang II与血管紧张素受体结合后可激活促纤维化细胞因子表达改变,导致上皮细胞内α-SMA、胶原蛋白等表达增多,进而诱导肾脏纤维化[5]。本研究给予NRK-52E细胞Ang II处理诱导其EMT过程,结果发现在给予肾小管上皮细胞不同浓度的Ang II处理后,细胞上清液的吸光度值随着浓度的增加而增加,且细胞内TGF-β、Collagen I、α-SMA、N-cadherin蛋白表达水平显著上调,表明Ang II具有促进细胞增殖以及上调细胞内EMT相关蛋白表达水平的作用。
既往研究表明,TGF-β可通过调控miR-155下调肿瘤蛋白P53诱导性核蛋白1(tumor protein p53-inducible nuclear protein 1,TP53INP1)蛋白表达水平从而促进肝癌细胞EMT过程[10];TGF-β还可在上调miR-155表达的同时下调c-Ski蛋白表达从而诱导人冠状动脉内皮细胞EMT过程[11];miR-155也可在增强肝癌细胞侵袭和转移能力的同时诱导肝癌细胞EMT过程[12]。本研究结果表明,Ang II可促进NRK-52E细胞内miR-155表达水平的上调,且在抑制NRK-52E细胞内miR-155表达水平后,Ang II对细胞内EMT相关蛋白表达水平的促进作用受到显著抑制,提示Ang II可通过上调miR-155表达水平促进肾小管上皮细胞EMT过程,进而诱导肾脏纤维化的发生。
AKT是一种在葡萄糖代谢、细胞凋亡、增殖及细胞迁移等过程中起到重要作用的丝氨酸/苏氨酸特异性蛋白激酶。既往研究表明,AKT通路参与了Ang II诱导的肾小管上皮细胞EMT过程[4],而miR-155可通过PTEN-PI3K/AKT通路调控细胞增殖和迁移能 力[13]。本研究结果表明,下调细胞内miR-155表达 水平可显著抑制NRK-52E细胞内AKT蛋白磷酸化水平,且在下调miR-155表达的同时上调AKT蛋白磷酸化水平,可恢复miR-155对细胞内EMT相关蛋白表达水平的上调作用,提示miR-155可通过上调AKT蛋白磷酸化水平诱导肾小管上皮细胞向着间充质细胞转变。
综上所述,本研究探讨了miR-155在Ang II诱导的肾小管上皮细胞EMT过程中的调控作用及其可能的信号转导机制,发现miR-155可通过调控AKT信号通路促进肾小管上皮细胞EMT进程,进而诱导肾脏纤维化的发生。
