高效液相色谱-荧光检测法测定红肉及其加工肉中唾液酸含量
2021-03-01陈宝英李克峰
赵 非,陈宝英,李克峰,王 旭,,*
(1.天津科技大学 省部共建食品营养与安全国家重点实验室,天津 300457;2.天津桑尼匹克生物科技有限公司,天津 300457)
唾液酸是一类9碳单糖的羧酸盐。它们在生理上起着多种重要作用,包括分子间的相互作用、神经元的外生长和记忆形成、细胞的增殖分化与癌变以及病毒细菌的感染[1-7]。唾液酸的主要代表形式为N-乙酰神经氨酸(N-acetylneuraminic acid,Neu5Ac),是一种酰化(C5氨基处)化合物。另一种常见的形式为N-羟乙酰神经氨酸(N-glycolylneuraminic acid,Neu5Gc),由C5处氨基与羟乙酰基结合形成(结构见图1)。唾液酸通常作为糖缀合物的末端残基被发现,很少以游离形式出现[8-10]。
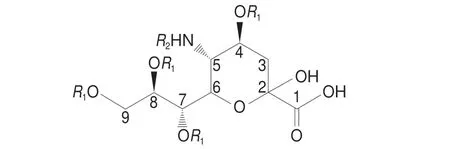
图1 唾液酸结构Fig.1 Structure of sialic acids
近年来,大量流行病学显示,红肉的长期摄入是一种潜在的癌症危险因素[11-12]。有研究[13]表明Neu5Gc作为红肉中的一种特殊成分与癌症的发生有关。人类在进化过程中合成Neu5Gc的关键酶CMAH的基因发生缺失突变,健康人体内不能合成Neu5Gc。但是在人体组织和体液中仍然会发现微量Neu5Gc的存在[14-15],这是由于通过食物摄入的结合态Neu5Gc具有生物可利用性,它可以经过体内代谢结合到人体组织中[13,16]。Neu5Gc作为外来抗原与抗Neu5Gc抗体的相互作用可能会引发炎症从而增加患癌机率,这也是研究者普遍认为的一个推测[17]。
比色法已用于测定动物组织的唾液酸含量,但此方法缺乏特异性,只能够测定总唾液酸含量[18-19]。近年来,气相色谱法[20]、基质辅助激光解吸电离-质谱法[21]和安培法[22]被应用于唾液酸的分析。但是,目前最常用方法是基于柱前衍生化的高效液相色谱法[10]。特别是4,5-亚甲二氧基-1,2-邻苯二胺盐(4,5-methylenedioxy-1,2-phenylenediamine dihydrochloride,DMB),作为一种具有高选择性和少干扰的衍生化试剂已被广泛用于液相色谱-质谱联用或液相色谱-荧光法分析唾液酸[23-24]。对于样品制备,酸水解是释放非游离形式唾液酸最常用的方法,通常使用70~90 ℃的温和酸性条件[25-26]。本研究借助超声辅助对前处理和衍生化条件进行优化,拟建立一种快速测定Neu5Ac和Neu5Gc的高效液相色谱-荧光检测(high performance liquid chromatography-fluorescence detector,HPLC-FLD)法,对红肉及其加工制品中的游离和结合形式的Neu5Ac和Neu5Gc含量进行检测。
1 材料与方法
1.1 材料与试剂
红肉(牛肉、猪肉、羊肉)、加工肉(火腿)市售;Neu5Gc、Neu5Ac标准品 美国Sigma公司;DMB 阿拉丁试剂(上海)有限公司;盐酸、乙酸(均为分析纯) 天津市风船化学试剂科技有限公司;氢氧化钠(分析纯) 博欧特(天津)化工贸易有限公司;连二亚硫酸钠、2-巯基乙醇(均为分析纯) 上海阿达玛斯试剂有限公司;乙腈(色谱级) 美国Fisher公司;所有用水均为超纯水。
1.2 仪器与设备
1260型液相色谱仪(配有荧光、示差、紫外检测器)美国Agilent公司;Hypersil GOLD C18(250 mmh 4.6 mm,5 μm)色谱柱、真空冷冻干燥仪、振荡恒温金属浴 赛默飞世尔科技(中国)有限公司。
1.3 方法
1.3.1 色谱条件
色谱柱:Thermo Hypersil GOLD C18(250 mmh 4.6 mm,5 µm);柱温30 ℃;荧光检测器激发波长373 nm,发射波长448 nm;流动相为超纯水(A)-乙腈(B);梯度洗脱程序:0~7 min,90%~80% A、10%~20% B;7~9 min,80%~10% A、20%~90% B;9 ~1 2 m i n,1 0% A、9 0% B;1 2 ~1 2.1 m i n,10%~90% A、90%~10% B;12.1~17 min,90% A、10% B;流速1.0 mL/min;进样体积10 μL。
1.3.2 衍生化反应
1.3.2.1 Neu5Ac和Neu5Gc标准品溶液配制
精密称量10.00 mg的Neu5Ac和Neu5Gc标准品,分别用超纯水溶解并定容到10 mL,得质量浓度为1.00 mg/mL的Neu5Ac和Neu5Gc储备液,置于-20 ℃冰箱中贮存备用。实验中使用的不同质量浓度标准品溶液均由标准品储备液稀释。
1.3.2.2 衍生化试剂溶液
精确称量29.25 mg DMB衍生化物质和24.37 mg连二亚硫酸钠置于10 mL棕色容量瓶中,加入528 μL 2-巯基乙醇和859 μL乙酸后用超纯水定容至10 mL。得13 mmol/L DMB、1.5 mol/L乙酸、14 mmol/L连二亚硫酸钠、0.75 mol/L 2-巯基乙醇的溶液。
1.3.2.3 衍生化条件
取100 μL样品或者某一质量浓度的标准品与100 μL衍生化试剂溶液混匀,避光、50 ℃混匀振荡动态衍生化120 min,转速450 r/min。冰水浴冷却至室温,经0.22 μm滤膜过滤进行色谱分析。
1.3.3 样品前处理
1.3.3.1 游离态Neu5Gc和Neu5Ac提取
准确称取1 g样品,加入10 mL超纯水匀浆后超声10 min,在13 000 r/min离心10 min,收集上清液。
1.3.3.2 结合态Neu5Gc和Neu5Ac含量
准确称取1 g样品,加入10 mL超纯水进行匀浆,冻干,研磨成粉末。取样品粉末于离心管中,加入0.1 mol/L的氢氧化钠溶液2 mL,37 ℃水浴30 min,达到脱乙酰的目的。继续加入8 mL 0.1 mol/L盐酸溶液,80 ℃超声(功率为180 W)辅助酸解30 min,冰水浴冷却至室温。停止反应后13 000 r/min离心10 min,收集上清液进行衍生化反应并分析。最终测得值减去游离态Neu5Gc和Neu5Ac含量即为结合态Neu5Gc和Neu5Ac含量。
1.4 数据处理
实验数据均采用Excel以及Origin软件作图并进行数据统计分析。
2 结果与分析
2.1 衍生化条件的优化
2.1.1 衍生化试剂用量
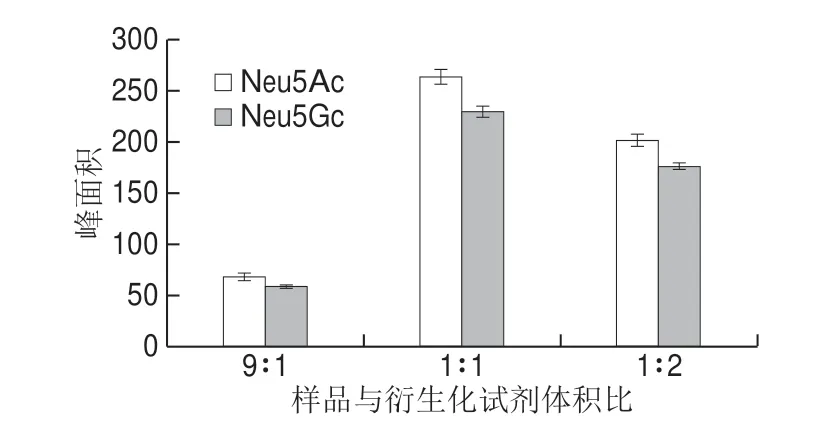
图2 衍生化试剂用量的优化Fig.2 Optimization of sample to derivatization reagent ratio
在8 mmol/L的DMB浓度下对衍生化试剂用量进行优化[27-28]。取100 μL 1 μg/mL的Neu5Ac和Neu5Gc混合标准品溶液分别在标准品溶液与衍生化试剂体积比9∶1、1∶1、1∶2三个用量下衍生化并进行色谱分析。由图2可见,当在混合标准品溶液与衍生化试剂用量体积比为1∶1时,所测物质的峰面积最高,故选用样品与衍生化试剂比1∶1作为最优的衍生化试剂用量。
2.1.2 衍生化试剂浓度
选取4、8、13 mmol/L三个浓度进行DMB衍生化试剂浓度的优化[13,29-30]。如图3所示,在4~13 mmol/L浓度范围内,随着DMB试剂浓度的增大,峰面积具有明显上升的趋势,即选用13 mmol/L作为衍生化试剂的最优浓度。
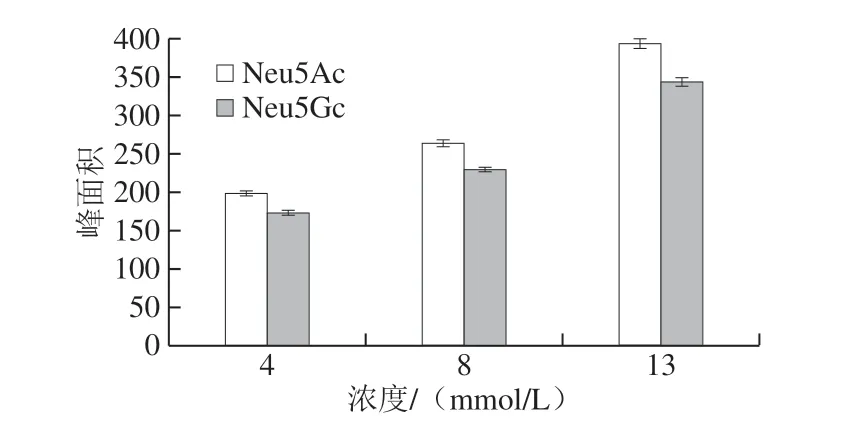
图3 衍生化试剂浓度的优化Fig.3 Optimization of derivatization reagent concentration
2.1.3 衍生化时间
将100 μL 1 μg/mL的Neu5Gc和Neu5Ac混合标准品溶液加入100 μL 13 mmol/L的DMB衍生化试剂,涡旋混匀。避光、50 ℃条件下分别水浴80、100、120、150、180 min。冰水浴冷却至室温,过膜进行色谱分析。如图4所示,80~120 min产物浓度随时间延长而上升,120~180 min产物浓度变化率减小。因此,选择120 min作为DMB最佳衍生化时间。
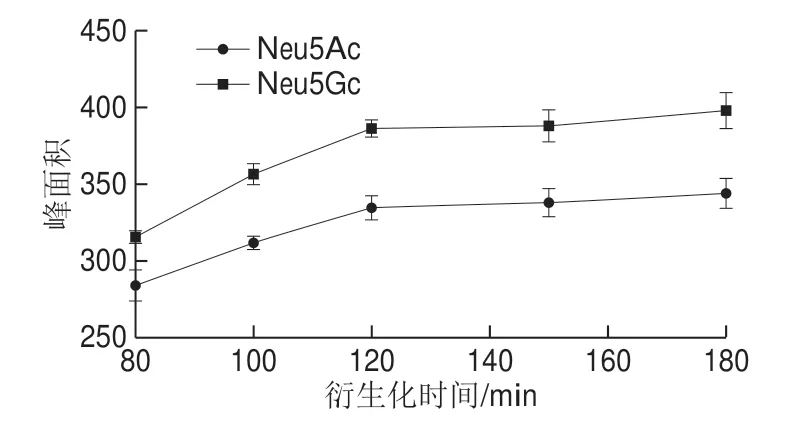
图4 衍生化时间的优化Fig.4 Optimization of derivatization time
2.2 样品酸解条件的优化
2.2.1 酸解试剂的选择
对比0.1 mol/L盐酸80 ℃酸解1 h和2 mol/L乙酸80 ℃酸解3 h两个样品酸解条件[31-32],结果(图5)表明0.1 mol/L盐酸酸解耗时短且酸解更完全,故选择0.1 mol/L盐酸作为酸解试剂。
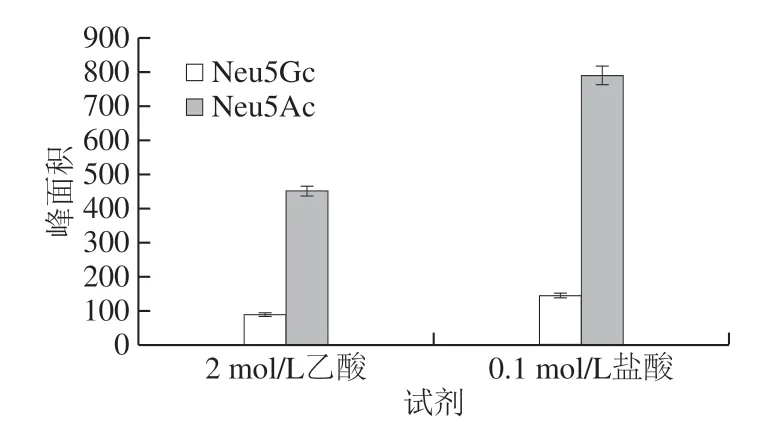
图5 酸解试剂的选择Fig.5 Selection of the optimal acid hydrolysis reagent
2.2.2 超声辅助酸解时间的优化
样品依次进行匀浆冻干、脱乙酰并加入酸解试剂,在功率为180 W的超声辅助下,80 ℃分别酸解10、20、30、40、50 min,冰水浴至室温后13 000 r/min离心10 min。取100 μL上清液按1.3.2节进行衍生化并进行色谱分析。结果(图6)表明在10~30 min的超声时间内,Neu5Ac和Neu5Gc的峰面积逐渐增加,当超声时间到达30 min后,峰面积趋于平稳,无明显增加。同时,超声30 min已基本达到常规水浴1 h的酸解效果,故选用30 min作为超声辅助酸解时间。
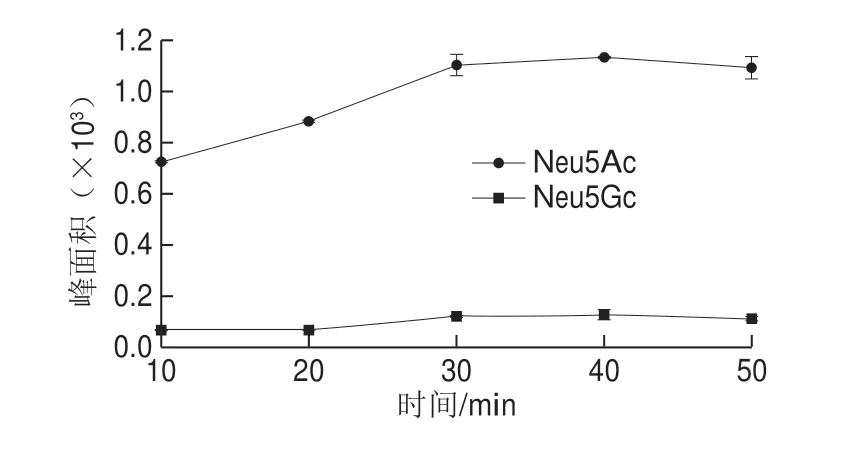
图6 超声辅助酸解时间的优化Fig.6 Optimization of ultrasound-assisted acidification time
2.3 方法学验证
2.3.1 线性关系及检出限实验结果
将Neu5Ac和Neu5Gc标准品储备液分别逐级稀释到0.1、0.5、1、5、10 μg/mL。按照1.3.2节方法进行衍生化,以3 次峰面积的平均值作为纵坐标,标准品质量浓度作为横坐标,绘制标准曲线。Neu5Ac标准曲线y=335.20x+12.275,R²=0.999 9;Neu5Gc标准曲线y=283.28x+1.042 9,R²=0.999 7。Neu5Ac和Neu5Gc在0.1~10 μg/mL质量浓度范围内线性关系良好。将标准品溶液继续进行倍数稀释,衍生化并进行测定,直至被测标准品质量浓度所对应信噪比为3。Neu5Ac和Neu5Gc检出限分别为0.003 μg/mL和0.01 μg/mL。
2.3.2 精密度实验结果
选取1 μg/mL混合标准品溶液,按1.3.2节方法进行衍生,重复进样6 次,计算相对标准偏差(relative standard deviation,RSD)。Neu5Ac和Neu5Gc两种物质的RSD分别为1.4%和1.2%,该方法精密度良好。
2.3.3 重复性实验结果
取一定体积的Neu5Ac和Neu5Gc储备液稀释至0.1、1 μg/mL和10 μg/mL,每个质量浓度配制3 个样本。如表1所示,Neu5Ac和Neu5Gc峰面积的RSD在0.7%~1.8%范围内,该方法具有良好的重复性。

表1 重复性实验(n=3)Table 1 Repeatability of the method (n= 3)
2.3.4 稳定性实验结果
同一份1 μg/mL混合标准品溶液,衍生后分别于第0、1、2、3、4、6、8小时测定Neu5Ac和Neu5Gc的峰面积,结果表明,Neu5Ac和Neu5Gc在3 h内稳定。
2.3.5 回收率实验结果
取3 份红肉,分别加入一定量高、中、低3 个不同质量浓度的Neu5Ac和Neu5Gc标准品溶液,测定Neu5Ac和Neu5Gc总量,回收率见表2。Neu5Ac和Neu5Gc回收率分别在104.7%~119.7%和91.2%~95.8%范围内,表明样品处理过程中待测物质具有较少损失,该方法回收率良好。
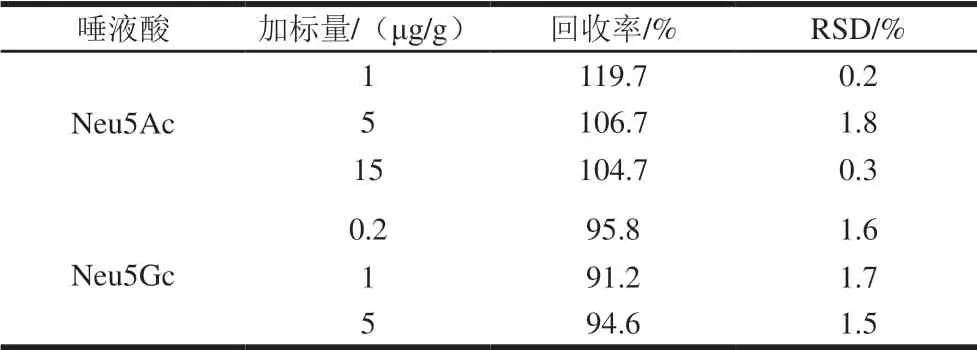
表2 回收率实验Table 2 Recoveries of Neu5Ac and Neu5Gc from spiked samples
2.4 红肉及其加工肉中的Neu5Gc和Neu5Ac含量测定结果
按照1.3.2节和1.3.3节对样品进行处理后进行检测,样品和混合标准品图谱见图7,按外标法计算样品含量。结果表明,不同红肉中的Neu5Gc和Neu5Ac含量存在差异,见表3。其中,加工肉(火腿)中的结合态Neu5Gc和Neu5Ac含量均最高,分别为(11.23f 2.73)mg/kg和(71.29f 3.32)mg/kg。生鲜红肉中羊肉的Neu5Ac含量最高,为(51.38f 10.38)mg/kg。本实验测试结果与文献报道数据基本一致[13,32],相关差异可能源于红肉部位、来源等方面的不同。
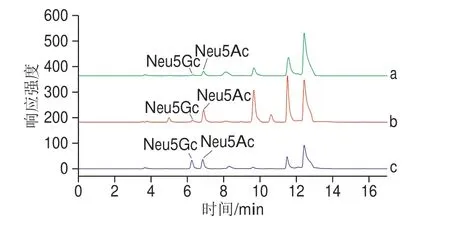
图7 样品和标准品图谱Fig.7 Chromatograms of mixed standards and samples

表3 红肉及加工肉中Neu5Gc和Neu5Ac的含量Table 3 Contents of Neu5Gc and Neu5Ac in red meat and processed meat products mg/kg
3 结 论
本研究利用单因素试验对DMB试剂浓度、用量和衍生化时间进行优化,并借助超声辅助方法对样品前处理进行优化,建立了一种耗时短、效率高的HPLC-FLD方法。较常规水浴、超声辅助的方法显著缩短了样品前处理时间,从而提高了检测效率。本方法Neu5Ac和Neu5Gc检出限分别为0.003 mg/kg和0.01 mg/kg,可满足含有较低唾液酸含量的样品检测。同时,本实验准确测定了红肉及加工肉中的游离态和结合态Neu5Ac和Neu5Gc的含量,对更好地理解红肉中Neu5Gc和癌症之间的关系及日常饮食摄入红肉的种类选择和摄入量具有一定的参考价值。
