间接竞争化学发光酶联免疫分析方法检测禽肉中金刚烷胺和氯霉素残留
2021-03-01许小炫苏晓娜钟翠丽曾道平徐振林杨金易
许小炫,苏晓娜,谭 庶,钟翠丽,曾道平,张 燕,徐振林,王 序,杨金易,*
(1.华南农业大学食品学院,广东 广州 510642;2.温氏食品集团股份有限公司,广东 云浮 527400;3.广东产品质量监督检验研究院,广东 佛山 528300)
金刚烷胺(amantadine,AMA)是用于治疗流感疾病的抗病毒药物,农业部2005年第560号公告规定禁止AMA类药物在养殖业的使用,然而2012年“速生鸡”事件反映了养禽业仍存在AMA滥用的问题[1]。研究表明,动物饲养中AMA的滥用问题增强了流感病毒的耐药性,而且对人体会产生神经毒性等毒副作用[2-4]。氯霉素(chloramphenicol,CAP)是一种广谱抗生素,我国农业部已将CAP从2000年版《中国兽药典》删除并列为禁药,但自“CAP风波”以来,CAP的滥用问题层出不穷[5]。CAP残留不仅会使大部分细菌对其产生耐药性,还可能导致骨髓造血机能絮乱、粒细胞/血小板减少、再生障碍性贫血等毒副作用[6]。目前实施的动物性食品中AMA残留量测定方法的检测限为1 μg/kg,2004年欧盟委员会已将CAP的检测底限降低为0.1 μg/kg[7]。
当前报道的检测禽肉样品中AMA和CAP残留的方法主要有仪器分析法[8-9]、微生物测定法[10-11]、免疫分析法[12-13]。仪器分析法主要包括高效液相色谱法[14-15]和气相色谱法[16-17],准确性高,但有操作复杂、检测时间长、对人员素质要求高、难以满足快速检测等问题。近年来报道的免疫分析法有酶联免疫吸附法[18-19]、化学发光免疫[20-21]、免疫传感器[22]、胶体金试纸条[23-24]、免疫磁珠[25]、免疫芯片[26]等。化学发光酶联免疫分析法(chemiluminescence enzyme-linked immunoassay,CLEIA)是根据酶联免疫分析的基本原理,将高特异性的免疫反应和高灵敏度的化学发光反应相结合以检测抗原或者抗体的免疫技术。目前已有使用CLEIA方法检测动物组织中的AMA和CAP的文献报道[20-21],然而,这些方法的不足之处在于检测目标过于单一,均为独立的前处理过程,无法实现同时处理和分析,不可避免地带来检测效率低下、成本高、浪费时间等问题,更无法满足愈来愈繁重的突发事件和应急监控工作的需要。目前适用于AMA和CAP残留同步检测的免疫分析方法及前处理方法鲜见报道,因此有必要开发出一种能同时提取禽肉样品中AMA和CAP两类药物总量的样品处理技术以及相应的CLEIA检测方法。
目前已报道的提取AMA和CAP的有机溶剂多为乙腈、酸性乙腈、乙酸乙酯和碱性乙酸乙酯[27-28]。AMA在结构上属于有机碱,在酸性溶液中易溶于水,在碱性溶液中易溶于有机溶剂。通过仪器验证证实,AMA和CAP在碱性环境中能被有机溶剂更好地萃取[29-30]。针对AMA和CAP的化学特征,本研究利用实验室前期所得的AMA抗体及抗原、CAP抗体及抗原建立了间接竞争性CLEIA(ic-CLEIA)检测方法,并创新性地使用碳酸钾和乙酸乙酯提取药物的方法将AMA和CAP的样品前处理方法合并,对ic-CLEIA方法进行系统评估,适用于实际样品中AMA和CAP药物的同步检测。本方法旨在使检测结果不仅灵敏度高、准确可靠,而且操作方便、节约时间,可以满足禽肉AMA和CAP药物两种药物的实际检测需求,为后期实现快速联检禽肉样品中多种违禁药物残留检测方法提供技术依据。
1 材料与方法
1.1 材料与试剂
未含AMA及CAP鸡肉、鸭肉、鸽肉 市购。
AMA多克隆抗体(anti-AMA pAb,2.33 mg/mL)、AMA包被原(AMA-BSA,7.43 mg/mL)、CAP单克隆抗体(anti-CAP mAb,3.5 mg/mL)、CAP包被原(CAP-BSA,18 mg/mL)由广东省食品安全重点实验室制备并保存[31-32];AMA、CAP、金刚乙胺、氟苯尼考 国药集团化学试剂有限公司上海分公司;辣根过氧化物酶标记羊抗鼠IgG(1 mg/mL)、辣根过氧化物酶标记羊抗兔IgG(1 mg/mL) 安诺伦生物科技有限公司;96 孔不透明白色发光板 深圳金灿华实业有限公司;ECL化学发光液 GE Healthcare中国公司;所用溶剂和试剂均为分析纯或色谱纯。
1.2 仪器与设备
JZ-II型均质器 莆田市南荣贸易有限公司;超低温高速离心机 美国E p p e n n d o r f 公司;WallacVICTOR31420多功能标记分析仪 美国PE公司;氮吹仪 康宁科技有限公司;QP50质谱仪 日本岛津公司;1200系列液相色谱仪 美国Agilent公司;ZHJH-1122超净工作台 上海新苗医疗器械公司。
1.3 方法
1.3.1 ic-CLEIA的操作步骤
包被:用包被液将包被原稀释至相应的最适浓度,包被96 孔不透明白色发光板,每孔150 μL,4 ℃条件下16 h包被。封闭:经每孔300 μL洗液洗涤2 次后,每孔加入170 μL封闭液,37 ℃封闭4 h,甩干孔中的液体,置于37 ℃烘箱中2 h备用。竞争反应:加入标准品或样品溶液(50 μL/孔),先加入50 μL酶标二抗,再加入50 μL抗体工作液,混匀后25 ℃反应一定时间,洗涤4 次,每孔加入100 μL底物缓冲液和底物液等体积混合后的化学发光反应液,轻拍混匀,盖上盖板膜,2 min后用化学发光免疫分析仪测定每孔的发光值RLU。
1.3.2 ic-CLEIA方法的优化
1.3.2.1 包被原及单克隆抗体的稀释倍数组合
取96 孔化学发光板,用包被液将包被原作一系列稀释,稀释倍数为2 500、5 000、10 000、20 000、30 000、40 000 倍;AMA多克隆抗体按5 000、10 000、15 000、20 000、40 000 倍稀释,而CAP单克隆抗体按20 000、40 000、80 000、120 000、160 000 倍稀释,按照1.3.1节的步骤操作,计算出标准曲线的RLUmax、IC50和RLUmax/IC50,以RLUmax/IC50较高、IC50较低、RLUmax适中时的条件为CLEIA的最佳反应条件。
1.3.2.2 二抗稀释倍数和竞争时间优化
AMA的羊抗兔酶标二抗按2 000、4 000、6 000、8 000 倍和10 000 倍稀释,CAP的羊抗鼠酶标二抗按6 000、8 000、10 000、20 000 倍和30 000 倍稀释,以20、25、30 min和40 min竞争时间反应,按照1.3.1节的步骤操作,以RLUmax/IC50较高、IC50较低、RLUmax适中时的条件为CLEIA的最佳反应条件。
1.3.3 样品前处理
称取空白禽肉样品2 g置于50 mL离心管中,加入6 mL乙酸乙酯和1 mL去离子水,涡旋振荡3 min,加入2 mL碳酸钾溶液,涡旋振荡60 s,4 000 r/min离心5 min,取3 mL上清液于离心管中,于65 ℃氮气或空气吹干,加入2 mL正己烷和1 mL PB溶液,涡旋振荡1 min,4 000 r/min离心1 min,弃去上层正己烷层,取下层溶液进行ic-CLEIA分析(稀释倍数为1)。
1.3.4 添加回收实验
向空白样品中添加AMA和CAP标准品溶液,使其AMA的含量为0.5、1 μg/kg和2 μg/kg,CAP含量为0.05、0.1 μg/kg和0.2 μg/kg,经前处理后用同一批次化学发光板对同批样品进行检测,每个样品设4 个重复,计算批内变异;用不同批次化学发光板对同批样品进行检测,每个样品设4 个重复,计算批间变异。
1.3.5 仪器方法验证
禽肉中AMA残留的仪器方法测定参照DB 21/2394ü 2014《鸡肝和鸡肉中AMA、金刚乙胺的检测 超高效液相色谱串联质谱法》进行,检测限为0.5 μg/kg。禽肉中CAP残留的仪器方法测定参照GB/T 22338ü 2008《动物源性食品中CAP类药物残留量测定》进行,检测限为0.1 μg/kg。
1.4 数据分析
以AMA标准品浓度或CAP标准品浓度的对数值为横坐标(X),以发光值RLU为纵坐标(Y),应用Origin 8.5软件中的四参数拟合竞争标准曲线;根据样品RLU值,由标准曲线查出相应的浓度,乘以稀释倍数,即为样品的实际浓度。使用Origin 8.5软件绘制相关ic-CLEIA图表。数据统计使用SAS 6.12软件计算完成。
2 结果与分析
2.1 CLEIA最优条件的优化
2.1.1 包被原、抗体最适工作浓度的确定
本研究以RLUmax、IC50和RLUmax/IC50作为评价各影响因素的标准,IC50越小,方法的灵敏度更高,RLUmax和RLUmax/IC50的高低决定曲线的线性可用范围宽窄。由图1、2可看出,当包被原稀释倍数为10 000,抗体稀释倍数为15 000时,AMA-CLEIA的IC50较低,RLUmax/IC50较高,因此AMA-CLEIA的包被原和抗体的最适工作质量浓度为743 μg/L和155 μg/L。同理,CAP-CLEIA的包被原和抗体的最适工作质量浓度为3.6 mg/L(稀释倍数5 000)和43.8 μg/L(稀释倍数80 000)。

图1 AMA(a)和CAP(b)包被原稀释倍数的优化Fig.1 Optimization of dilution factor of AMA-BSA (a) and CAP-BSA (b)

图2 AMA(a)和CAP(b)抗体稀释倍数的优化Fig.2 Optimization of dilution factor of anti-AMA (a) and anti-CAP (b) antibody
2.1.2 竞争时间和酶标二抗稀释倍数的确定
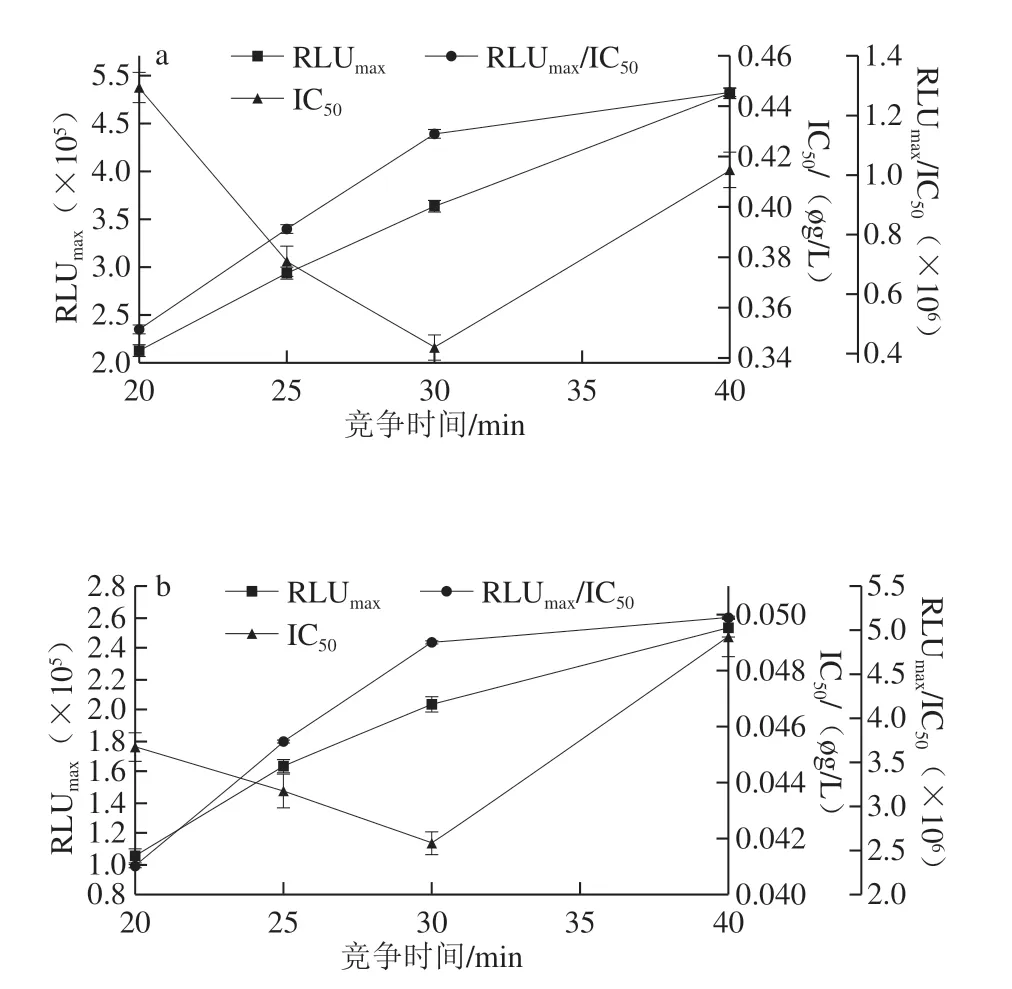
图3 AMA(a)和CAP(b)竞争时间的优化Fig.3 Optimization of competition time for AMA (a) and CAP (b)
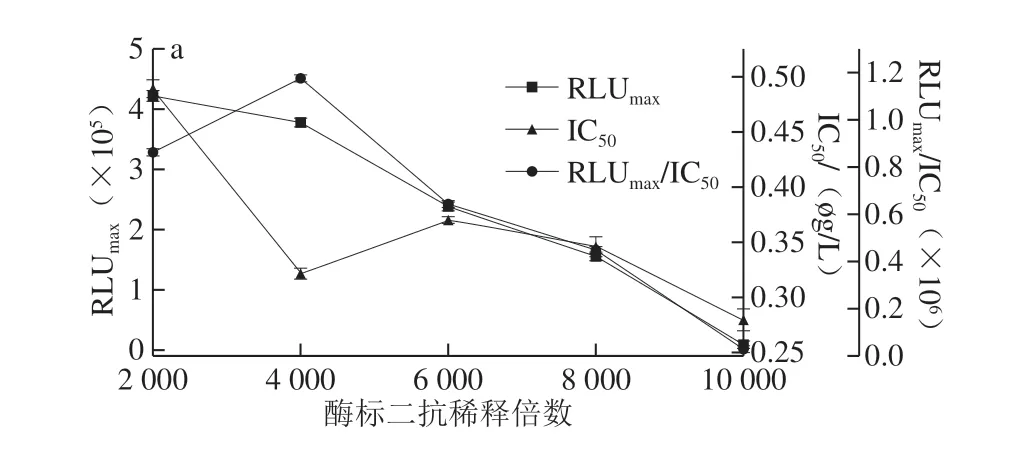
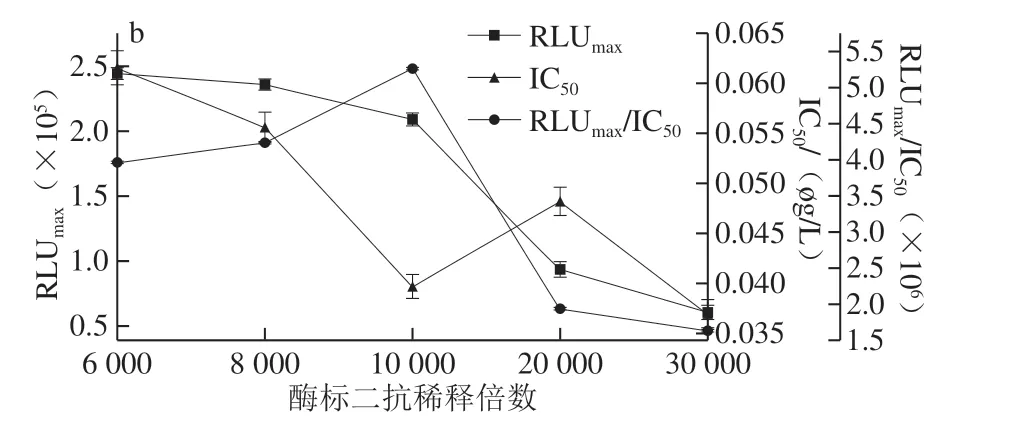
图4 AMA(a)和CAP(b)酶标二抗稀释倍数的优化Fig.4 Optimization of dilution factor of RP-labeled secondary antibody against AMA (a) and CAP (b)
抗原抗体能否充分结合与其反应时间长短有关,所以要对反应时间进行优化。如图3 所示,当竞争时间为30 min时,IC50最小,RLUmax/IC50较大,因此AMA-CLEIA和CAP-CLEIA的最佳竞争反应时间为30 min。如图4可知,AMA-CLEIA和CAP-CLEIA的最佳酶标二抗稀释倍数为4 000和10 000。
2.1.3 标准曲线的建立
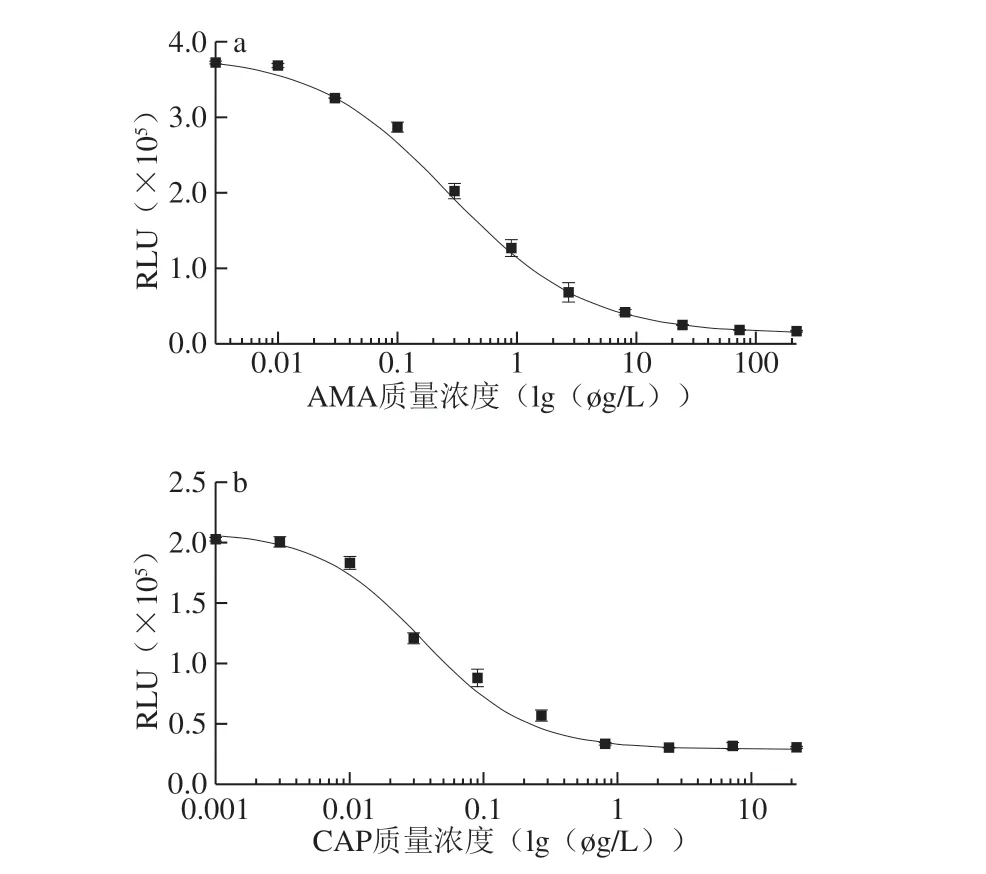
图5 ic-CLEIA检测AMA(a)和CAP(b)的标准曲线Fig.5 Calibration curve for indirect competitive chemiluminescence enzyme linked immunoassay (ic-CLEIA) analysis of AMA (a) and CAP (b)
按照上述CLEIA条件优化结果,以AMA或CAP标准品溶液质量浓度对数为横坐标,RLU值为纵坐标,绘制标准曲线,结果如图5所示。AMA标准曲线的线性范围(IC20~IC80)为0.06~1.77 μg/L,IC50为0.33 μg/L,检出限为0.0 6 μ g/L。C A P 标准曲线的线性范围(IC20~IC80)为0.010~0.179 μg/L,IC50为0.039 μg/L,检出限为0.009 μg/L。
2.2 样品前处理的优化
2.2.1 提取助剂种类和浓度的确定
研究去离子水、氨水、碳酸钠溶液、氢氧化钠溶液和碳酸钾溶液5 种提取助剂的提取效果,结果如图6所示,根据回收率进行比较,提取AMA效果最好的是碳酸钾溶液,其次是氨水和碳酸钠溶液,去离子水和氢氧化钠溶液的提取效果较差。5 种提取助剂提取CAP差异性并不显著,都能取得良好的回收率。最终选择碳酸钾溶液为AMA和CAP的提取助剂。比较了不同浓度的碳酸钾的提取效率,由图7可知,当碳酸钾浓度为1.2 mol/L时,AMA和CAP的添加回收率达到最高,因此确定碳酸钾的最佳浓度为1.2 mol/L。

图6 不同提取助剂的AMA和CAP添加回收结果Fig.6 Effect of extraction solvents on the recovery of AMA and CAP
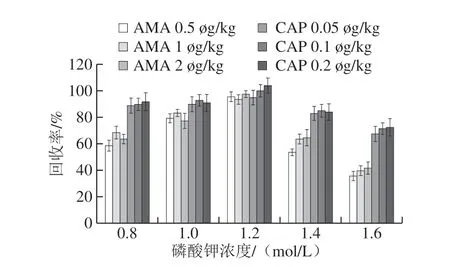
图7 不同浓度碳酸钾的AMA和CAP添加回收结果Fig.7 Evaluation of the concentration of potassium carbonate on the recoveries of AMA and CAP
2.2.2 提取时间的优化
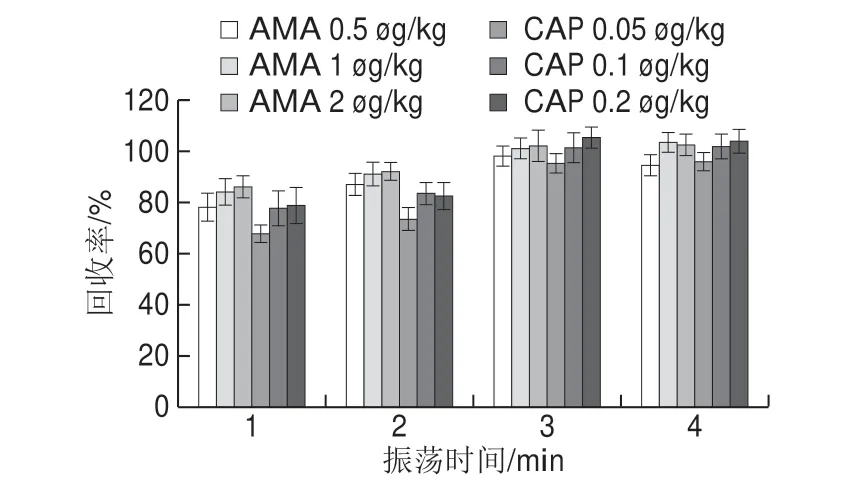
图8 不同振荡时间的AMA和CAP添加回收结果Fig.8 Effect of shaking time on the recoveries of AMA and CAP
本研究的前处理方法中,加入纯水和乙酸乙酯后,比较不同振荡时间的提取效率,结果如图8所示。振荡时间越长,AMA和CAP的回收率越高,当振荡时间为4 min时,2 种药物的回收率与振荡时间3 min无显著差异。因此振荡时间确定为3 min。加入碳酸钾溶液后,比较不同萃取时间的提取效率,结果如图9所示,60 s已经将样品中的CAP和AMA几乎完全提取出,从节约时间和效率方面考虑,最终确定萃取时间为60 s。
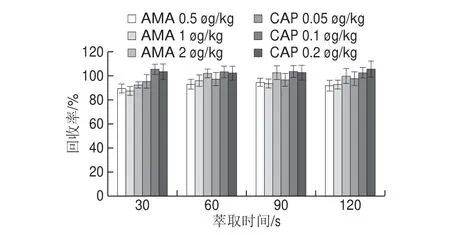
图9 不同萃取时间的AMA和CAP添加回收结果Fig.9 Effect of extraction time on the recoveries of AMA and CAP
2.2.3 样品复溶液的优化
由于药物性质和基质效应的作用,不同缓冲体系和离子强度的复溶液会影响药物的实际样品添加回收率。本实验选择PB缓冲液作为样品复溶液,并比较不同浓度的PB缓冲液下AMA和CAP的回收率,结果如图10所示,随着PB缓冲液的浓度增大,AMA的回收率先增大后趋于平稳,CAP的回收率则越来越高,当缓冲液浓度超过0.05 mol/L时,CAP的回收率超过120%。因此,确定PB缓冲液的最佳浓度为0.05 mol/L。
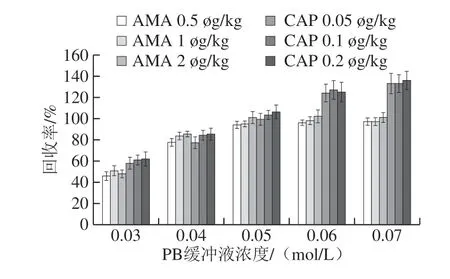
图10 不同浓度PB缓冲液的AMA和CAP添加回收结果Fig.10 Effect of PB buffer concentration on the recoveries of AMA and CAP
2.3 精密度实验结果
CLEIA方法的精密度以批内变异和批间变异表示。每个标准品质量浓度做6 次重复,测得质量浓度的变异系数表示批内变异;取不同批次包被的化学发光板,测得标准曲线的IC50和RLUmax值,连续进行6 d测定,以IC50和RLUmax值的变异系数表示批间变异。结果如表1~3所示,批内变异系数均小于10%,批间变异均小于5.6%,表明实验重复性较好。

表1 AMA批内变异(n=6)Table 1 Intra-assay coefficients of variation of the CLEIA method for AMA (n= 6)

表2 CAP批内变异(n= 6)Table 2 Intra-assay coefficients of variation of the CLEIA method for CAP (n= 6)
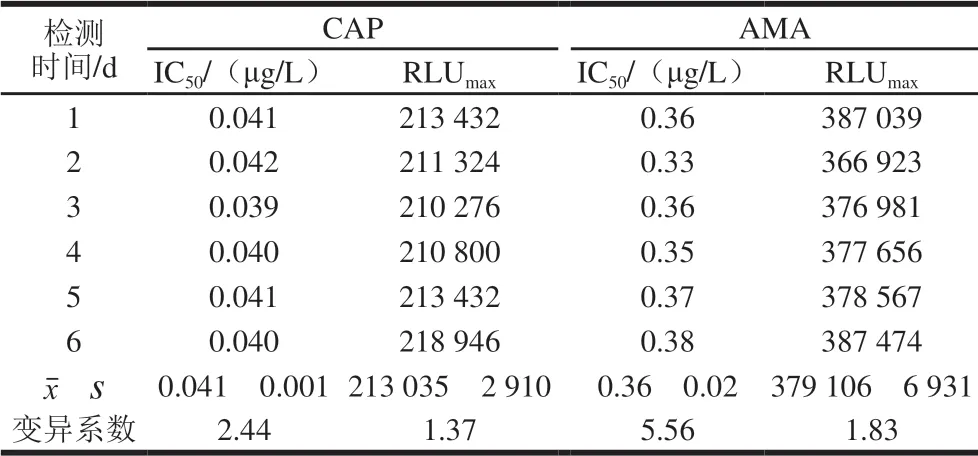
表3 AMA和CAP的批间变异(n=6)Table 3 Inter-assay coefficients of variation of the CLEIA method for AMA and CAP (n= 6)
2.4 特异性实验结果
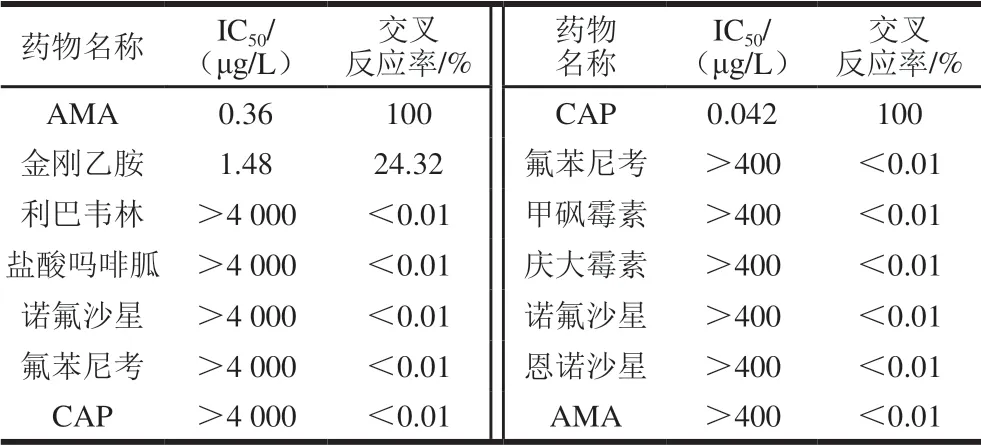
表4 AMA和CAP结构类似物药物交叉反应率Table 4 Cross-reactivityof anti-AMA pAb and anti-CAP pAb determined by ic-CLEIA
由表4所示,除与金刚乙胺存在24.32%的交叉反应率外,AMA与其他结构类似物和功能类似物的交叉反应率均小于0.01%。CAP与其他结构功能类似物均不存在明显交叉反应。表明CLEIA方法特异性良好,不易出现假阳性,错检等现象。
2.5 空白样品添加实验结果
选取高中低3 个添加量水平进行样品添加回收实验,结果如表5所示。其中所测样品中AMA的平均添加回收率在92.55%~105.14%之间,CAP平均添加回收率在92.00%~112.50%之间,且两者批内和批间变异系数小于10.48%。方法准确度能达到检测要求,适用于禽肉样品中AMA和CAP的检测。
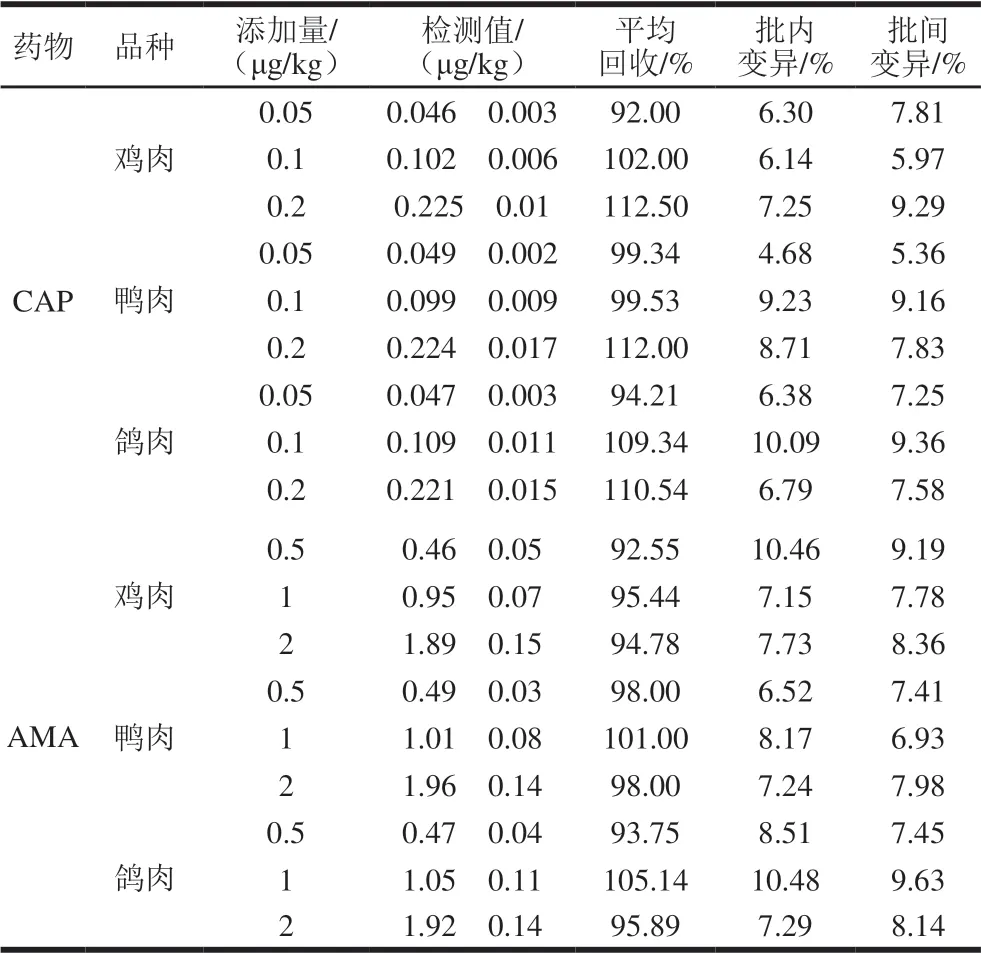
表5 AMA和CAP的实际样品添加回收率和变异系数(n=4)Table 5 Recoveries and coefficients of variation (CVs) of AMA and CAP spiked into poultry muscles (n= 4)
2.6 仪器方法对比

图11 AMA(a)和CAP(b)ic-CLEIA与LC-MS方法对比Fig.11 Good linear correlation between ic-CLEIA and LC-MS values for AMA (a) and CAP (b)
随机购买100 份家禽样品,其中鸡肉60 份、鸭肉30 份、鸽肉10 份,均质化后放入-20 ℃保存。按照建立的ic-CLEIA方法检测所有样品中的AMA和CAP,以DB 21/2394ü 2014的检测限(0.5 μg/kg)作为AMA阴阳性判定值,其中检出8 份样品为AMA阳性,92 份样品为AMA阴性;以GB/T 22338ü 2008的检测限(0.1 μg/kg)作为CAP阴阳性判定值,其中检出5 份样品为CAP阳性,95 份样品为CAP阴性,将可疑样品和9 份阴性样品分别再用ic-CLEIA方法和高效液相色谱-质谱(high performance liquid chromatography-mass spectrometry,HPLC-MS)方法检测,进行统计学分析比较测定结果。以HPLC-MS所测得的AMA或CAP的浓度为Y轴,以ic-CLEIA测得的AMA或CAP的浓度为X轴,绘制散点图。如图11所示,AMA的回归方程为Y=1.18X-0.06,R2=0.988 1;CAP的回归方程为Y=1.278X-0.005,R2=0.989 7。说明建立的AMA和CAP的ic-CLEIA方法的测定结果准确可靠。
3 结 论
本研究建立了检测禽肉中AMA和CAP残留的ic-CLEIA检测方法,AMA ic-CLEIA方法线性范围为0.06~1.77 μg/L,IC50为0.33 μg/L,检出限为0.06 μg/L;CAP ic-CLEIA方法线性范围为0.010~0.179 μg/L,IC50为0.039 μg/L,检出限为0.009 μg/L。除AMA与金刚乙胺有部分交叉外,2 种ic-CLEIA方法的特异性良好;优化了样品前处理各项参数,制定了一种用碳酸钾和乙酸乙酯同时提取禽肉中AMA和CAP的样品前处理方法。在最佳条件下,AMA和CAP的添加回收率分别为92.55%~105.14%和92.00%~112.50%,变异系数均低于10.48%;经仪器方法确证,本方法及样品前处理方法检测结果准确可靠,可以满足禽肉中AMA和CAP两种药物的实际检测需求。与蔡云虹[11]、杨丽丽[12]酶联免疫检测方法相比,本方法不仅灵敏度和准确度有了显著提高,而且能够应用于禽肉产品多残留药物的同时检测,具有良好的应用前景。
