绵羊BTG2 基因CDs 区克隆、生物信息学分析及组织mRNA 表达研究
2021-03-01刘理想金海国马惠海薛佳佳
高 一 ,刘理想,2,肖 成,金海国,马惠海,薛佳佳,2,魏 天,曹 阳*
(1.吉林省农业科学院动物生物技术研究所,吉林公主岭 136100;2.吉林农业大学动物科技学院,吉林长春 130118)
小尾寒羊B 细胞易位基因2(B-cell TranslocationGene 2,BTG2)是首个被鉴定的新型抗增殖因子BTG/TOB 基因家族成员[1],位于染色体的1q32 位点,编码150 个氨基酸,BGT2也被命名为TIS21、PC3,是分别表达于人类、小鼠、大鼠的同源基因[2-3]。BTG/TOB家族包括Pc3/Tis21/BTG2、Btg1、Tob、Tob2、Ana/Btg3、P c3k等,成员众多且来自不同物种,有些命名与最初概念有一点不同,为便于记忆和理解,根据该家族抗增殖功能统一命名为APRO(Anti-Proliferative),因此BGT2又名为APRO1[4]。BTG/TOB 家族成员结构的共同特征是蛋白分子的N-末端存在2 个约110 个高度保守氨基酸组成的同源区A box 和B box,其中A box具有抗增殖的作用,而B box 与许多靶分子结合起作用,A box 和B box 被一段非保守的氨基酸序列隔开,2 个保守区与调节细胞周期的CCR4 相关因子1(Caf1)有关[5]。且BTG/TOB 基因家族存在一些影响哺乳动物细胞RNA 稳定性的ATTTA 基序[4,6],与其他家庭成员相比,BTG1和BTG2还具有C Box[7]。BTG2在各种器官和组织中表达,如脾脏、胸腺、肺、胃和大肠,在肺、肠、胰腺和前列腺[8],能够阻滞细胞在G1/S 和G2/M 的过渡、增加凋亡[9],促进维甲酸诱导的细胞分化造血细胞[10]和抑制胸腺细胞的扩张[11]。此外,该基因具有促进神经元分化发育,抑制细胞增殖[9,12],依赖p53 机制调控DNA 损伤修复[13]等生物学功能。
随着研究深入挖掘,BTG2基因逐步成为畜牧业领域中研究热点,并在羊中的功能研究取得一定成果。在滩羊尾部脂肪沉积的研究中发现,BTG2表达量与尾部脂肪沉积指标呈正相关,能促进脂肪沉积[14]。另有报道表明BTG2基因可以作为多脊椎小尾寒羊的候选的分子标记或位点[15]。在特克赛尔(Texel)和乌珠穆沁试验发现,BTG2对绵羊胎儿中后期骨骼肌发育有重要作用,且可能参与myostatin 调节通路[16]。本实验拟克隆小尾寒羊BTG2基因CDs 区,并对其进行生物信息学分析,同时检测该基因在羔羊期不同组织中的mRNA表达情况,旨在为进一步探索BTG2基因在羔羊期的生理学作用提供理论基础。
1 材料与方法
1.1 材料采集 3 日龄和40 日龄的小尾寒羊心脏、肝脏、脾脏、肺脏、肾脏、十二指肠、背最长肌组织,存于冻存管中,液氮保存。
1.2 主要试剂 Trizol 购自Invitrogen 公司;2xEs Taq Master Mix(dye)购自康为世纪;DNA Marker2000bp、PrimeScriptRTTMreagent Kit with gDNA Eraser、SYBR®Premix Ex taqTM、pMD18-T 载体购自TaKaRa 公司;Gel Extraction Kit 购自OMEGA 公司。引物、测序均由金唯智生物技术有限公司完成。
1.3 引物设计与合成 根据NCBI 数据库中绵羊BTG2基因CDs 序列,使用Primer Premier5.0 软件设计特异性引物及定量引物(表1),选取β-actin为内参基因。
1.4BTG2基因CDs 区克隆 提取绵羊肌肉组织RNA,反转录获得cDNA。PCR 扩增体系:2×Master Mix 10 μL,1 μmol/L F-primer 0.4 μL,1 μmol/L R-primer 0.4 μL,50 ng/μL cDNA 1.2 μL,补充ddH2O 至20 μL。扩增程序:98℃ 5min;98℃ 10 s;61℃ 30 s;72℃30s,30 个循环;72℃ 7 min。
PCR 产物用1.5%琼脂糖凝胶电泳进行检测并进行胶回收。采用TA 克隆的方法,将回收产物与pMD18-T载体16℃孵育30min 进行连接,转化大肠杆菌DH5α感受态细胞,随后涂布在氨苄青霉素平板上,于37℃培养箱中倒置过夜,挑取单克隆菌落于含有氨苄的液体培养基中,37℃、200 r/min 摇床震荡过夜。最后进行菌液PCR 鉴定,并送往苏州金唯智生物公司测序。
1.5 生物信息学分析 将绵羊BTG2基因序列在NCBI中BLAST 比对同源性,利用MEGA-X 软件构建绵羊、牛、猪、人、大鼠、小鼠、虎鲸系统进化树;根据在线软件http://www.bio-soft.net/sms/prot_mw.html 分析蛋白分子量;https://web.expasy.org/protparam/ 分析蛋白的基本理化性质;https://web.expasy.org/protscale/ 分析蛋白氨基酸序列的亲疏水性;http://www.cbs.dtu.dk/services/SignalP/预测氨基酸序列信号肽;TMHMM-2.0分析蛋白的跨膜区结构;http://www.cbs.dtu.dk/services/TargetP/ 和https://psort.hgc.jp/form2.html 预测蛋白的亚细胞定位;https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.p 和http://bioinf.cs.ucl.ac.uk/psipred/分析蛋白的二级结构;http://www.sbg.bio.ic.ac.uk/phyre2/phyre2_output/分析蛋白三级结构。
1.6BTG2基因在绵羊各组织中的表达分析 提取3 日龄和40 日龄绵羊各组织RNA,进行反转录,qPCR 检测BTG2基因在心脏、肝脏、脾脏、肺脏、肾脏、胃、肠、肌肉中的mRNA 表达量。PCR 扩增体系:SYBR®Premix Ex taqTM10 μL,cDNA 1.5 μL,F-primer 0.4 μL,R-primer 0.4 μL,补充ddH2O 至 20 μL。反应程序:95℃5 min;95℃ 10 s;60℃15 s,72℃ 20 s,共40 个循环;72℃ 7 min。熔解曲线分析:95℃ 5 s;65℃ 1 min,每个待测样品设置3 个重复,采用2-ΔΔct方法分析相对表达水平。

表1 引物序列信息
1.7 统计分析 采用SPSS 19.0 和GraphPad Prism 6 软件对数据进行单因素方差分析,数据均以平均值±标准误表示。
2 结果与分析
2.1BTG2基因CDs 区序列克隆 以肌肉组织cDNA为模板,PCR 扩增得到一条453 bp 的特异性片段(图1),与预期长度相符。同时用TA 克隆的方法,测序比对序列正确,表明本实验成功克隆出绵羊BTG2基因 CDs 区。
2.2BTG2基因序列的生物信息学分析。

图1 BTG2 琼脂糖凝胶电泳图
2.2.1 同源性比对及系统进化树构建 通过NCBI 中BLAST 对绵羊BTG2基因CDs(NM_001246210.1)核苷酸序列与牛(XM_002693879.5)、猪(XM_018059998.1)、人(NM_006763.3)、大鼠(NM_017259.1)、小鼠(NM_007570.2)、虎鲸(XM_004282488.2)进行同源性比对,比对结果显示绵羊与牛、猪、虎鲸、人、大鼠、小鼠同源性分别为98.9%、90.29%、94.04%、88.52%和85.65%、86.98%,说明该基因在生物进化过程中比较保守。利用MEGA-X 软件邻近法(Neighbor-Joining Method,NJ)构建核苷酸系统进化树模型,发现物种进化过程中绵羊与牛的亲缘关系最近,与小鼠的亲缘关系最远(图2)。
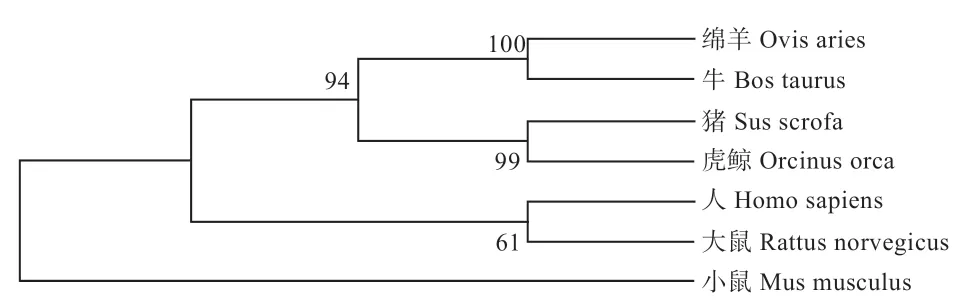
图2 BTG2 基因系统进化树
2.2.2 绵羊BTG2 蛋白理化性质 利用在线ProtParam软件分析BTG2 蛋白的理化性质,结果显示BTG2基因编码150 个氨基酸,根据氨基酸残基组成表(表2)可知含量最高的是亮氨酸(11.3%),不含吡咯赖氨酸和硒半胱氨酸。蛋白的分子式C748H1190N208O213S8,分子质量为17 ku,理论等电点(pI)为9.14,肽链N 端为蛋氨酸(Met),半衰期为30 h。其水溶液在280 nm 处的消光系数为21680,不稳定系数为48.51,属于不稳定蛋白,脂肪系数为94.27,亲水性总平均值为-0.123。根据ProtScale 在线软件对蛋白做进一步的疏水性分析(图3),其中纵坐标0 值以上为疏水区,分值越高疏水性越强,0 值以下为亲水区,分值越低亲水性越强。由图3 可知,多肽链的第9 位氨基酸分值最高为2.167,第47 位氨基酸分值最低为-2.111。该氨基酸序列亲水性残基多于疏水性残基,因此整体表现为亲水性,与ProtParam 软件预测蛋白亲水性结果相同。
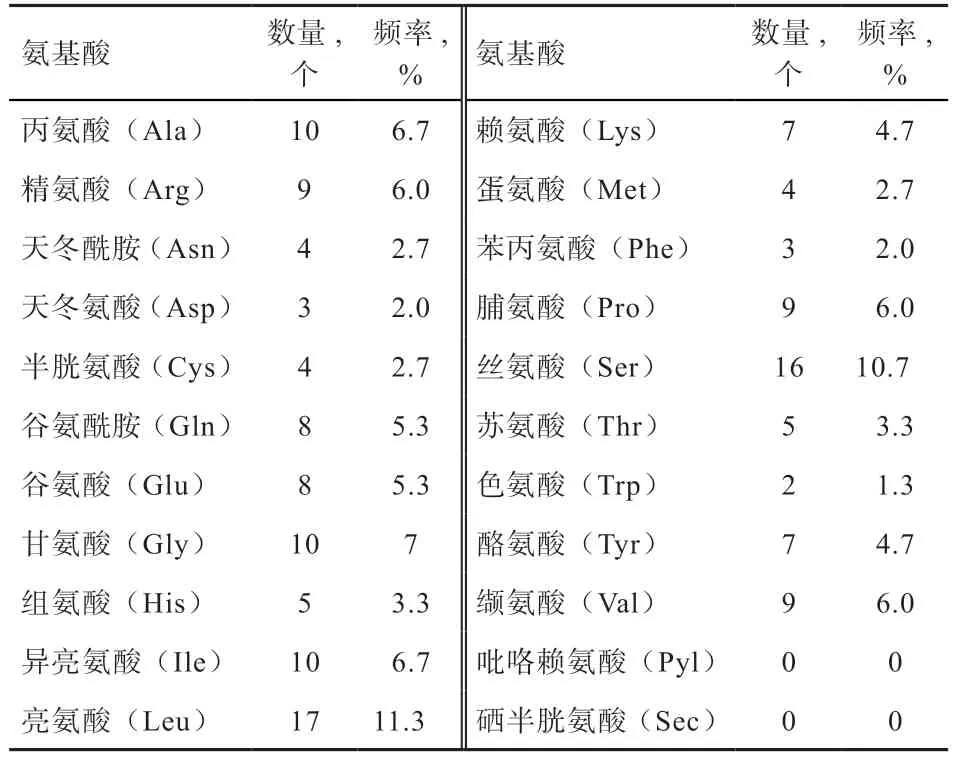
表2 BTG2 蛋白氨基酸组成
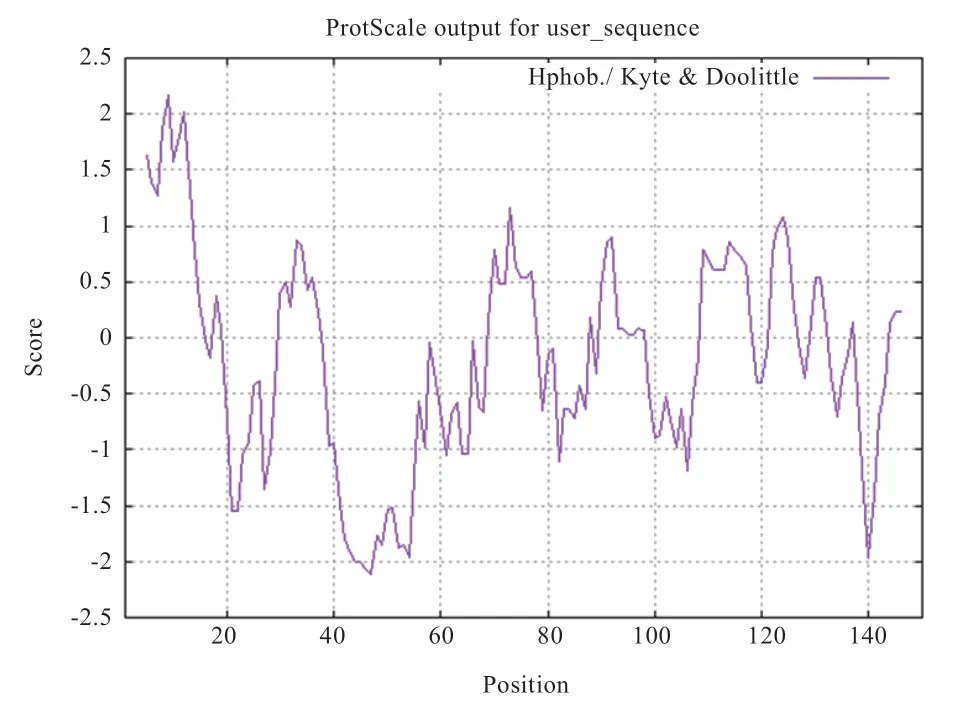
图3 BTG2 蛋白亲疏水性分析
2.2.3 绵羊BTG2 蛋白跨膜区预测及信号肽分析 TMHMM在线软件对BTG2 蛋白的跨膜结构进行预测,结果显示1~150 的氨基酸都位于膜外,不存在跨膜结构。在线软件SignalP 对BTG2 蛋白信号肽进行预测,结果表明该蛋白不存在信号肽序列,也就说明该蛋白不是分泌型蛋白。
2.2.4 绵羊BTG2 蛋白亚细胞定位 使用TargetP、PSORT II 分别预测蛋白质的亚细胞定位(表3),分析显示BTG2 存在于分泌信号通路位点(mTP)、线粒体作用位点(SP),所占比例均很小。蛋白主要分布于细胞核,线粒体上、细胞质、细胞壁、分泌系统的囊泡、细胞支架中也有分布。

表3 绵羊BTG2 蛋白亚细胞定位
2.2.5 BTG2 蛋白高级结构预测 运用SOPM 软件预测BTG2 蛋白二级结构,结果显示α-螺旋、β折叠股(β股)、β-转角和无规则卷曲分别占36%、20%、4.67%和39.33%。利用psipred 软件再次预测二级结构(图4),结果与SOPM 预测相一致,显示蛋白结构主要由α-螺旋(Helix)、无规则卷曲(Coil))和β股(Strand)构成,为混合型蛋白。Phyre2 在线软件对BTG2 的三级结构预测(图5),其主要构成仍为α-螺旋、无规则卷曲和β股,与二级结构预测基本一致。并用JSmol 软件进行查看,其结果与模板序列可信度(confidence)100%,模型精度(identify)92%。

图4 BTG2 蛋白二级结构预测
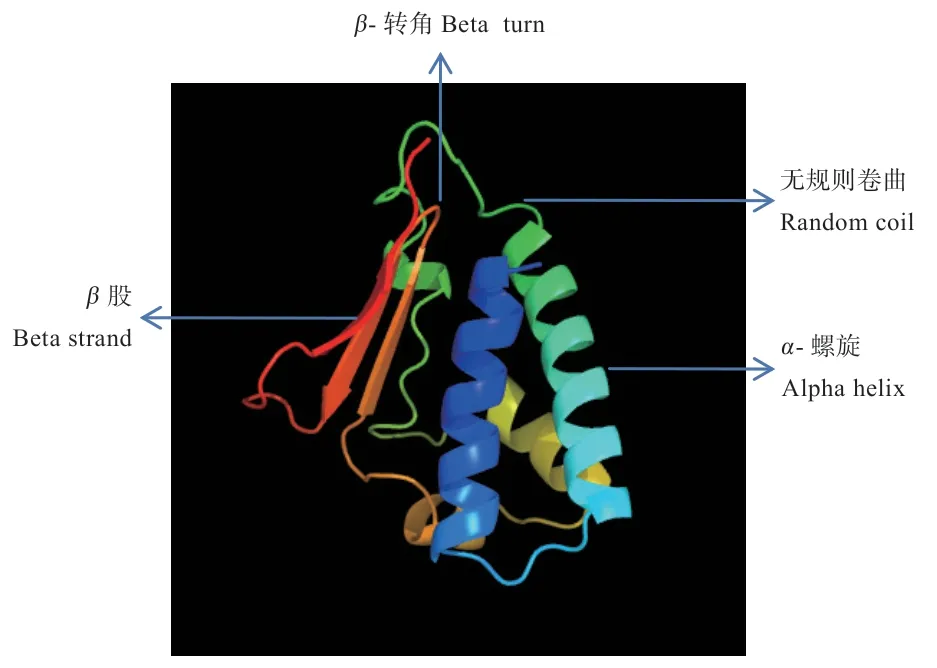
图5 BTG2 蛋白三级结构预测
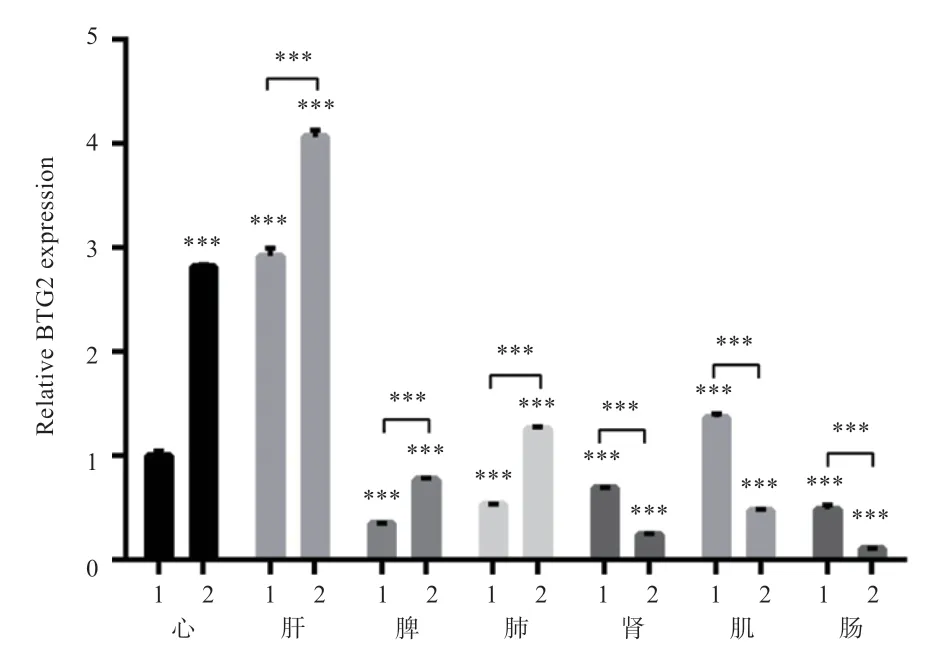
图6 BTG2 基因在绵羊不同组织中的表达
2.3BTG2基因在不同日龄不同组织间的表达分析qPCR 方法检测结果如图6 所示,以BTG2 在3 日龄的心脏表达量作参照组,BTG2基因在各组织(心脏、肝脏、脾脏、肺脏、肾脏、肠和肌肉)中均有表达,且无论在3 日龄还是40 日龄阶段都以肝脏中表达量最高(P<0.001);经数据分析,在心、肝、脾、肺组织中,40 日龄BTG2 表达量极显著高于3 日龄,而在肾脏、肠和肌肉中,40 日龄极显著低于3 日龄。也就是说在3日龄至40 日龄阶段,随着日龄增长,BTG2基因在心、肝、脾、肺组织中表达量增加,在肾脏、肠和肌肉中表达趋势降低。
3 讨 论
本实验对绵羊BTG2基因核苷酸序列与其他几个物种进行同源性比对,比对结果与系统进化树结果保持一致,显示绵羊与牛的亲缘关系最近,与小鼠的亲缘关系最远,证实了BTG2序列在物种间具有高度保守性,符合生物进化的特征,且具有广泛的同源性。蛋白质结构的特征是疏水/亲水间的平衡,其结构的稳定在很大程度上有赖于分子内的疏水作用,软件分析该氨基酸序列亲水性残基多于疏水性残基,表现为亲水性,也进一步说明BTG2属于不稳定蛋白。BTG2 蛋白跨膜结构的预测结果显示不存在跨膜结构,且1~150 的氨基酸都位于膜外,与蛋白的亲水性区域分析结果基本一致。对其进行信号肽预测,发现BTG2 蛋白氨基酸序列不存在信号肽,意味着不能够将新合成的蛋白质引导向分泌通路,不属于分泌蛋白。亚细胞定位预测显示,该蛋白主要分布于细胞核和线粒体上,鉴于2 个细胞器在细胞内发挥的重要功能,提示BTG2 蛋白可能通过接受外来信号参与细胞的遗传代谢、细胞周期、凋亡和分化等过程。根据目前已有的BTG2研究来看,可以肯定的是BTG2确实参与细胞周期负调控、抑制细胞增殖、DNA 损伤修复及肿瘤抑制等过程。该基因蛋白二级、三级结构预测结果相一致,显示以α-螺旋、无规则卷曲为主。
BTG2基因在不同日龄羔羊组织中qPCR 检测结果表明,该基因在各组织中广泛分布。存在于心脏、肺脏、肾脏中,说明其参与呼吸和泌尿的可能性;表达在肝脏和肌肉中,提示其可能参与脂类代谢、糖代谢等调控过程;在肠中表达,说明其可能在机体消化、促生长方面具有重要作用;在脾脏中表达,推测其与免疫功能有关。数据进一步分析发现,BTG2在各组织中表达存在差异,但以在肝脏中表达量最高,表示BTG2可能与脂代谢、糖代谢等过程密切相关。关于BTG2的研究中,有研究人员发现包括BTG2在内的6 个基因(BTG2、PDHB、SORBS1、TRDN、TTN和MGP)在肌间脂肪含量不同的日本和牛中存在差异表达[17]。此外,有研究表明BTG2能够通过Stat3 信号通路的来抑制前脂肪生成活性,在前脂肪细胞分化过程中,呈现波动表达趋势[18]。在滩羊尾部脂肪沉积的探索试验结果表明,BTG2表达量则对尾部脂肪沉积指标呈正相关,能促进脂肪沉积[14]。并有报道证明,经cAMP 信号通路,BTG2与肝糖生成相关基因协同上调,可致肝糖含量增加[6]。这些研究结果提示BTG2基因与脂代谢、脂肪沉积乃至碳水化合物的积累存在紧密关联。对数据深入分析发现,在3~40 日龄阶段,随着日龄增长,BTG2基因在心、肝、脾、肺组织中表达量增加,但在肾脏、肠和肌肉中表达量降低。本研究推测BTG2于不同时间段在各组织中发挥的作用不同,所以表达趋势有所变化,但具体功能作用和机制仍不清楚,有待后续进一步的细化研究。
4 结 论
本实验成功克隆BTG2基因蛋白编码区,并对其进行生物信息学分析,结果显示小尾寒羊BTG2基因CDs区长度453 bp,分子质量为17ku 的亲水性的不稳定蛋白,不存在跨膜结构和信号肽,蛋白主要分布于细胞核,存在于分泌信号通路位点,高级结构由α-螺旋、无规则卷曲和β股构成,并在在生物进化过程具有保守性。通过对该基因的3 日龄和40 日龄的羔羊期组织表达图谱分析,BTG2在在各组织中的广泛分布且表达趋势不同,以肝脏中表达量最高,且随着日龄增长,该基因在心、肝、脾、肺组织中表达量增加,在肾脏、肠和肌肉中表达量降低。本实验结果支持BTG2与脂代谢相关这一观点,但还需更多的实验数据来提供支持和验证。
