耐力运动与高脂饮食对Wistar大鼠骨骼肌线粒体融合分裂蛋白表达的影响研究*
2021-03-01徐晓阳
郑 义, 徐晓阳,薄 海, 张 勇
(1.华南师范大学体育科学学院,广东 广州 510000;2.武警后勤学院军事训练医学教研室,天津 300162;3.天津体育学院天津市运动生理与运动医学重点实验室,天津 300381)
随着人民生活水平的提高,脂肪摄入占机体总热量摄入的比重逐年升高,高脂饮食(High Fat Diet,HFD)习惯已成为机体肥胖的主要原因之一。研究表明,长期高脂饮食(High Fat Diet,HFD)可以显著增加机体体重,骨骼肌线粒体氧化功能异常及能力代谢紊乱,降低机体胰岛素敏感性,进而诱发胰岛素抵抗(Insulin Resistance,IR)乃至Ⅱ型糖尿病[1]。耐力运动可以有效改善骨骼肌线粒体脂肪氧化能力,降低机体体重、血糖浓度并增强机体胰岛素敏感性[2]。骨骼肌是人体重要的运动器官,线粒体是骨骼肌重要的“能量工厂”,通过氧化磷酸化为骨骼肌提供能量。线粒体同时也是一种高度动态的细胞器,通过不断的移动、融合与分裂等动态变化维持其分布、形态与数量的稳定性以便适应各种外界应激条件,从而满足细胞的能量代谢及其他生物学需求。目前已发现一些与线粒体融合与分裂密切相关的线粒体蛋白,如调控线粒体内外膜融合的蛋白MFN1、MFN2与OPA1等,调控线粒体分裂的蛋白DRP1、FIS1等[3]。骨骼肌线粒体融合与分裂变化极大程度的影响了骨骼肌线粒体功能与能量代谢,其异常改变可导致骨骼肌线粒体动态失衡与能量代谢紊乱,故骨骼肌线粒体融合与分裂状态的变化在肥胖与运动干预中的作用是本研究所关注的重点。
目前耐力运动中线粒体融合与分裂相关蛋白表达的研究较少,长期耐力运动对于肥胖个体骨骼肌线粒体融合与分裂蛋白表达及其意义仍不清楚。本研究采用HFD诱导Wistar大鼠肥胖模型,通过观察HFD与长时间高强度耐力运动对肥胖大鼠骨骼肌线粒体融合与分裂蛋白的影响,初步探讨骨骼肌线粒体动态变化的规律,为肥胖个体的营养与运动干预方案提供理论依据。
1 材料与方法
1.1 实验动物与训练方案
实验动物为8周龄SPF级雄性Wistar大鼠(北京维通利华实验动物技术有限公司,许可证号SCXK(京)2016-0006)48只,初始体重291.08±6.98g。大鼠饲养地点为天津体育学院天津市运动生理与医学重点实验室动物房。大鼠适应性饲养2周后随机分为普通饮食组(N组,16只)与高脂饮食组(H组,32只),两组大鼠初始体重无差异。N组大鼠使用维持饲料(Normal Diet, ND;北京华阜康生物科技有限公司)进行饲喂,H组大鼠使用高脂饲料(High Fat Diet,HFD;北京华阜康生物科技有限公司,脂肪含量60%)进行饲喂,共饲喂8周,每周末记录大鼠体重。第9周将N组大鼠分为普食安静组(NNC组,8只)与普食运动组(NNE组,8只),H组大鼠分为高脂安静组(HHC组,8只)、高脂运动组(HHE组,8只)、饮食转换安静组(HNC组)与饮食转换运动组(HNE组,8只),NNC组与NNE组继续使用维持饲料饲喂,HHC组与HHE组继续使用HFD饲料进行饲喂,、HNC组与HNE组从HFD饲料转换为维持饲料进行饲喂。NNE组、HHE组与HNE组从第9周开始进行耐力运动干预,第9周进行为期1周的运动适应(运动方案如图1所示),第10周-第17周进行正式运动干预,其运动方式为0°跑台速度9m/min,热身3~5min;随后0°跑台速度19m/min运动1h,1h/d,5d/w。每周末记录大鼠体重。第17周末进行取材。

图1 大鼠适应性运动阶梯方案
1.2 取材与指标检测
实验第8周末对实验Wistar大鼠进行OGTT测试。测试前1天晚进行禁食处理,隔夜禁食14~16h后,用平板固定器(北京合力科创公司,HL-DBS-400)将大鼠固定,将鼠尾浸泡于45℃左右的温水中3~5min以舒张大鼠鼠尾静脉血管,擦干并酒精消毒后用采血针轻轻扎破尾静脉取血,擦掉第一滴血后测定空腹血糖(0min)。立即灌注10ul/g体重的20%葡萄糖溶液,并开始计时。在葡萄糖灌注后的30min、60min、90min与120min再次使用采血针进行尾静脉取血,测定血糖值。每次采血结束后对大鼠鼠尾采血点均使用酒精片消毒并压迫止血。将记录的0min、30min、60min、90min与120min血糖值(G0、G30、G60、G90、G120)作图绘制OGTT曲线。
第17周末处死前称量大鼠体重并测量大鼠体长,计算Lee’s指数;处死后解剖称量大鼠附睾脂肪与肾周脂肪重量,计算内脏脂肪指数。
内脏脂肪指数=(附睾脂肪+肾周脂肪)/体重*100%
动物经麻醉后处死,取右腿腓肠肌用预冷的PBS清洗后放入冻存管进行液氮速冻,随后放入-80℃低温冰箱进行保存。称取100mg腓肠肌加入含有10ul PMSF(Solarbio)的 1mlRIPA裂解液(Solarbio),表面皿剪碎后在冰水浴中使用杜恩斯匀浆器充分匀浆,倒入1.5mlEP管中,冰上静置20min。随后将装有混合液的EP管使用离心机4℃,15000g离心20min,取上清液使用BCA蛋白浓度试剂盒(Solarbio)测定蛋白浓度,调整浓度后加入5Xloading buffer(碧云天)煮沸10min进行蛋白变性。冷却后取15-20ug蛋白使用10%与12%SDS-PAGE电泳分离,半干转膜法转移至0.22umPVDF膜(millipore)上,5%脱脂牛奶常温封闭1h,TBST稍稍清洗后加入一抗MFN1、MFN2、OPA1、DRP1、FIS1、PINK1、PARKIN、BNIP3、P62、LCⅢ抗体(abcam)及β-tubulin、GAPDH内参抗体(CST)过夜,次日使用TBST清洗PVDF膜,加入HRP标记的与一抗对应之二抗(中杉金桥)室温孵育1h,再次使用TBST清洗。清洗结束后滴加ECL发光底物(millipore)进行蛋白显影,使用暗匣胶片拍照。使用ImageJ 4.0软件进行半定量分析。
1.3 统计学分析
实验数据采用SPSS22.0软件进行统计学分析。所有数据均使用平均数±标准差(x±s)表示。方差齐性条件下,同一指标数据使用独立样本T检验 / 双因素方差分析(Two-way ANOVA)进行统计分析。
2 实验结果
2.1 耐力运动和HFD干预前后大鼠体重、OGTT、Lee‘s指数及内脏脂肪指数
正式实验开始时,N组大鼠与H组大鼠初始体重均无差异;HFD饲喂6周后,H组大鼠体重开始显著高于N组大鼠体重,如图2所示。

*:P<0.05,H组相较于N组图2 第1周-第8周N组与H组大鼠体重
第8周末对N组与H组大鼠进行OGTT测试(图3),H组大鼠30min、60min、90min、120min血糖均非常显著高于N组大鼠,显示H组大鼠已出现较为明显的IR症状,综合体重改变情况认定8周HFD干预大鼠肥胖模型造模成功。

**:P<0.01,H组相较于N组图3 第8周末N组与H组大鼠OGTT测试结果
如图4所示,第9周再次分组后,随着HFD饲喂的时间增加HHC组大鼠体重持续升高,而9周耐力运动干预使NNE组、HHE组与HNE组大鼠体重显著下降,NNC组、HNC组大鼠与HHC组大鼠体重相比具有显著差异,提示耐力运动与饮食转归均可有效降低肥胖大鼠体重,HFD与运动缺失均是大鼠体重增加乃至肥胖的主要诱因之一。

图4 第8周-第17周各组大鼠体重变化
17周末进行大鼠宰杀,如表1所示NNE组与NNC组、HHE组与HHC组相比Lee’s指数均显著下降,提示耐力运动显著降低了大鼠Lee’s指数;NNE组与NNC组、HHE组与HHC组、HNE组与HNC组、NNC组与HHC组、HNC组与HHC组相比内脏脂肪指数均有显著性(P<0.05)或非常显著性(P<0.01)差异,提示运动显著降低了大鼠内脏脂肪指数,HFD显著提升了大鼠内脏脂肪指数。

表1 各组大鼠Lee‘s指数与内脏脂肪指数
2.2 耐力运动和HFD对大鼠骨骼肌线粒体融合蛋白的影响
骨骼肌线粒体融合分为外膜融合与内膜融合。MFN1与MFN2是骨骼肌线粒体的外膜融合蛋白,可以形成3种不同的复合体(MFN1-MFN1、MFN2-MFN2及MFN1-MFN2)调控线粒体外膜融合。由图 5可知NNC组与NNE组、HHC组与HHE组、HNC组与HNE组骨骼肌MFN1表达均存在非常显著性差异(P<0.01),提示运动可以显著提升MFN1的表达;NNC组与HHC组、HHC组与HNC组骨骼肌MFN1表达均存在非常显著性差异(P<0.01),提示HFD可以显著降低骨骼肌MFN1的表达;NNE组与HHE组、HHE组与HNE组骨骼肌MFN1表达均存在非常显著性差异(P<0.01),提示HFD可以抑制运动对MFN1表达的提升作用。
由图6结果可知,NNC组与NNE组、HHC组与HHE组、HNC组与HNE组骨骼肌MFN2蛋白均存在显著性(P<0.05)/非常显著性(P<0.01)差异,提示9周耐力运动可以提升MFN2蛋白表达;NNC组与HHC组、HHC组与HNC组骨骼肌MFN2蛋白存在显著性(P<0.05)/非常显著性(P<0.01)差异,提示HFD干预可以降低MFN2蛋白表达;NNE组与HHE组骨骼肌MFN2蛋白存在非常显著性(P<0.01)差异,提示HFD可以抑制9周耐力运动对MFN2蛋白表达的提升作用。
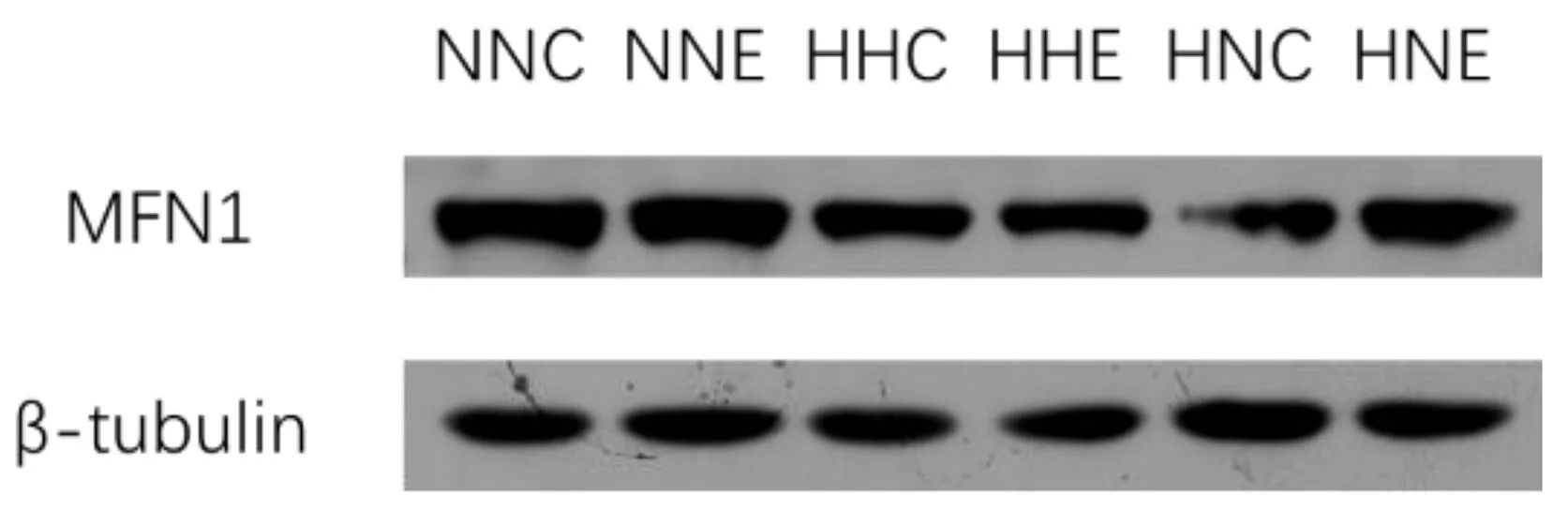

*:P<0.05;**:P<0.01图5 各组大鼠骨骼肌MFN1蛋白表达
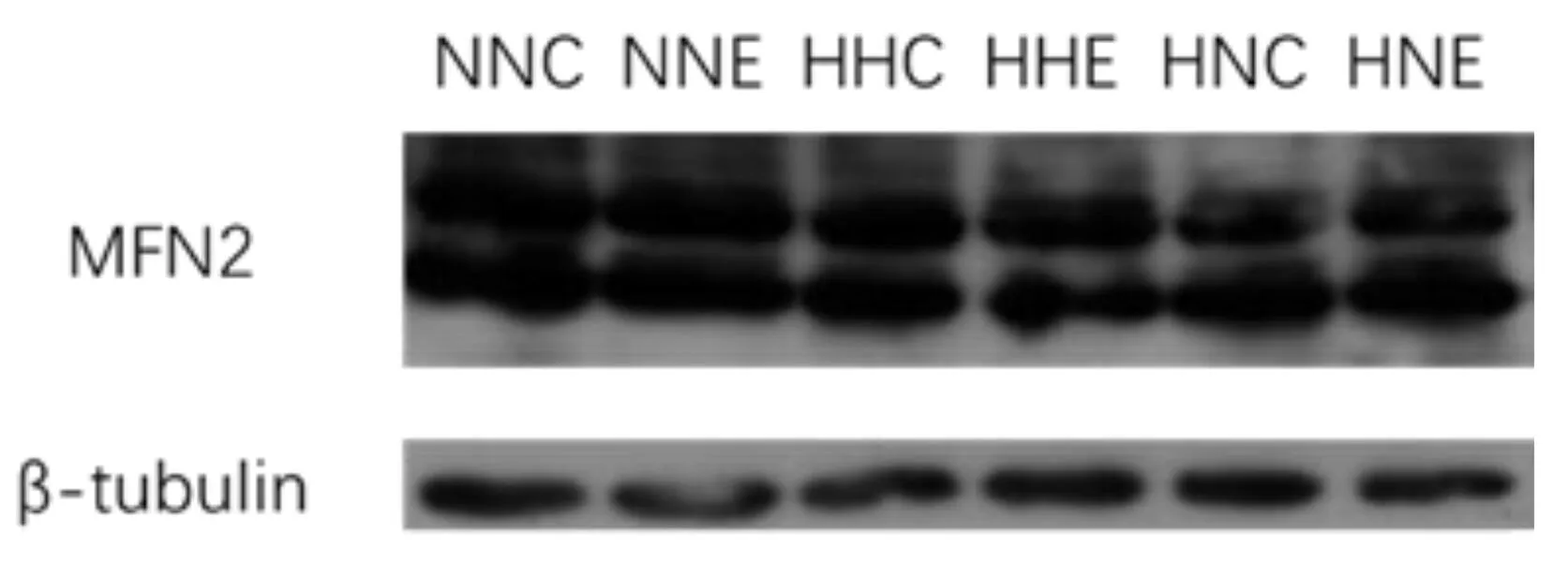
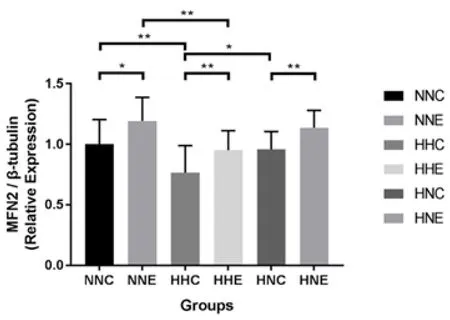
*:P<0.05;**:P<0.01图6 各组大鼠骨骼肌MFN2蛋白表达


*:P<0.05;**:P<0.01图7 各组大鼠骨骼肌OPA1蛋白表达
OPA1是线粒体内膜上的重要蛋白,参与线粒体内膜融合与嵴重构。由图7结果可知,NNC组与NNE组、HNC组与HNE组骨骼肌总OPA1蛋白表达具有显著性(P<0.05)与非常显著性(P<0.01)差异,而HHC组与HHE组骨骼肌总OPA1表达无差异;同时NNC组与HHC组、NNE组与HHE组、HHE组与HNE组骨骼肌总OPA1表达均具有非常显著性差异,提示长期耐力运动提升了大鼠骨骼肌总OPA1表达,同时HFD显著降低了骨骼肌OPA1的蛋白表达,且HFD可以显著甚至完全抑制了长期耐力运动对OPA1蛋白表达的提升作用。为了进一步了解不同类型OPA1所受到的影响,本研究将OPA1进行分型统计,上方为L-OPA1,下方为S-OPA1。由结果可知,由于L-OPA1与S-OPA1在各组大鼠骨骼肌蛋白表达与总OPA1表达相一致,故不作赘述。不同的是,HHC组与HHE组大鼠骨骼肌S-OPA1蛋白表达存在显著性差异(P<0.05)。
2.3 耐力运动和HFD对大鼠骨骼肌线粒体分裂蛋白的影响
与线粒体融合模式有所不同,线粒体分裂主要由线粒体分裂蛋白DRP1进行调控。DRP1在线粒体外膜结合FIS1、MID49/51及MFF等受体蛋白,形成环状结构后逐渐收缩分裂线粒体。本研究主要检测了骨骼肌DRP1及FIS1的蛋白表达情况。


*:P<0.05;**:P<0.01图8 各组大鼠骨骼肌DRP1蛋白表达
由图8可知,NNC组与NNE组、HHC组与HHE组、HNC组与HNE组相比骨骼肌DRP1蛋白表达均存在显著性(P<0.05)与非常显著性差异,NNE组与HHE组、HHE组与HNE组相比骨骼肌DRP1蛋白表达均存在非常显著性差异(P<0.01),提示维持饲料及饮食转归饲喂情况下9周耐力运动显著提升了骨骼肌DRP1的表达,9周耐力运动显著降低了HFD干预组的DRP1的表达。
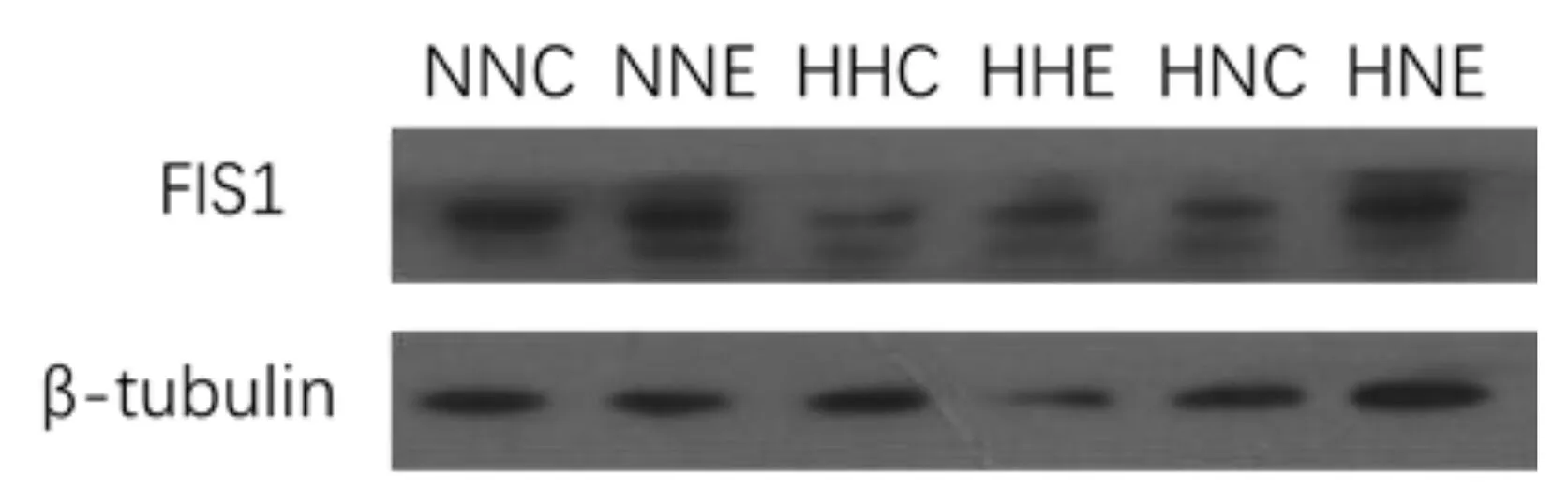

*:P<0.05图9 各组大鼠骨骼肌FIS1蛋白表达
由图9可知,NNC组与NNE组、HHC组,HNC组与HNE组大鼠相比骨骼肌FIS1蛋白表达存在显著性差异(P<0.05),提示运动与HFD均显著提升了大鼠骨骼肌FIS1蛋白的表达。但HHC组与HHE组FIS1蛋白表达无差异,提示运动并不能降低HFD干预后FIS1蛋白表达。
3 分析与讨论
3.1 耐力运动与HFD对肥胖大鼠骨骼肌线粒体融合蛋白的影响
骨骼肌线粒体是一种适应性很强的细胞器,随着外界环境的刺激产生不同的变化以保证其功能的完整性[4]。线粒体融合蛋白MFN1与MFN2具有功能互补性,当线粒体同时缺乏MFN1与MFN2时则不能进行线粒体外膜融合[5-6];当线粒体缺乏OPA1时则仅能进行线粒体外膜融合而不能进行内膜融合。由结果可知,9周耐力运动上调了大鼠骨骼肌MFN1的蛋白表达,HFD干预使MFN1的表达显著下降,同时抑制了9周耐力运动对MFN1的表达上调;9周耐力运动也上调了MFN2的蛋白表达,HFD干预同样使MFN2的表达显著下降并抑制了9周耐力运动对MFN2的上调作用。MFN2相较于MFN1似乎具有更多功能,有研究表明MFN2表达量下降可能会导致骨骼肌内质网信号的激活,进而加重IR病程[7]。Greene等人研究发现小鼠高脂饮食降低了骨骼肌MFN2、OPA1的蛋白表达量[8],Joseph等也·观察到T2DM患者骨骼肌中MFN2和OPA1融合蛋白表达显著降低[9]。各组大鼠骨骼肌OPA1蛋白表达结果与MFN1/MFN2结果相一致,但本研究并未检测出HHC组与HHE组间OPA1表达结果的差异,提示HFD对于运动提升OPA1的表达具有抑制作用。有研究表明,过表达OPA1可以显著改善线粒体呼吸功能,减少Cyt C与ROS的生成速率[10-11]。而OPA1缺失则会导致机体早衰、全身性炎症反应以及代谢紊乱症状[12]。但HHE组大鼠骨骼肌S-OPA1蛋白表达显著低于HHC组,S-OPA1参与了线粒体分裂与凋亡等活动,此结果与DRP1表达结果相一致。本实验室在之前的研究中已报道随着一次大强度急性运动时间的增加,骨骼肌mfn1/2 mRNA的表达逐渐下降,同时骨骼肌MFN1蛋白水平下降,而骨骼肌fis1 mRNA表达和FIS1蛋白含量显著升高,上述结果提示一过性大强度运动后骨骼肌线粒体融合减少,趋向于分裂[13]。长期耐力运动后由于能量代谢的需求增加,PGC-1a等线粒体生物合成上游因子显著上调[14],骨骼肌线粒体趋向于融合,与一次性大强度运动后骨骼肌线粒体趋向于分裂有所不同。综上耐力运动显著提升了骨骼肌线粒体融合蛋白的表达,HFD显著降低了骨骼肌线粒体融合蛋白的表达,HFD显著抑制了耐力运动对骨骼肌融合蛋白表达的提升作用。
3.2 耐力运动与HFD对肥胖大鼠骨骼肌线粒体分裂蛋白的影响
由结果可知,运动干预显著上调了S-OPA1与DRP1的表达,提示9周耐力运动与增加了线粒体分裂蛋白的表达。然而HFD干预后进行9周耐力运动组(HHE组)小鼠DRP1与S-OPA1显著下降,提示9周耐力运动显著下调了HFD干预大鼠骨骼肌DRP1与S-OPA1蛋白表达。此结果与骨骼肌线粒体OPA1切割蛋白OMA1表达结果(未显示)相一致。此前两项独立研究均表面DRP1在骨骼肌中的过度表达损害了骨骼肌线粒体网络稳定性,导致肌肉质量下降以及机体运动能力的显著下降[15-16]。在使用mdivi-1(DRP1抑制剂)干预C2C12细胞后,线粒体趋于融合态且氧化能力有所增加综合融合蛋白表达[17]。Borengasser等人观察到HFD诱导的肥胖小鼠在骨骼肌中表现出DRP1与FIS1蛋白的上调[18],而本研究中NNC组与HHC组DRP1蛋白表达无差异,其原因可能是HFD干预时间存在差异,随着HFD干预时间的增加,线粒体分裂蛋白的表达可能趋于升高。相关研究均表明HFD可能扰乱了骨骼肌的线粒体动态变化[19-20],与本研究结果相一致。综合本研究中骨骼肌线粒体融合与分裂蛋白表达情况来看, 9周耐力运动显著上调了骨骼肌线粒体融合蛋白的表达,也上调了线粒体分裂蛋白的表达,骨骼肌线粒体融合与分裂呈现较为活跃的状态;HFD干预后骨骼肌线粒体融合蛋白下调,线粒体分裂蛋白上调,线粒体趋向于分裂;9周耐力运动对HFD干预后大鼠骨骼肌下调了线粒体分裂蛋白的表达,提示运动抑制了HFD大鼠骨骼肌线粒体的分裂蛋白表达,使线粒体趋向于融合。
4 结论
本研究结果表明,HFD降低骨骼肌融合蛋白的表达并提升分裂蛋白的表达;9周耐力运动同时升高了骨骼肌融合蛋白与维持饲料及饮食转归饲喂组分裂蛋白的表达,但9周耐力运动降低了HFD干预组骨骼肌分裂蛋白的表达。
