半枝莲氯仿极性部位提取物调控linc01843逆转大肠癌5-FU耐药研究
2021-02-28林久茂蔡巧燕魏丽慧熊晓满郑小红俞诗雅林燕滨
张 铃 方 翌 林久茂 蔡巧燕 魏丽慧 熊晓满 刘 菲 郑小红 俞诗雅 林燕滨
(1.福建中医药大学中西医结合研究院,福建 福州 350122;2.福建省中西医结合老年性疾病重点实验室,福建 福州 350122;3.福建中医药大学中西医结合学院,福建 福州 350122)
大肠癌是一种常见的恶性肿瘤,其病死率位居全球第二[1]。 在过去的 50 年,5-氟尿嘧啶(5-fluorouracil,5-FU)是治疗大肠癌最常用的药物。然而,患者对5-FU产生耐药在很大程度上限制了其治疗的有效性[2]。因此,探讨大肠癌对5-FU产生耐药的潜在分子机制,并探索5-FU耐药的新诊断生物标记物已迫在眉睫。长链非编码RNA(long non-coding RNA,lncRNA)是一类长度大于 200 bp的非编码RNA,具有5’帽子和 poly尾巴,通过剪接形成成熟的lncRNA,不具有或很少具有编码蛋白的功能。目前研究已发现,lncRNA具有数量多、类型多、功能多等特点,它们参与了调控基因表达的各个阶段,包括染色质重塑、基因转录、转录后调节、蛋白质翻译以及翻译后的调控[3],而许多lncRNA已被证实在肿瘤的耐药中起到了重要的调控作用[4]。目前的最新研究显示,中药能够通过调控lncRNA逆转肿瘤耐药[5]。半枝莲具有清热解毒、利尿散瘀等功效,在临床上常单用或联合应用于治疗各种肿瘤,包括肺癌、乳腺癌和大肠癌等,并且取得较好的疗效[6]。本课题组前期研究表明半枝莲通过“多环节、多途径、多靶点”方式起到抗大肠癌的作用[7-11]。同时,半枝莲氯仿极性部位提取物(ECSB)是逆转大肠癌5-FU耐药最有效的部位提取物[12],且作用机制可能与下调LRP基因有关[13]。但半枝莲能否通过调控lncRNA的表达逆转大肠癌对5-FU的耐药,仍需进一步研究。因此,本实验初步研究linc01843与5-FU耐药的相关性,并进一步研究半枝莲对其的调控作用。
1 实验材料
1.1 实验细胞与药物 半枝莲购于福建中医药大学国医堂。人结肠癌细胞株HCT-8和耐5-FU细胞株HCT-8/5-FU均购于南京凯基生物科技发展有限公司。
1.2 实验试剂 RPMI-1640培养基、胎牛血清、胰蛋白 酶 、Trizol、lipofectamine 3000、Opti-MEN 培 养基[美国赛默飞世尔科技(中国)有限公司];引物合成于上海生物工程有限公司;si-linc01843合成于上海吉玛制药技术有限公司;HiScript II 1st Strand cDNA合成试剂盒以及ChamQTM SYBR qPCR预混液(南京诺唯赞生物科技股份有限公司);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT,北京索莱宝科技有限公司)。
1.3 实验仪器 二氧化碳培养箱(Heal Force公司);超净工作台(苏州净化设备公司);倒置显微镜系统(德国徕卡仪器有限公司);多功能酶标[美国赛默飞世尔科技(中国)有限公司];PCR扩增仪(美国伯乐公司)。
2 实验方法
2.1 半枝莲提取物的制备 用5 000 mL的85%乙醇将半枝莲(500 g)回流提取3次并过滤。用石油醚、氯仿、乙酸乙酯和正丁醇溶剂进行萃取,得到半枝莲的石油醚(EPESB)、氯仿(ECSB)、乙酸乙酯(EEASB)、正丁醇(ENBSB)的极性部位提取物。然后将这些提取物在旋转蒸发仪上蒸发,得到的浸膏用二甲亚砜(DMSO)超声溶解。其中,ECSB的终浓度为 200 mg/mL,并在-20℃储存。
2.2 HCT-8和HCT-8/5-FU细胞培养 亲本HCT-8细胞和5-FU耐药HCT-8/5-FU细胞均在RPMI-1640培养基中培养(含10%胎牛血清,100 U/mL青霉素和 100 μg/mL 链霉素),置于 37 ℃、5%CO2的培养箱中进行传代培养。HCT-8/5-FU细胞在上述培养条件下,同时在培养基中添加了15 μg/mL的5-FU,以维持其耐药性。
2.3 RT-PCR法检测HCT-8和HCT-8/5-FU细胞中 linc01843的表达 将 HCT-8和 HCT-8/5-FU细胞按2×105个/孔的密度接种于6孔板中,待细胞贴壁后,分别加入 5-FU(HCT-8:0、400 μmonl/L 5-FU;HCT-8/5-FU:0、3 200 μmonl/L 5-FU)干预48 h。48 h后,使用Trizol试剂提取总RNA。利用HiScript II 1st Strand cDNA合成试剂盒将RNA逆转录成cDNA;用 ChamQTM SYBR qPCR预混液以及linc01843的引物,从cDNA中扩增出linc01843,将GAPDH作为内参。相对linc01843的RNA表达分析使用 2-ΔΔCt方法。
2.4 转染 linc01843到 HCT-8和 HCT-8/5-FU细胞中 分别用Opti-MEN培养基配置si-linc01843、negative control(阴性对照)和 lipofectamine 3000 试剂液,且si-linc01843和negative control的终浓度为30 nmol/L,室温静止 5 min。 将配置好 si-linc01843、negative control与lipofectamine 3000试剂液等体积混合,室温静止15 min后加入到亲本HCT-8细胞和5-FU耐药HCT-8/5-FU细胞中。6 h后,去掉上清液,加入RPMI-1640完全培养基,进行后续实验。
2.5 RT-PCR法检测转染si-linc01843后的HCT-8和HCT-8/5-FU细胞中linc01843的表达 将转染 si-linc01843、negative control的 HCT-8 和 HCT-8/5-FU细胞培养48 h后,使用Trizol试剂提取总RNA。利用HiScript II 1st Strand cDNA合成试剂盒将RNA逆转录成cDNA;用 ChamQTM SYBR qPCR预混液以及linc01843的引物,从cDNA中扩增出linc01843,将GAPDH作为内参。相对linc01843的RNA 表达分析使用 2-ΔΔCt方法。
2.6 MTT法检测5-FU对转染si-linc01843后的HCT-8和HCT-8/5-FU细胞活力的影响 取对数生长期细胞,将 HCT-8、HCT-8/5-FU细胞按1×104个/孔的密度接种于96孔板中,待细胞贴壁后,利用 lipofectamine 3000 将 si-linc01843、negative control转染到细胞中,6 h后换液,分别加入不同剂量的 5-FU(HCT-8:0、200、400、800 μmonl/L 5-FU;HCT-8/5-FU:0、1 600、3 200、6 400 μmonl/L 5-FU),干预48 h后移去上清液,每孔加入0.5 mg/mL MTT溶液100 μL,37℃培养4 h。弃上清液后,每孔加入 100 μL DMSO,振荡 10 min后,在 570 nm 处测OD值。
2.7 MTT法检测ECSB及5-FU对HCT-8/5-FU细胞活力的影响 取对数生长期细胞,将HCT-8/5-FU细胞按1×104个/孔的密度接种于96孔板中,待细胞贴壁后,分别加入 ECSB(0、50、100、150、200、250 μg/mL)或 5-FU(0、400、800、1 600、3 200、6 400μmol/L)或 ECSB 联合 5-FU(400、800、1 600、3 200、6 400 μmol/L 5-FU+50 μg/mL ECSB;400、800、1 600、3 200、6 400 μmol/L 5-FU+100 μg/mL ECSB)干预48 h,48 h后移去上清液,每孔加入 0.5 mg/mL MTT溶液100 μL,37℃培养4 h。弃上清液后,每孔加入100 μL DMSO,振荡10 min后,在570 nm处测OD值。
2.8 RT-PCR法检测ECSB对 HCT-8/5-FU细胞中linc01843表达的影响 将HCT-8/5-FU细胞按2×105个/孔的密度接种于6孔板中,待细胞贴壁后,分别加入 0、3 200 μmol/L 5-FU,3 200 μmol/L 5-FU+50 μg/mL ECSB,3 200 μmol/L 5-FU+100 μg/mL ECSB 干预 48 h,48 h 后收集各组细胞,使用Trizol试剂提取总RNA。利用HiScript II 1st Strand cDNA合成试剂盒将RNA逆转录成cDNA;用ChamQTM SYBR qPCR预混液以及linc01843的引物,从cDNA中扩增出linc01843,将GAPDH作为内参。相对linc01843的RNA表达分析使用2-ΔΔCt方法。
2.9 统计学方法 采用SPSS 16.0软件进行处理。计量资料符合正态分布以(±s)表示,组间统计分析采用单因素方差分析。
3 结 果
3.1 linc01843在 HCT-8和 HCT-8/5-FU细胞中的表达 本研究发现:在5-FU干预下,HCT-8和HCT-8/5-FU细胞中的linc01843表达均显著高于各自的对照组(见图1),提示linc01843可能与大肠癌对5-FU的耐药有关。
3.2 linc01843参与大肠癌5-FU的耐药 在转染了si-linc01843后,HCT-8和HCT-8/5-FU细胞中linc01843表达均显著低于各自的negative control组(见图2),说明转染si-linc01843到两株细胞中的模型构建成功,可进行后续实验。表1和表2结果显示:在没有5-FU干预下,转染了si-linc01843的HCT-8细胞和HCT-8/5-FU细胞活力已显著低于其各自的negative control组,在相同5-FU剂量干预48 h下,转染了si-linc01843组的两株细胞活力仍均显著低于各自的negative control组。这些实验结果表明:linc01843参与了大肠癌5-FU的耐药。

图1 HCT-8和HCT-8/5-FU细胞在5-FU干预下的linc01843表达
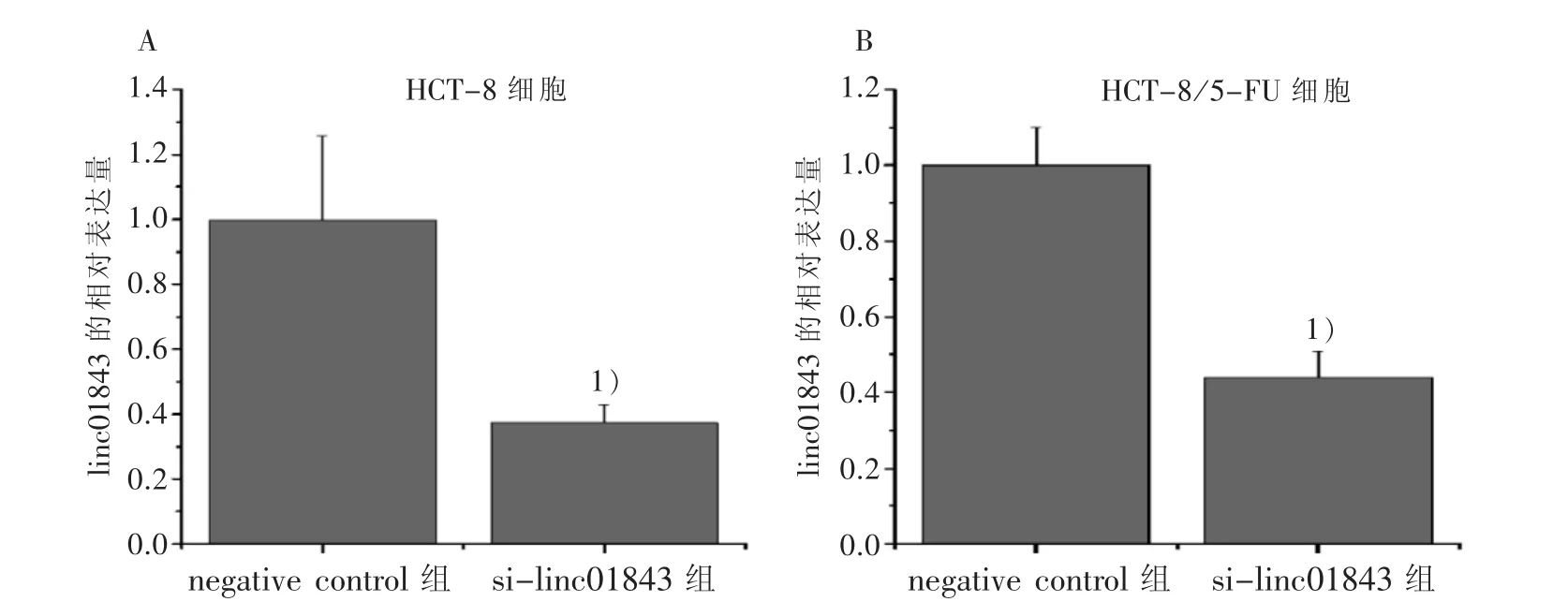
图2 HCT-8和HCT-8/5-FU细胞在转染si-linc01843及negative control后的linc01843表达
表1 linc01843对HCT-8细胞活力的影响(±s)%
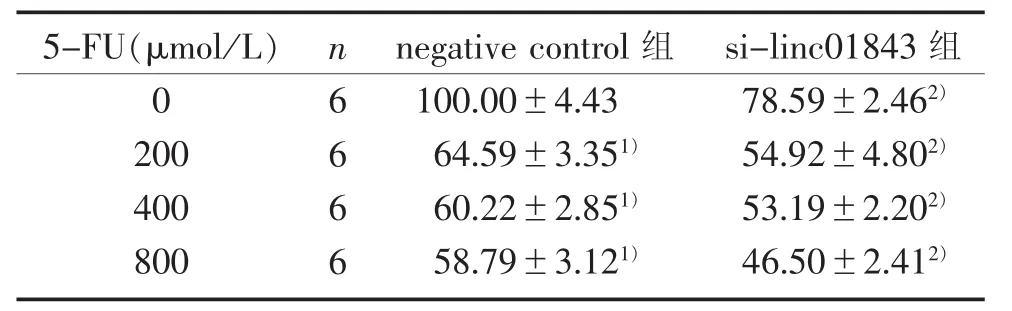
表1 linc01843对HCT-8细胞活力的影响(±s)%
注:与 0 μmol/L 5-FU 组比较,1) P<0.05;与 negative control组比较,2) P<0.05。
5-F U(μ m o l/L)0 2 0 0 4 0 0 8 0 0 n 6 6 6 6 n e g a t i v e c o n t r o l组1 0 0.0 0±4.4 3 6 4.5 9±3.3 5 1)6 0.2 2±2.8 5 1)5 8.7 9±3.1 2 1)s i-l i n c 0 1 8 4 3组7 8.5 9±2.4 6 2)5 4.9 2±4.8 0 2)5 3.1 9±2.2 0 2)4 6.5 0±2.4 1 2)
3.3 ECSB及5-FU对HCT-8/5-FU细胞活力的影响 表3结果显示:HCT-8/5-FU细胞在ECSB干预48 h后,其细胞活力呈剂量依赖性下降。为进一步研究ECSB能否逆转HCT-8/5-FU细胞对5-FU的耐药性,采用 50和 100 μg/mL ECSB和不同剂量的5-FU联合给药干预HCT-8/5-FU细胞48 h,与单独5-FU给药组相比,ECSB联合5-FU给药能够更加显著抑制HCT-8/5-FU细胞的活力,见表4。以上研究结果证实,ECSB能够逆转HCT-8/5-FU对5-FU的耐药性。
3.4 ECSB对 HCT-8/5-FU细胞中linc01843表达的影响 图3显示:在5-FU干预下,HCT-8/5-FU细胞中的linc01843表达显著高于对照组。而在5-FU和ECSB联合干预下,HCT-8/5-FU细胞中的linc01843表达则显著低于单独5-FU给药组。该实验结果表明:ECSB逆转大肠癌5-FU耐药的作用机制之一是通过调控linc01843的表达。
表2 linc01843对HCT-8/5-FU细胞活力的影响(±s)%

表2 linc01843对HCT-8/5-FU细胞活力的影响(±s)%
注:与 0 μmol/L 5-FU 组比较,1) P<0.05;与 negative control组比较,2) P<0.05。
5-F U(μ m o l/L)0 1 6 0 0 3 2 0 0 6 4 0 0 n 6 6 6 6 n e g a t i v e c o n t r o l组1 0 0.0 0±7.7 0 8 3.4 6±5.7 0 1)7 4.6 7±5.1 7 1)6 6.4 5±6.5 9 1)s i-l i n c 0 1 8 4 3组8 9.2 5±5.5 6 2)7 4.0 9±2.9 9 2)6 6.1 1±2.5 0 2)5 4.9 2±3.7 1 2)
表3 ECSB对HCT-8/5-FU细胞活力的影响(±s)%

表3 ECSB对HCT-8/5-FU细胞活力的影响(±s)%
注:与 0 μg/mL ECSB 组比较,1) P<0.05。
E C S B/(μ g/m L)0 5 0 1 0 0 1 5 0 2 0 0 2 5 0 n 6 6 6 6 6 6细胞活力1 0 0.0 0±1.5 1 8 6.8 4±6.3 3 1)6 1.1 3±3.4 1 1)4 1.9 2±2.7 9 1)3 2.5 2±0.7 7 1)2 9.1 5±2.0 0 1)
表4 ECSB联合5-FU对HCT-8/5-FU细胞活力的影响(±s)%

表4 ECSB联合5-FU对HCT-8/5-FU细胞活力的影响(±s)%
注:与 0 μmol/L 5-FU 组比较,1) P<0.05;分别与 400、800、1 600、3 200、6 400 μmol/L 5-FU 组比较,2) P<0.05。
5-F U/(μ m o l/L)0 4 0 0 8 0 0 1 6 0 0 3 2 0 0 6 4 0 0 n 6 6 6 6 6 6 E C S B/(μ g/m L)0 1 0 0.0 0±2.3 7 8 4.3 1±5.1 0 1)8 1.1 3±2.7 5 1)7 6.1 7±1.3 6 1)7 4.4 4±1.8 9 1)7 1.7 4±2.0 8 1)5 0—7 7.6 2±4.4 5 2)7 2.7 4±5.7 8 2)7 1.1 8±2.5 0 2)6 4.4 6±6.1 3 2)6 3.2 1±2.2 0 2)1 0 0—5 1.1 7±5.5 4 2)4 9.6 9±1.2 4 2)5 1.4 5±1.6 9 2)4 8.3 3±2.3 0 2)4 6.7 9±1.9 1 2)

图3 ECSB对HCT-8/5-FU细胞中linc01843表达的影响
4 讨论
肿瘤耐药是指肿瘤细胞对一种化疗药物产生耐药性,同时对其他与之化学结构及其作用机制完全不同的药物也产生交叉耐药[14]。目前,肿瘤耐药的作用机制非常复杂,涉及到药物转运相关蛋白的异常表达、细胞增殖、凋亡以及上皮—间质转化紊乱等[15]。现阶段研究发现,lncRNA可以通过调控相关信号通路,引起肿瘤细胞增殖、凋亡以及上皮—间质转化等改变,或直接调控药物转运相关蛋白,从而对肿瘤细胞的耐药产生影响。如过表达lncRNA HOTTIP能够激活 Wnt/β-catenin信号通路,促进骨肉瘤细胞进入S期,增加其对顺铂的耐药性[16]。lncRNA H19通过靶向激活生存信号通路中的关键蛋白AKT,从而促进多发性骨髓瘤对长春新碱的耐药性[17]。LncRNA CHRF在卵巢癌顺铂耐药中的新作用是由miR-10b诱导的EMT和STAT3信号介导的[18]。LncRNA MRUL通过促进药物转运蛋白ABCB1的表达,导致化疗药物外排增加,使得胃癌细胞产生肿瘤耐药现象[19]。
Linc01843是一种lincRNA(long intergenic noncoding RNA),也被命名为 lncRNA AC005355.2,位于 chr5:134506552-134509229:+。 目前,linc01843在肿瘤研究方面的报道较少。本研究首次发现linc01843在5-FU干预后的HCT-8和 HCT-8/5-FU细胞中均呈现高表达,提示其可能和5-FU干预结肠癌细胞有关。在两株细胞中同时敲低linc01843,发现敲低linc01843后均能增强两株细胞对5-FU的敏感性,初步证实其参与了5-FU耐药的过程。
随着国家对中药研发的重视,中药联合化疗药物治疗肿瘤受到人们的广泛关注。临床研究显示,两者联合用药,可减轻化疗药物产生的毒副作用,并降低化疗药物产生的交叉耐药,同时提高患者的治愈率[20]。先前已有大量文献显示,中药能够通过调控lncRNA的表达逆转多种肿瘤对化疗药物的耐药性[5]。半枝莲是一种传统中草药,在临床以及基础实验均已证明,其能起到良好的抗癌疗效[21]。本研究发现,对5-FU存在显著耐药性的HCT-8/5-FU细胞,对ECSB不存在耐药性。ECSB联合5-FU干预HCT-8/5-FU细胞,可以显著逆转 HCT-8/5-FU细胞对5-FU的耐药性。并且,初步研究也发现,在HCT-8/5-FU 细胞中,5-FU 干预后,linc01843的表达显著上升,而ECSB联合5-FU干预后,可显著下调linc01843的表达。说明ECSB逆转大肠癌5-FU耐药的作用机制之一是通过调控linc01843的表达。由于耐药机制极其复杂,关于linc01843后续的功能以及深入的机制研究,以及半枝莲调控linc01843的表达后级联作用于下游的哪些效应蛋白而最终发挥功效,还有待进一步的探讨。
