合并不同疾病的男性骨量异常患者骨代谢、骨密度及骨折情况研究
2021-02-27李丽陈琳潘凌杨明李思雨曾越茜彭永德游利
李丽 陈琳 潘凌 杨明 李思雨 曾越茜 彭永德 游利
上海交通大学附属第一人民医院内分泌代谢科(骨质疏松亚专科),上海 200080
骨质疏松症(osteoporosis,OP)是以骨量减少、骨组织微结构破坏、骨脆性增加和易于骨折为特征的代谢性骨病,骨质疏松性骨折(脆性骨折)多发生于患者髋部、腰椎、桡骨远端、肱骨近端等部位,其发生后展现出高致残率和高死亡率,同时伴随而来的高额医疗费用已成为一种主要公共卫生负担[1]。虽然我国目前50岁以上男性和女性骨质疏松症患病率分别为6 %和32.1 %,骨量减低发生率分别为46.9 %和45.9 %,但值得注意的是男性髋部骨折后死亡率至少是同龄女性的2倍[2]。老年人作为骨质疏松症的高发人群,同时也好发包括2型糖尿病以及心脑血管病在内的其他疾病。如何在如此复杂的病情中准确快速的识别出脆性骨折风险较高的人群,并给予他们合适的预防和治疗目前已被越来越多的人所关注。本研究回顾性分析了合并不同疾病的男性骨量异常患者骨转换指标、骨密度及骨折的情况,并初步探讨了各种危险因素与脆性骨折发生之间的相关性,以期在骨质疏松症患者脆性骨折的病情检测、预防及诊断方面为临床提供依据。
1 对象与方法
1.1 对象
对2006年1月至2017年12月在上海市第一人民医院内分泌科骨质疏松亚专科就诊的男性骨量异常患者进行回顾性研究。
1.1.1纳入和排除标准:骨质疏松症纳入标准:基于世界卫生组织(WTO)推荐的诊断标准及2017年原发性骨质疏松诊疗指南标准以腰椎、股骨颈或髋部骨密度来判断,50岁以下男性用Z值判定,即Z≤-2.0,即判定为骨质疏松患者。对于大于50岁男性,用T值判定,-2.5 1.1.2分组:根据研究目的不同,将既往是否合并相应慢性病的患者分别分为有或无糖尿病组、有或无慢性肝病组、有或无慢性肾病组、有或无慢性胃病组、有或无心血管疾病组、骨量减低组和骨质疏松组。 1.2.1病史资料的收集:记录患者初诊时的年龄、身高、体重、体质量指数(body mass index,BMI)、血钙、血磷、25羟维生素D(25 hydroxy-vitamin D,25OHD)、骨密度值(腰椎、股骨颈、全髋)、骨转换标志物、脆性骨折史以及并发其他疾病等资料。 1.2.2血钙、血磷、25OHD和骨转换标志物检测:上午8:00~10:00采集入选者空腹静脉血,将血清低温离心分离后置于-80 ℃低温保存。采用电化学发光法(罗氏E170,德国)定量检测。检测指标主要包括血钙(calcium,Ca)、血磷(phosphorus,P)、血清骨钙素(bone gamma-carboxyglutamic-acid-containing proteins,BGP)、Ⅰ型胶原交联羧基末端肽(cross-linked carboxy-terminal telopeptide of typeⅠcollagen,CTX)、甲状旁腺素(parathyroid hormone,PTH)和25OHD水平。批内变异系数(coefficient of variation,CV)和批间CV均<10 %。 1.2.3尿钙/尿肌酐的测定:受检者清晨空腹排出夜间尿后不喝水,留取清晨第二次尿的中段尿,且前一天不得服用钙。尿钙的检测采用偶氮胂-III法,尿肌酐的测定采用肌氨酸氧化酶法,样本均在全自动生化分析仪(美国亚培,Abottaeroset)上测定。测定尿钙和尿肌酐方法的室内变异系数(coefficientsofvariation,CV)分别为2.15 % 和2.56 %。 1.2.4骨密度测定:采用双能X线骨密度吸收仪(GE-Lunar,Prodigy,美国)测定正位脊柱腰1~4(T1~4)和左侧全髋关节(T全部)骨密度。测量前均行体模测试,L1~4CV值为1.5 %,股骨颈CV值为1.7 %。在骨密度测量中进行严格的质量控制以排除测量误差对诊断结果的干扰,并每年进行一次质控试验。 共有928例骨量异常的男性患者符合纳入标准,如表1所示,合并T2DM患者的BMI高于不合并T2DM的患者(P<0.05),其他资料如年龄、身高、体重、钙、磷水平比较差异无统计学意义(P>0.05)。有或无合并慢性肝病、慢性肾病、心脑血管疾病的患者均只有年龄的差异(P<0.05),其他指标的差异无统计学意义(P>0.05)。而有或无合并慢性胃病的患者各项指标相比无差异(P>0.05)。骨质疏松的患者身高略高于骨量减低的患者(P<0.05),其他资料无差异(P>0.05)。从下表还可以看出,合并慢性胃病、心脑血管疾病和骨质疏松症的患者骨折发生率更高,但是这种差异无统计学意义(P>0.05)。 表1 合并不同疾病的男性骨量异常患者临床基本资料比较Table 1 Comparison of basic clinical data of male patients with abnormal bone mass with different 合并T2DM的患者与对照组相比,BALP显著降低(P<0.05),但L1~4、股骨颈及全髋的骨密度却明显增高(P均<0.05);有无合并慢性肝病的患者各项骨转换指标和骨密度之间的差异无统计学意义(P均>0.05);合并慢性肾病的患者与对照组相比,β-CTX、BGP、PTH均明显升高且差异有统计学意义(P均<0.05);合并慢性胃病的患者与对照组相比,全髋BMD明显降低且有统计学差异(P<0.05);合并心脑血管疾病的患者与对照组相比,尿钙/尿肌酐显著降低(P<0.05),而其余指标无差异(P均>0.05);与骨量减低的患者相比,骨质疏松组的β-CTX、25OHD、BALP显著降低(P均<0.05),而BGP、PTH却明显增高(P均<0.05),其余指标的差异无统计学意义(P均<0.05)。见表2。 表2 合并不同疾病的男性骨量异常患者的骨转换指标与骨密度的比较Table 2 Comparison of bone conversion indexes and bone mineral density in male patients with abnormal bone mass of different 单因素回归分析提示患者年龄、体重、L1~4BMD、股骨颈BMD、全髋BMD、β-CTX、慢性胃病、骨质疏松是骨折史的影响因素,差异具有统计学意义(P<0.05),且提示骨折史与患者年龄、β-CTX、慢性胃病、骨质疏松B值为正值,呈正相关,与体重、L1~4BMD、股骨颈BMD、全髋BMD呈负相关,与其余指标无统计学意义。见表3。 表3 骨折史与单因素骨相关指标Logistic回归分析Table 3 Logistic regression analysis of fracture history and univariate bone-related indicators 续表 将上述相关分析中P<0.1的指标纳入回归分析,而临床经验认为合并糖尿病的患者骨折风险高,因此也将糖尿病纳入回归分析,见表4,可得出年龄(OR=1.027,P=0.029)、BALP(OR=1.011,P=0.022)、T2DM(OR=2.26,P=0.03)、骨质疏松(OR=1.014,P=0.014)均是骨折的危险因素,而25OHD水平(OR=0.315,P=0.008)是保护因素。 表4 骨折史的Logtistic二元回归分析Table 4 Logtistic binary regression analysis of fracture history 在男性中,由于骨密度减低而导致骨折发生的危险因素有很多,例如年龄、体重减轻、缺乏运动、合并慢性肝病、慢性肾病、慢性胃炎、糖尿病、甲状腺功能障碍、COPD、类风湿关节炎,或者长期使用皮质类固醇、5-羟色胺再摄取抑制剂以及雌激素缺乏等,骨密度减低或骨吸收增加也会增加心血管疾病的风险,同时还会增加骨折的风险[3-10]。因此对于男性患者,需要全面评估他们合并的基础疾病的情况,进行个体化分析与治疗。 许多研究[11-14]已经证实在老年男性中,高水平骨转换可能是骨丢失和骨质疏松症的主要决定因素,与本研究的结果一致。本研究还发现年龄是骨折发生的危险因素,可能的机制[10,15]有:增龄可抑制成骨细胞增殖,诱导成骨细胞凋亡,也可以抑制破骨细胞分化和骨吸收,使得骨转换水平迅速下降,还可增加骨硬化蛋白的表达,最终导致骨质量受损和脆性增加。 许多研究[15-17]表明T2DM的患者骨代谢降低,骨密度正常或较高,但骨折风险增加,本研究的结果也支持这一观点。另外,Hitomi等[18]的研究发现T2DM患者的全因死亡率增加与骨密度降低和严重椎体骨折有关。其机制可能是[10,15-17]:慢性高血糖可抑制间充质干细胞的成骨分化,且加速非酶糖基化的过程;其次,慢性炎症、胰岛素抵抗、氧化应激、晚期糖基化终产物导致骨微结构的恶化;并且OC、瘦素和胰岛素也可干扰骨代谢。 此外,有许多研究[19-21]发现慢性胃炎与骨质疏松和骨折发生有关,本研究的相关性分析也证实了这一点。首先,胃粘膜萎缩可导致胃酸分泌减少,进而抑制钙的吸收;其次,幽门螺旋杆菌可增加促炎性因子、TNF、IL-1、IL-6的释放,这些因子均可激活破骨细胞分化,最终增加骨吸收,降低骨量。同样,长期使用质子泵抑制剂也与骨密度下降和骨折发生有关。 另有证据[18,22]表明,骨质疏松症、心脑血管疾病和死亡率之间存在着关系。高胆固醇水平可破环骨的微结构、降低骨强度,增加男性高转化性骨质疏松症的风险。同时,成骨样细胞以及包括骨钙素(OC)在内的几种骨细胞产生的蛋白也存在于动脉粥样硬化病变的血管中。虽然本研究未发现心脑血管疾病与骨质疏松性骨折的显著关系,可能是由于样本量少的缘故,未来可以加大样本进一步研究。 慢性肾脏疾病(CKD)的骨代谢异常通常与PTH分泌不足或分泌过多有关。研究[23-24]表明,CKD患者的BALP和PTH显著升高,骨折风险增加,与本研究结果一致。此外,PTH分泌不足,尤其是在终末期肾病患者中,低水平的骨转换对骨骼同样有不利影响[10]。另有研究[25-26]发现,非酒精性脂肪肝或慢性肝炎患者的骨密度减低,容易发生骨质疏松,可能与胰岛素抵抗和慢性炎症有关,但确切的病理生理机制还不清楚。 另外,骨质疏松症是老年慢性阻塞性肺疾病患者常见的肺外效应之一。许多研究[9,27]发现COPD患者的骨密度明显低于正常人群,更容易发生骨质疏松和椎体骨折,从而使患者胸腔容积减少,进一步危及肺功能。这可能与持续缺氧、全身慢性炎症、25OHD水平、高血糖、运动能力下降、频繁使用糖皮质激素等因素有关。由于本次明确诊断为COPD的患者较少,并未纳入研究,今后可进一步关注此类患者,将其纳入研究中。 综上,在男性骨量异常患者中,对于年龄较大、β-CTX和BALP水平较高、合并慢性胃病以及2型糖尿病的患者,应积极进行抗骨质疏松干预及治疗,以减少此类患者骨折的发生率。1.2 方法
1.3 统计学方法
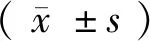
2 结果
2.1 合并不同疾病的男性骨量异常患者临床基本资料比较

2.2 合并不同疾病的男性骨量异常患者骨转换指标与骨密度的比较

2.3 骨折史与单因素骨相关指标Logistic回归分析
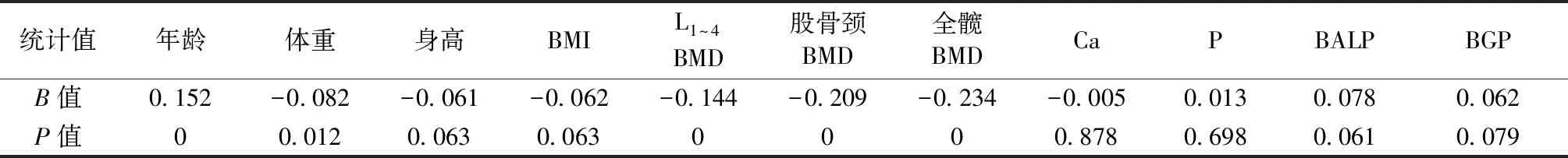

2.4 骨折史的二分类Logistic回归分析

3 讨论
