Raji-MG63细胞共培养体系中心肌营养蛋白样细胞因子1(CLCF1)对RANKL/OPG比值及成骨细胞分化的影响
2021-02-27陈娟叶云金谢丽华陈赛楠葛继荣许惠娟
陈娟 叶云金 谢丽华 陈赛楠 葛继荣 许惠娟
福建省中医药科学院骨质疏松证候基因组学重点研究室,福建 福州 350003
2000 年Arron[1]首次提出“骨免疫学”概念,讲述了骨骼系统与免疫系统之间的相互关系,在维持骨代谢平衡过程中,免疫因素发挥着重要作用。B 淋巴细胞、T淋巴细胞、细胞因子和趋化因子等均能与成骨细胞、破骨细胞相互作用,调节骨形成和骨吸收[2-3]。其中,骨保护素(osteoprotegerin,OPG)/核因子κB受体活化因子配体(receptor activator of NF-κB ligand,RANKL)系统是骨代谢与免疫系统之间的桥梁[4]。OPG 主要来源于骨微环境内B 细胞及浆细胞,对骨有保护作用。成骨细胞分泌RANKL,可激活破骨细胞和单核巨噬细胞(破骨细胞前体细胞)膜表面的RANK受体,引起破骨细胞活化。
心肌营养蛋白样细胞因子1(cardiotrophin-like cytokine factor 1,CLCF1)基因属于白细胞介素6(IL-6)细胞因子家族成员,是一种B细胞刺激剂,与神经内分泌免疫调节密切相关[5-6]。课题组前期研究发现,CLCF1 是绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)肾阴虚证关联基因[7]。但CLCF1基因参与PMOP的具体机制尚不清楚。本研究通过构建Raji-MG63细胞共培养体系,研究CLCF1基因对RANKL/OPG比值和成骨细胞分化的影响。旨在从骨免疫角度,探讨CLCF1 对OPG/RANKL/RANK信号系统的调控机制,阐明PMOP的骨免疫机制。
1 材料与方法
1.1 试剂与仪器
人B淋巴瘤细胞Raji细胞、人骨肉瘤细胞 MG63均购自中国科学院上海生命科学研究院细胞资源中心;MEM培养基(GIBCO公司);胎牛血清(fetal bovine serum,FBS,GIBCO公司);青链霉素(Invitrogen公司);CRISPR/Cas9慢病毒系统(上海吉凯基因化学技术有限公司);CLCF1、OPG、RANKL、JAK2、p-JAK2 STAT3、p-STAT3、GAPDH抗体(Abcam公司);碱性磷酸酶检测试剂盒(上海碧云天生物技术有限公司);茜素红(南京凯基)。
1.2 方法
1.2.1CLCF1基因敲除Raji细胞株的构建:Raji细胞用含10 % FBS、1 %双抗的RPMI-1640培养基,置于含5 % CO2孵箱中以37 ℃恒温培养。CRISPR/ Cas9基因编辑技术介导的CLCF1基因敲除Raji细胞株的构建,参考文献[8]。CLCF1 sgRNA 序列5’-TTGAAGTCTGGCTCGTTGAA-3’。实验分2组:对照组(Control组)和CLCF1敲除组(CLCF1-KO组)。转染前先将Raji细胞接种于6孔板中,Control组和CLCF1-KO组按照感染复数(multiplicity of infection,MOI)100,分别感染CRISPR/ Cas9-CLCF1慢病毒及相应阴性对照慢病毒。24 h后换正常培养液,转染72 h后通过荧光显微镜及FCM观察感染效率,并收取细胞进行相关检测。
1.2.2Raji-MG63细胞共培养体系的构建:应用Transwell 实验建立共培养体系,将Raji细胞种植于24孔板Transwell小室上层,下层为成骨细胞系MG63,细胞以完全培养基(RPMI1640培养基+10 %胎牛血清+1 %双抗)常规培养。
1.2.3Western blot检测蛋白水平:运用RIPA裂解法提取转染后各组细胞总蛋白,定量蛋白浓度。取40 μg蛋白样品,110 V、120 g/L SDS-PAGE分离蛋白70 min。采用湿转系统,100 V恒压转膜 60 min,50 g/L脱脂奶粉室温封闭1 h;分别加入CLCF1抗体(1∶1 000)、OPG抗体(1∶1 000)、JAK2、p-JAK2 STAT3、p-STAT3抗体(均1∶1 000)、RANKL抗体(1∶500)和GAPDH抗体(1∶2 000)。4 ℃孵育过夜;1×TBST 漂洗3次,加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗(1∶4 000),常温孵育1 h;1×TBST 漂洗4 次,避光条件下化学发光检测,并进行灰度值分析。以GAPDH作为内参计算目的蛋白相对灰度比值[9]。
1.2.4ALP活性检测:参考碧云天碱性磷酸酶检测试剂盒说明书,收集各组细胞,计数后,添加150 μL 0.2 %Triton X-100裂解细胞,4 ℃,15 000 r/min离心15 min,收集上清液作为样品;向96孔板内添加50 μL底物、30 μL缓冲液和20 μL样品,在微孔板震荡器上充分振荡1 min后,37 ℃孵育15 min;添加100 μL反应终止液,在微孔板震荡器上充分振荡1 min后,酶标仪测量405 nm处的吸光值;同样方法进行空白(蒸馏水)对照和标准品的检测,实验数据取ALP活性与细胞蛋白总量的比值进行统计分析。
1.2.5茜素红染色:细胞用PBS洗2次;每孔加入2 mL 4 %中性甲醛溶液,固定30 min;吸走中性甲醛溶液,用PBS洗2次;每孔加入1 mL茜素红染液染3~5 min;吸走茜素红染液,用PBS洗2次;每孔加入 1 mL 10 %十六烷基吡啶,轻微摇晃 10 min 洗脱染料,吸取200 μL 加入96孔板中,分光光度计检测 540 nm 处吸光值。
1.3 统计学处理
2 结果
2.1 抑制CLCF1基因表达对RANKL/OPG比值和JAK2/STAT3通路的影响
CRISPR/ Cas9-CLCF1慢病毒感染Raji细胞72 h后,Western blot结果显示,与对照组相比,CLCF1基因敲除组CLCF1蛋白表达水平显著降低,差异有统计学意义(图1 A),提示成功建立CLCF1基因敲除的Raji细胞株。
为探讨CLCF1基因对RANKL/OPG和JAK2/STAT3通路的调控作用,笔者检测了相关蛋白的表达变化。结果显示,与对照组相比,CLCF1基因的敲除显著降低OPG的表达,但对RANKL的表达影响轻微(图1 A,图1B)。与对照组相比,CLCF1基因敲除增加了RANKL/OPG比率(图1C)。此外,CLCF1基因敲除组,p-JAK2 和p-STAT3水平均减少(图1 A),p-JAK2/JAK2和p-STAT3/STAT3比值降低(图1B)。说明抑制CLCF1表达,会抑制JAK2/STAT3通路的激活,并影响RANKL/OPG的比值。
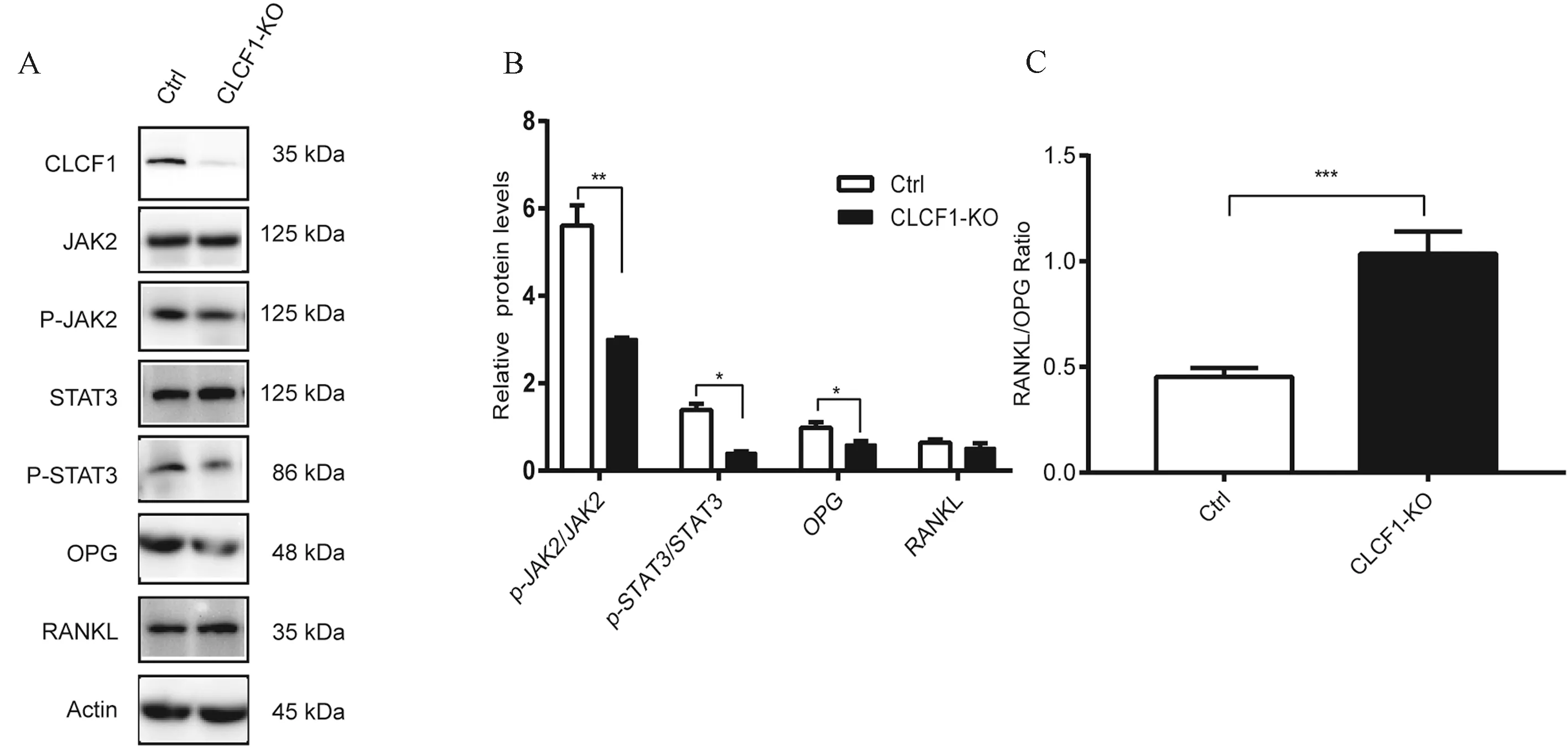
图1 CLCF1对JAK2/STAT3通路和RANKL/OPG比值的影响A:Weste blot分析CLCF1基因敲除对JAK2/STAT3通路及RANKL和OPG影响;B:相对蛋白质水平的定量分析;C:Weste blot分析显示CLCF1基因敲除对RANKL/OPG比值的影响。注:*P<0.05,**P<0.01,***P<0.001。Fig.1 Effects of CLCF1 on the JAK2/STAT3 pathway and RANKL/OPG ratio
2.2 抑制CLCF1基因表达对成骨细胞分化的影响
为了探讨CLCF1基因能否通过RANKL/OPG系统影响成骨细胞分化,笔者通过Transwell小室建立了Raji-MG63细胞共培养系统。通过碱性磷酸酶(ALP)活性和茜素红S染色水平分析MG63细胞成骨分化能力。结果表明,与对照组相比,CLCF1基因敲除组MG-63细胞ALP活性降低(图2 A)。钙结节的数量和体积明显低于对照组,茜素红半定量结果显示CLCF1基因敲除组成骨能力弱于对照组,差异有统计学意义(图2B)。提示抑制CLCF1基因表达能抑制成骨细胞分化。WB结果显示,CLCF1基因敲除组MG63细胞OPG蛋白表达水平明显降低,RANKL蛋白上调,RANKL/OPG 比值升高;同时,p-JAK2/JAK2和p-STAT3/STAT3比值降低。与对照组比较,差异具有统计学意义(图2C)。
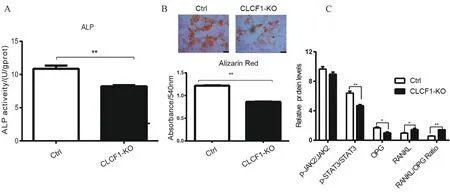
图2 CLCF1基因敲除对Raji-MG-63共培养体系中MG-63细胞成骨分化的影响A:MG63细胞JAK2/STAT3通路和RANKL/OPG的相对蛋白水平的定量分析;B:MG-63细胞ALP活性评价成骨能力的分析;C:茜素红染色分析MG63细胞成骨能力。注:*P<0.05,**P<0.01,***P<0.001。Fig.2 Effect of CLCF1 gene knockout on osteogenic differentiation of the MG-63 cells in the Raji-MG-63 co-culture system
3 讨论
CLCF1作为IL-6家族的细胞因子,参与调节B细胞的增殖和运动神经元的发育。然而,CLCF1在骨代谢的生理和病理学中的作用尚待明确。本研究结果表明,抑制 CLCF1的表达能使JAK2/STAT3通路失活、RANKL/OPG比值升高。此外,CLCF1基因敲除能抑制成骨细胞分化。提示CLCF1可能通过调节RANKL/OPG平衡在免疫介导的骨代谢中发挥作用。
骨免疫学的概念指出,骨质疏松症、类风湿关节炎和牙周炎等慢性炎症性疾病通过激活免疫细胞合成的细胞因子来诱导骨丢失[10-11]。在这方面,许多被认为与骨免疫相关的细胞因子,如白细胞介素6(IL-6)[12]、肿瘤坏死因子α(TNF-α)[13]、巨噬细胞集落刺激因子(M-CSF)[14]、核因子-κB受体激活剂(RANK)及其配体(RANKL)[15]都被发现参与了这一生物学过程。OPG/RANK/RANKL通路在骨免疫中的作用已被广泛报道。RANKL负责刺激破骨细胞分化和骨吸收,而OPG通过阻断RANKL抑制骨吸收。OPG、RANKL 和其唯一受体RANK是调节破骨细胞分化成熟的重要信号系统,在骨质疏松中起重要作用[16]。RANKL能激活单核巨噬细胞(破骨细胞前体细胞)膜表面的RANK受体,促进破骨细胞的活化[17]。RANKL作为一种重要的细胞因子,能调节T细胞和早期阶段B细胞的发育和功能,对免疫系统发育也起着起重要作用。OPG与RANK竞争性地结合RANKL,阻断RANKL与RANK结合,从而抑制破骨细胞前体细胞的分化,起到抑制骨吸收的作用[18]。因此OPG/RANKL/RANK信号系统被认为是骨免疫研究的介入点。
作为IL-6细胞因子家族的一员,CLCF1在免疫细胞中高表达。CLCF1的作用主要在于支持运动神经元的生存和发育。同时,CLCF1在免疫调节功能和B细胞扩张中也发挥重要作用,影响B细胞群的存活和分化[19]。研究[20]表明,由 B细胞所表达的RANKL促进破骨前体细胞分化,并引发骨吸收。在骨骼生物学中起着至关重要的作用。IL-6家族的成员,包括睫状神经营养因子(CNTF)、白血病抑制因子(LIF)、心肌营养素-1(CT-1)和肿瘤抑制素M(OSM)等已被证明能在病理条件下刺激成骨细胞分化并促进骨吸收[21-22]。和其他IL-6家族细胞因子不同的是,关于CLCF1在骨代谢中作用的数据甚少报道。本研究结果表明,抑制CLCF1基因表达,会引起RANKL/OPG比值失调。因此,笔者推测,CLCFI基因可能通过调节B细胞RANKL/OPG的平衡,从而在骨免疫和骨代谢中发挥重要作用。
CLCF1也参与JAK/STAT级联反应的调节。Mukut Sharma等[23]的研究表明,CLCF1诱导的STAT3磷酸化。CLCF1作为潜在循环因子,促进肾小球足细胞中的JAK/STAT信号通路,在人类肾脏疾病局灶节段性肾小球硬化(FSGS)发生发展过程中发挥作用[24]。JAK2/STAT3通路在骨质疏松症的发生和发展中起着重要作用。最近的研究[25-26]表明JAK2/STAT3通路能调节RANKL水平并增强破骨细胞的分化。此外,本研究结果表明,CLCF1基因敲除后,抑制了JAK2/STAT3通路的激活。提示CLCF1可能通过JAK2/STAT3调控RANKL/OPG的表达,进而影响骨代谢,这一点有待于后续深入的研究。
综上所述,本研究结果显示CLCF1可能是骨免疫调控基因,通过调控B淋巴细胞,影响OPG的生成,继而影响RANKL/OPG的平衡和成骨分化,参与骨代谢过程。这些结果为免疫-骨骼相互作用的机制提供了新的理解,并为CLCF1作为病理性骨丢失的创新治疗靶点提供了前景。
