高效液相色谱-串联质谱法测定动物源性食品中3种β-受体激动剂的残留
2021-02-27刘婧
刘 婧
1.苏州世标检测技术有限公司 江苏苏州 215168 2.苏州海关综合技术中心 江苏苏州 215168
β-Agonists是一种苯乙胺类药物,更是一种生长促进剂,常用于治疗支气管哮喘,Clenbuterol是最开始被添加于饲料中的β-受体激动剂,渐渐的Ractopamine、Salbutamol也被添加[1~3],用该饲料喂养动物时,可以提高瘦肉产率,但是这类肉制品摄入人体后会造成严重影响,危害生命健康[4,5]。因此,为了消费者的安全,规定β-受体激动剂不得使用。
本文改进了实验方法和质谱条件,更为快速高效的检测β-Agonists残留量。
1 试验部分
1.1 仪器与试剂
1.1.1 仪器和耗材
电子天平ML204/02,梅特勒公司;
恒温水浴锅,上海博讯公司;
超纯水仪Milli-Q,美国公司;
涡旋仪,IKA公司;
离心机,湖南湘仪集团;
氮吹仪N-EVAP,美国Organomation公司;
液质联用仪6470,美国安捷伦公司。
色谱柱:Waters C18柱,100mm×2.1mm,5μm。
固相萃取柱:60mg/3mL Waters Oasis HLB、60mg/3mL Waters Oasis MCX、60mg/3mL AgelaPCX。
1.1.2 试剂
沃凯:乙酸铵、正己烷(色谱纯)。
国药:高氯酸、盐酸(优级纯)。
阿拉丁:甲酸(色谱纯)。
Fisher chemical:甲醇、乙酸乙酯(色谱纯)。
Sigma alorich:氨水(色谱纯)、β-葡萄糖醛甙霉。
1.1.3 标准物质
标准物质相关信息见表1。
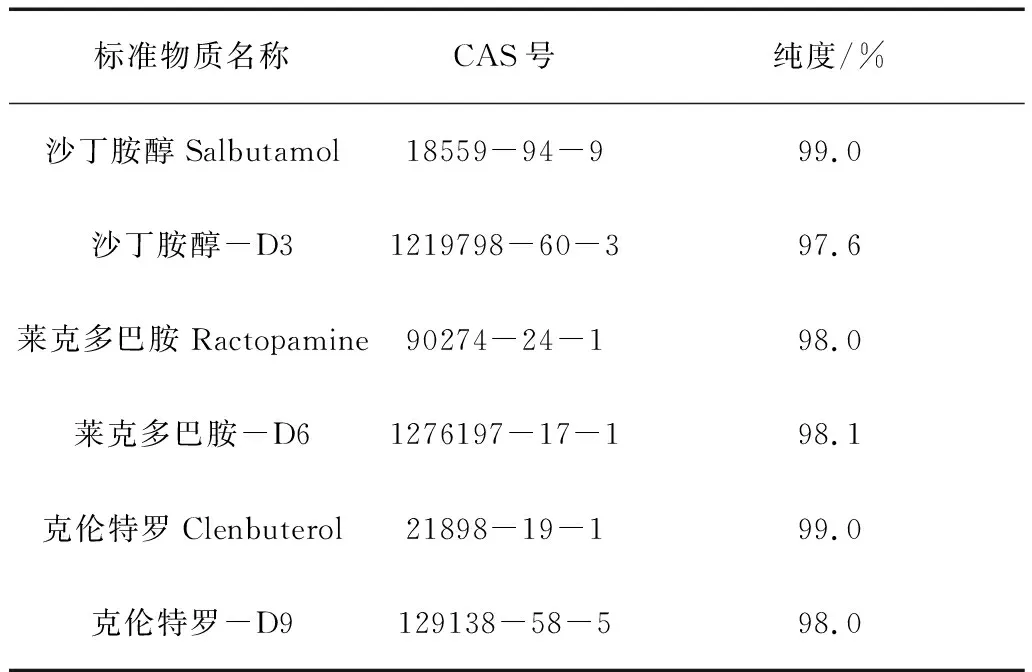
表1 标准物质相关信息
1.2 标准溶液配制
标准储备溶液:准确称取上述标准物质,用甲醇溶解定容配成1 000mg/L的标准溶液,并于-20℃保存。临用时稀释成0.1mg/L的标准混合溶液。
内标储备溶液:准确称取上述同位素标准物质,用甲醇溶解定容配成1 000mg/L的标准溶液,并于-20℃保存。临用时稀释成0.1mg/L的标准混合溶液。
1.3 实验方法
酶解:称取试样5.0g→加入0.8mL乙酸铵溶液(2.0mol/L)→7.2mL超纯水→40μL β-葡萄糖醛甙霉→涡旋混匀→置于37℃恒温水浴锅中酶解16h。
提取:取出酶解样品后→冷却至室温→加入0.1mg/L内标储备混合溶液100μL 0.1mg/L标准储备混合溶液25μL→再加入5mL高氯酸溶液(1mol/L)→涡旋混匀→9 500r/min离心10min→取上清液经装有脱脂棉的漏斗过滤,滤液备用。
净化:将上述滤液采用固相萃取柱过滤洗脱,过程见表2;洗脱液氮吹干,用2mL水溶解残渣,过膜,用于液相色谱-串联质谱分析。

表2 固相萃取净化方法
1.4 高效液相色谱及质谱条件
1.4.1 色谱条件
流动相:0.1%甲酸水、0.1%甲酸乙腈。
进样量:20.0μL。
柱温:25℃。
梯度洗脱程序见表3。
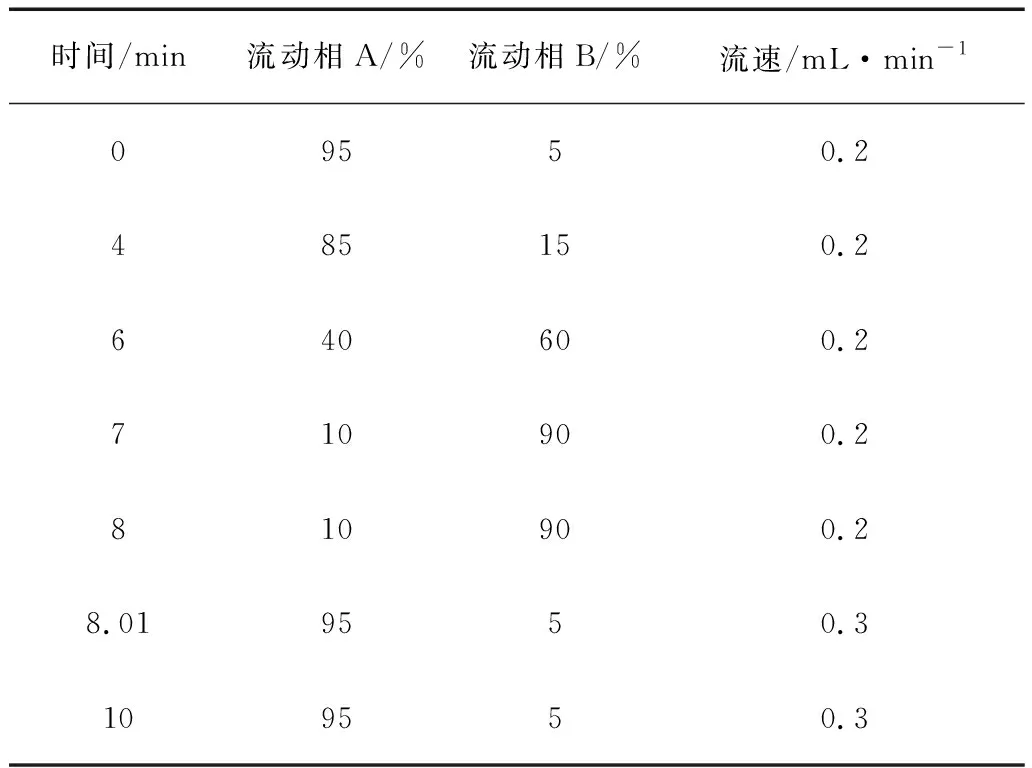
表3 梯度洗脱表
1.4.2 质谱条件
电离源:ESI电喷雾方式。
扫描方式:MRM多反应监测。
电喷雾电压:3 500V。
鞘气温度:300℃。
鞘气流速:30L/min。
干燥气流速:10L/min。
干燥气温度:350℃。
监测离子:被测物质的质谱分析参数见表4。
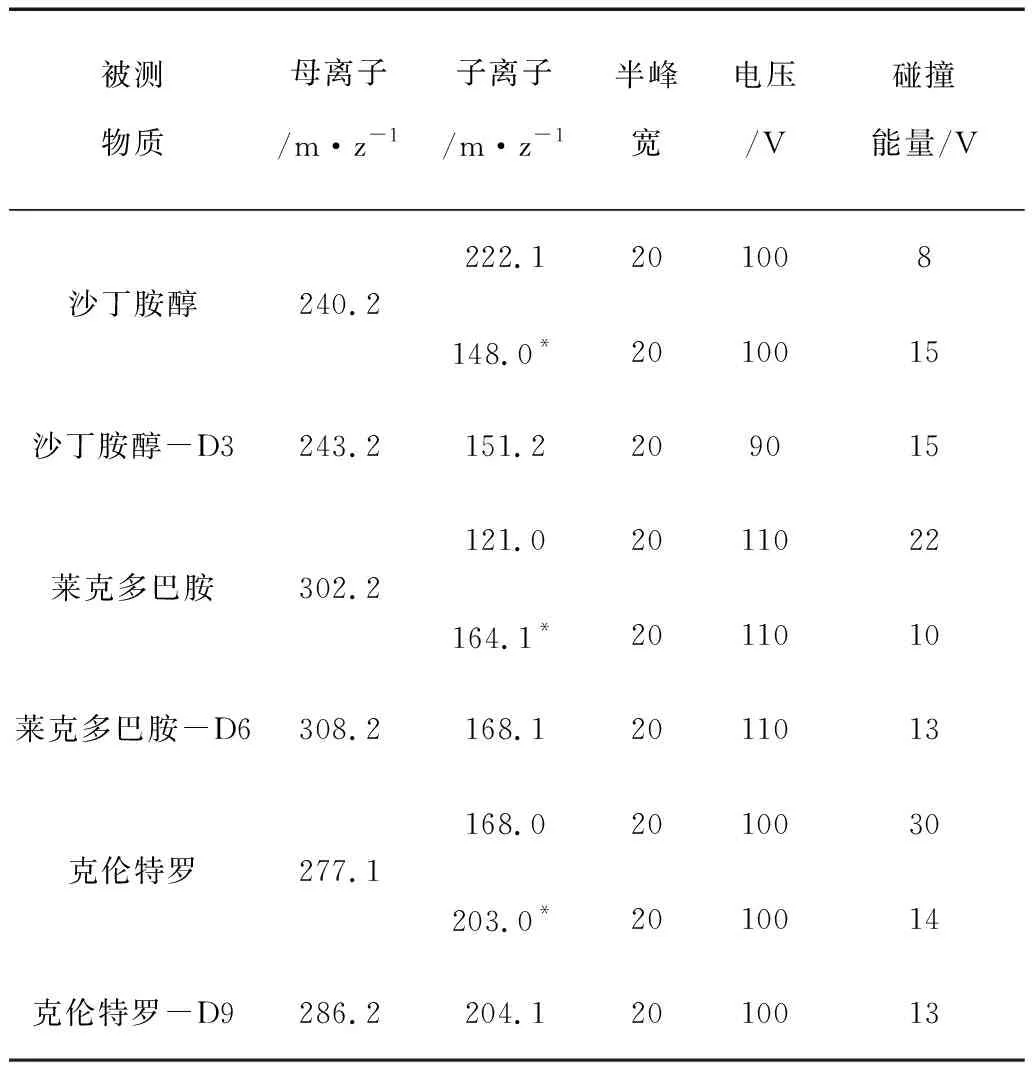
表4 被测物质的质谱分析参数
2 结果分析讨论
2.1 前处理及检测条件的选择
2.1.1 流动相的选择
根据现有的相关标准,采用了几种不同流动相进行实验。流动相分别选用了0.1%甲酸水+0.1%甲酸乙腈、0.1甲酸水+乙腈,经过实验发现0.1%甲酸水+0.1%甲酸乙腈峰形较好。
2.1.2 固相萃取柱的选择
采用相同的步骤,分别使用3种固相萃取柱,发现MCX分离效果最好,浓度响应值较高,PCX次之,HLB不适用。
2.1.3 淋洗液的选择
采用MCX柱,进行不同的净化过程见表5。方法4试剂少、简单、分离效果较好且样品损失较少,峰响应值较高。加标0.5g/kg的样品提取色谱图见图1,各组分的MRM图见图2。

表5 MCX柱的不同净化方法
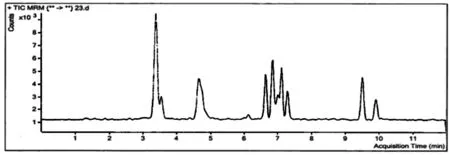
图1 加标0.5g/kg的样品提取色谱图

图2 样品各组分的MRM图
2.2 方法的线性范围
将3种β-受体激动剂,按检出限用水稀释成相应的浓度见表6;以化合物峰面积定量,绘制标准曲线,3种化合物的线性回归方程见表7。

表6 标准曲线配制表
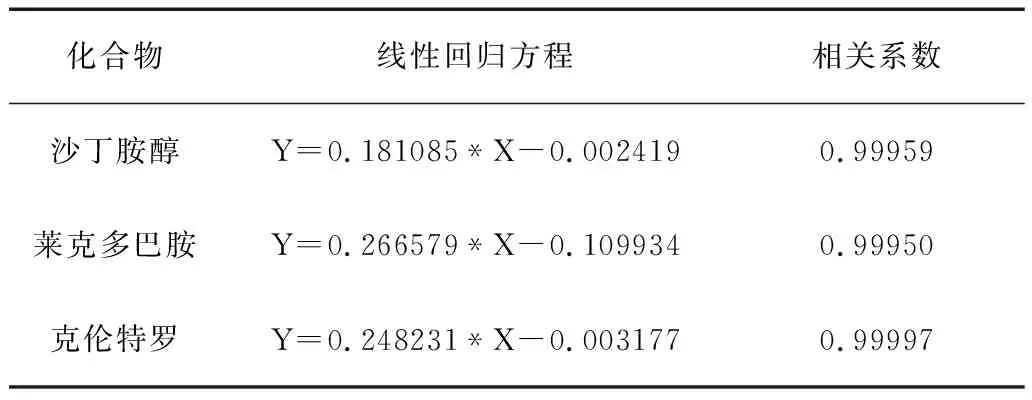
表7 3种化合物的线性回归方程
2.3 方法回收率和精密度
向阴性样品中添加检出限的1倍、2倍、10倍3种浓度的标准混合溶液,分别测定3次,计算各个化合物的回收率和RSD,结果见表8。
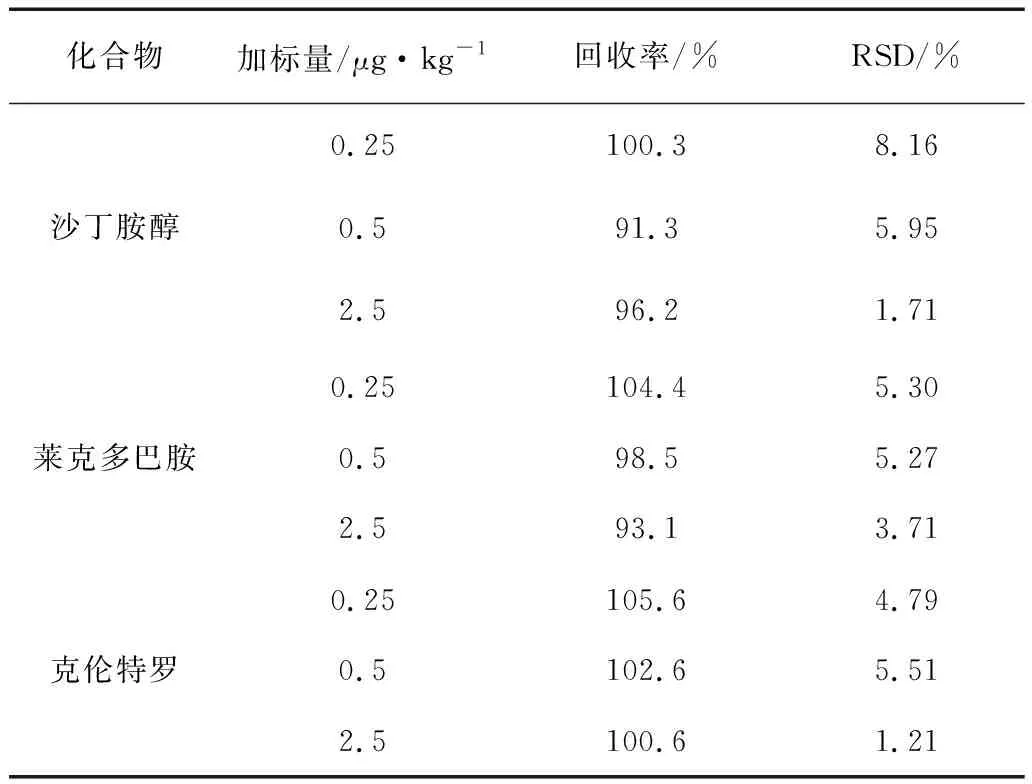
表8 回收率和精密度的试验结果
3 结论
本实验建立了动物源性食品中3种β-受体激动剂的残留量的LC-MS分析方法,该方法前处理简单,重复性好,回收率高,满足检测要求。
