苦参碱调控Wnt/β⁃catenin途径抑制宫颈癌细胞系Caski细胞侵袭迁移
2021-02-26郑荣芳张芸中樊学芬郭钰珍
郑荣芳,刘 伟,张芸中,樊学芬,郭钰珍*
1兰州大学第二医院妇科,2麻醉科,甘肃 兰州 730000
宫颈癌是妇女最常见的恶性肿瘤之一,起源于宫颈腺柱状上皮、鳞状上皮以及储备细胞,其恶性程度较高,呈浸润生长且易发生转移[1]。已有大量研究表明肿瘤发生侵袭迁移与Wnt/β⁃catenin通路具有重要关系,该通路异常直接影响肿瘤的转移[2]。Wnt/β⁃catenin信号通路变化能够促进宫颈癌的发生发展[3],β⁃catenin 作为转导途径的核心元件参与调节该通路[4],从而促进宫颈癌的发生发展[5]。Wnt2B可以通过经典Wnt 途径调节肿瘤的发生发展,Wnt/β⁃catenin 通路激活后,胞浆中的β⁃catenin 表达上调[6],GSK⁃3β作为β⁃catenin 上游重要的负性调控因子,其失活与β⁃catenin 的表达呈正相关[7]。
苦参碱(matrine)是一个四环的喹嗪啶类生物碱,广泛存在于豆科植物苦参、山豆根和苦豆子中[8]。苦参碱具有广泛的药理作用,如抗炎、抗肝纤维化、镇痛和抗心律失常等,苦参碱制剂不良反应较少,应用广泛[9]。已有研究表明其具有良好的抗肿瘤特性,参与调节肿瘤增殖、凋亡、血管生成、侵袭迁移等相关的多条信号通路[10-14]。且有研究表明,苦参碱在人白血病细胞、乳腺癌以及人鼻咽癌细胞中,均可通过抑制Wnt/β⁃catenin 信号通路的激活降低癌细胞生长活性和诱导其分化[15]。故本研究将基于Wnt/β⁃catenin 信号通路研究苦参碱抑制宫颈癌细胞系Caski细胞侵袭迁移的分子机制。
1 材料和方法
1.1 材料
人宫颈癌细胞系Caski 细胞购于中国科学院典型培养物保藏委员会细胞库。苦参碱(上海源叶公司);MTT、二甲亚砜(dimethyl sulfoxide,DMSO)、DMEM 高糖培养基(北京索莱宝生物科技有限公司);Transwell 小室(Millipore 公司,美国);基质胶(Matrigel,BD 公司,美国);胎牛血清(fetal calf se⁃rum,FBS,浙江天杭生物科技股份有限公司);MMP⁃9 ELISA 试剂盒、VEGF ELISA 试剂盒(上海酶联生物科技有限公司);RIPA 裂解液、SDS⁃PAGE 凝胶试剂盒、山羊抗兔二抗(上海碧云天生物技术有限公司);TRIzol、逆转录试剂盒、实时荧光定量PCR试剂盒(大连宝生物工程有限公司);兔抗β⁃catenin 单克隆抗体、兔抗p⁃β⁃catenin 单克隆抗体(Abcam 公司,英国)。引物序列:GSK⁃3β上游5′⁃CACCTCTGGC⁃TACCATCCTTAT⁃3′,下游5′⁃ATTATTGGTCTGTC⁃CACGGTCT⁃3′;Wnt2B 上游5′⁃GTGTCCTGGCTG⁃GTTCCTTA⁃3′,下游5′⁃AGCTGGTGCAAAGGAA⁃AGAA⁃3′;GAPDH 上游5′⁃AAGGCTGTGGGCAAGG⁃3′,下游5′⁃TGGAGGAGTGGGTGTCG⁃3′。
1.2 方法
1.2.1 MTT细胞增殖实验
取对数生长期细胞消化成单细胞悬液,计数后配制成1.5×105个/mL,以每孔100 μL 加入96 孔板中,37 ℃、饱和湿度、5%CO2细胞培养箱培养24 h后,分别以0.1、0.2、0.4、0.8、1.6 g/L 终浓度加入苦参碱,每组设6 个平行孔,加入相同体积的溶媒作为空白对照,分别处理24、48、72 h后,每孔加入20 mL MTT溶液(5 mg/mL),继续培养4 h后,弃去上清,每孔加入150 μL DMSO 溶解MTT,于490 nm 处检测光密度(optical density,OD)值,计算抑制率,抑制率=[(OD空白组-OD实验组)/OD空白组]×100%。
1.2.2 细胞侵袭实验
将Transwell 小室放入24 孔板,4 ℃预冷后,上室加入1∶4 稀释的Matrigel,待凝固后,上室加入无血清培养基配制的细胞悬液400 μL,下室加入20%FBS 的培养基,待细胞沉降后上室分别加入0.4、0.8 g/L 终浓度苦参碱,每组设6 个平行孔,加入相同体积的溶媒作为空白对照,处理24 h后,取出小室,磷酸缓冲盐溶液(phosphate buffer saline,PBS)漂洗后-20 ℃预冷甲醇固定5 min,用棉签轻轻拭去上室未迁移的细胞,结晶紫染色5 min,PBS 漂洗,拍照,计数。
1.2.3 细胞迁移实验
将Transwell小室放入24孔板孔,上室加入无血清培养基配制的细胞悬液400 μL,下室加入20%FBS的培养基,待细胞沉降后上室分别加入0.4、0.8 g/L终浓度苦参碱,每组设6个平行孔,加入相同体积的溶媒作为空白对照,处理24 h 后,取出小室,PBS 漂洗后-20 ℃预冷甲醇固定5 min,用棉签轻轻拭去上室未迁移的细胞,结晶紫染色5 min,PBS漂洗,于倒置显微镜观察拍照,统计细胞迁移率。
1.2.4 ELISA实验
取对数生长期细胞,加入0.4、0.8 g/L 终浓度苦参碱,加入相同体积的溶媒作为空白对照,处理24 h后,收集无血清培养基,参照ELISA试剂盒说明书检测培养基中MMP⁃9、VEGF含量。
1.2.5 qRT⁃PCR实验
取对数生长期细胞,加入0.4、0.8 g/L 终浓度苦参碱,加入相同体积的溶媒作为空白对照,处理24 h后,加入1.5 mL TRIzol 于冰上吹打细胞,室温静置5 min,13 000 r/min离心5 min,吸取上清,加入氯仿,静置离心,吸取上清加入异丙醇,静置离心,弃去上清,75%乙醇清洗沉淀,离心弃上清,保留沉淀干燥,用DEPC 水溶解。然后按照TaKaRa 反应试剂盒依次经过去除基因组DNA 反应、反转录反应和qPCR进行扩增,扩增程序为:95 ℃10 min 预变性;95 ℃15 s,60 ℃15 s,72 ℃30 s 40个循环。2-ΔΔCt计算基因的表达量,其中ΔΔCt=(待测样品目的基因的Ct 平均值-待测样本看家基因的Ct 平均值)-(对照样品目的基因的Ct 平均值-对照样本看家基因的Ct 平均值)。
1.2.6 Western blot实验
取对数生长期细胞,加入0.4、0.8 g/L 终浓度苦参碱,加入相同体积的溶媒作为空白对照,处理24 h后,加入RIPA裂解液,置于冰上研碎至匀浆后,4 ℃放置30 min,13 000 r/min 离心10 min,取一部分上清,BCA 试剂盒检测蛋白浓度,另取部分上清加入4×上样缓冲液,煮沸变性后,加到4%浓缩胶浓缩,10%分离胶分离,再经过转膜、封闭,4 ℃孵育一抗(其中β⁃catenin抗体以1∶2 500稀释,p⁃β⁃catenin抗体以1∶1 000稀释),室温孵育二抗,ECL发光液显色,X医用胶片显影、定影等步骤,最后进行拍照分析。
1.3 统计学方法
采用SPSS21.0统计软件进行统计分析,所有数据均以均数±标准差()表示,多组间比较采用单因素方差分析,两两比较采用LSD⁃t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 苦参碱对Caski细胞增殖的影响
随着苦参碱浓度的不断升高,Caski细胞增殖抑制率呈逐渐增大的趋势。在苦参碱浓度>0.1 g/L时,相同浓度下,对Caski 细胞的抑制率随作用时间的延长而逐步增大(图1),显示苦参碱对Caski增殖抑制作用具有时间、浓度的依赖性。
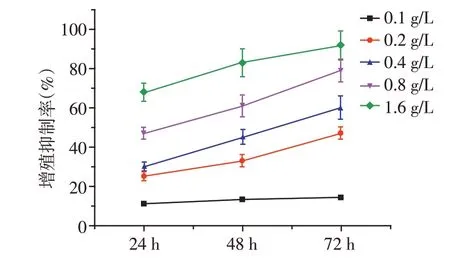
图1 苦参碱对Caski细胞的增殖抑制作用(n=6)Figure 1 Inhibitory effect of matrine on proliferation of Caski cells(n=6)
2.2 苦参碱对Caski细胞侵袭的影响
随着苦参碱处理浓度的逐步升高,Caski细胞侵袭的数量逐渐减少,且与空白组相比,0.4、0.8 g/L处理组差异均具有统计学意义(P<0.01,图2)。
2.3 苦参碱对Caski细胞迁移的影响
随着苦参碱处理浓度的升高,Caski细胞迁移的数量逐步减少,且与空白组相比,0.4、0.8 g/L处理组差异均具有统计学意义(P<0.05,P<0.01,图3)。
2.4 苦参碱对Caski细胞MMP⁃9、VEGF含量的影响
随着苦参碱处理浓度的升高,Caski细胞上清培养液中MMP⁃9、VEGF含量均逐步降低,与空白组相比,0.4、0.8 g/L 处理组差异均具有统计学意义(P<0.05,P<0.01,表1)。
2.5 苦参碱对Caski 细胞GSK⁃3β、Wnt2B mRNA 表达的影响
随着苦参碱处理浓度的逐步升高,Caski细胞内GSK⁃3β mRNA表达量逐渐增加,Wnt2B mRNA表达量逐渐减少,与空白组相比,0.4、0.8 g/L处理组差异均具有统计学意义(P<0.05,P<0.01,图4)。
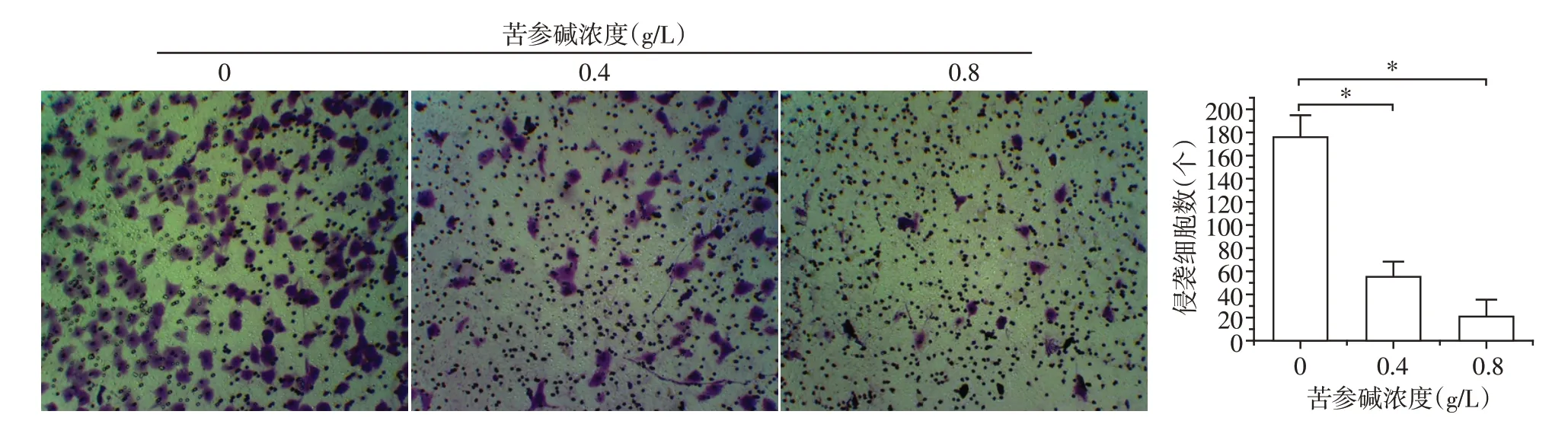
图2 不同浓度的苦参碱对各组细胞Caski侵袭能力变化的影响(结晶紫染色,×200)Figure 2 Effects of different concentrations of matrine on Caski invasiveability in each group(crystal violet staining,×200)
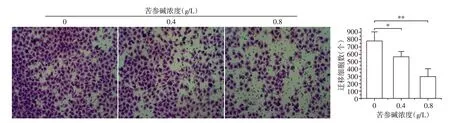
图3 苦参碱对各组细胞迁移能力变化的影响(结晶紫染色,×200)Figure 3 Effects of matrine on the changes of cell migration in each group(crystal violet staining,×200)
表1 各组细胞上清培养液中MMP⁃9、VEGF含量变化Table 1 Changes of MMP⁃9 and VEGF in supernatant medium of each group ()

表1 各组细胞上清培养液中MMP⁃9、VEGF含量变化Table 1 Changes of MMP⁃9 and VEGF in supernatant medium of each group ()
与空白组相比,*P<0.05,**P<0.01,n=3。
2.6 苦参碱对Caski细胞β⁃catenin蛋白及其磷酸化的影响
随着苦参碱处理浓度的逐步升高,Caski细胞内β⁃catenin 蛋白含量逐渐减少,p⁃β⁃catenin(phospho S37)蛋白含量逐渐增多,且与空白组相比,0.4、0.8 g/L处理组差异均具有统计学意义(P<0.01,图5)。
3 讨论
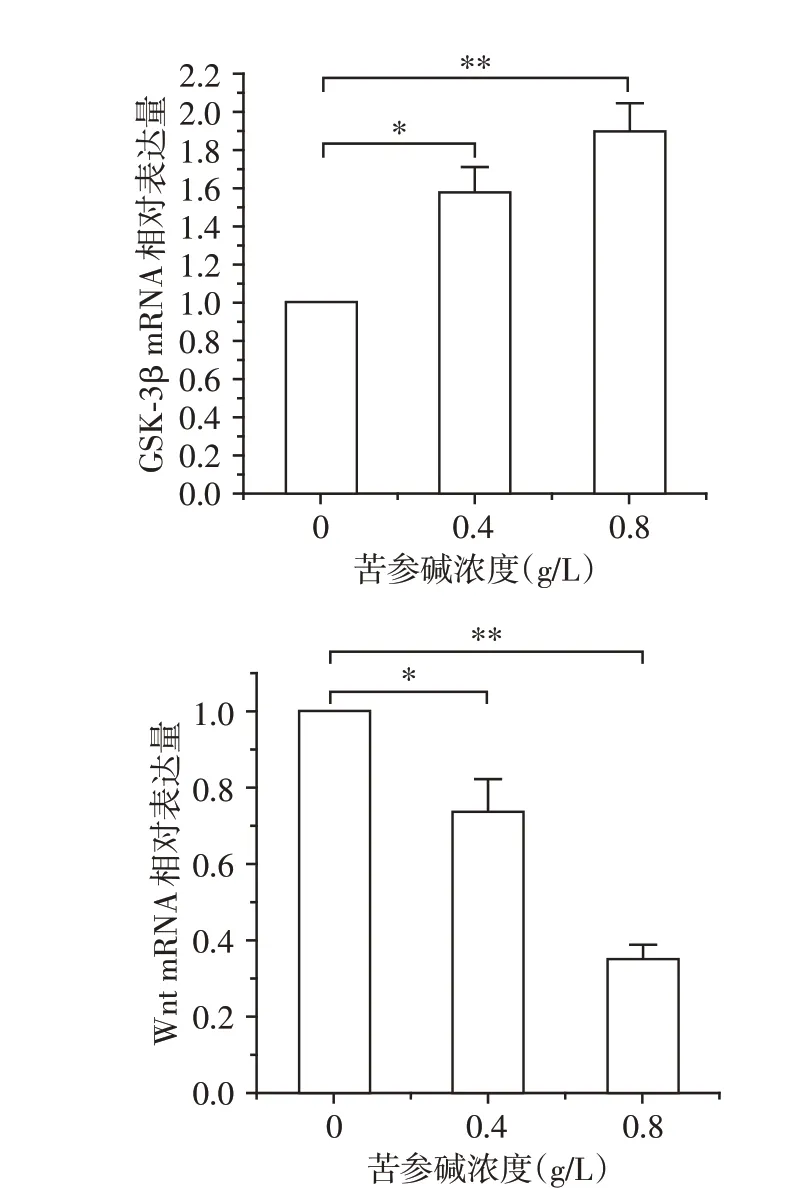
图4 各组细胞GSK⁃3β、Wnt2B mRNA表达量变化Figure 4 Changes of mRNA expression levels of GSK⁃3β and Wnt2B in each group
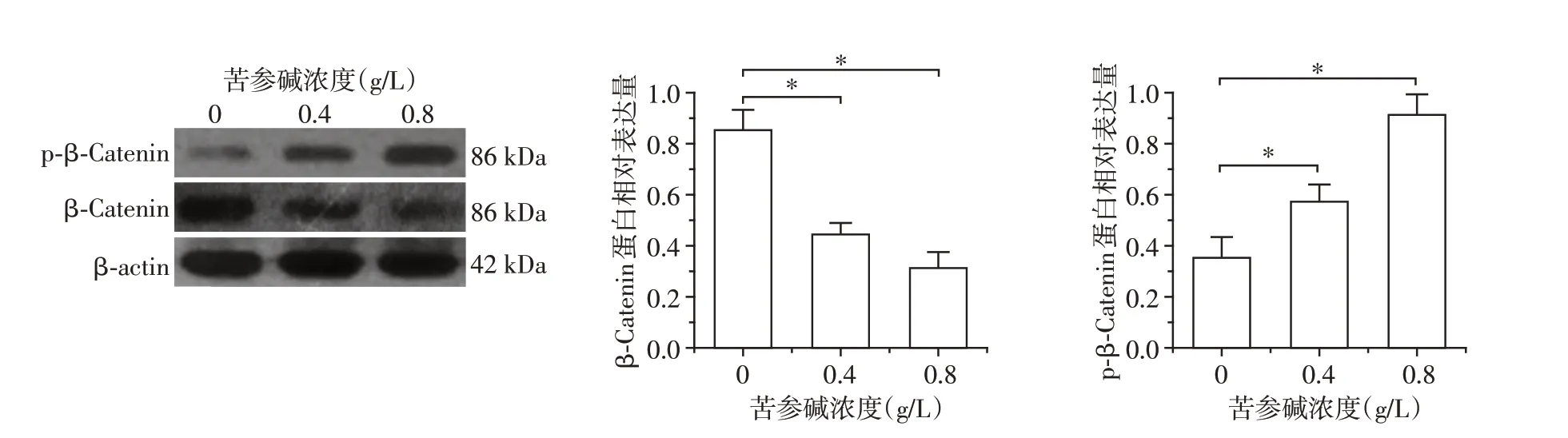
图5 各组细胞β⁃catenin、p⁃β⁃catenin蛋白变化Figure 5 Changes of β⁃catenin and p⁃β⁃catenin in each group
大量研究表明苦参碱具有显著的抗癌作用,其可抑制肿瘤细胞的增殖、诱导肿瘤细胞凋亡、阻止血管生成、侵袭、迁移,且其不良反应小[16],目前,苦参碱在肝癌、胃癌、乳腺癌等肿瘤中的作用已有大量研究,表现出良好的抗癌作用[17-19]。但苦参碱对宫颈癌抗癌作用的研究报道较少,本研究选取人宫颈癌细胞系Caski 细胞为对象进行研究,发现随着浓度的升高,苦参碱对Caski 细胞的增殖抑制作用显著升高,与空白对照组相比,差异具有统计学意义,在相同浓度下随着时间的增加,苦参碱对Caski细胞的增殖抑制作用显著升高,提示苦参碱对Caski细胞的增殖抑制作用也具有剂量、时间依赖性。
肿瘤发生侵袭迁移是恶化的标志,抑制肿瘤的侵袭迁移可以有效降低病死率[20]。本研究发现苦参碱可有效抑制Caski 细胞的侵袭迁移,并表现出一定的剂量依赖性。近年来研究发现,Wnt/β⁃catenin 通路与多种肿瘤的侵袭迁移相关,该通路可影响肿瘤胞外基质的降解、血管生成以及细胞迁移黏附,本研究发现苦参碱可以抑制Caski 细胞分泌MMP⁃9、VEGF,MMP⁃9 具有降解胞外基质,促进细胞侵袭的作用。VEGF 通过诱导血管内皮细胞增殖、迁移促进肿瘤血管生成,为肿瘤细胞的迁移提供通道[21-22],大量研究表明基质金属蛋白酶家族(matrix metalloproteinase,MMP)作为肿瘤侵袭转移的促进因子与Wnt/β⁃catenin 信号通路密切相关[23-24]。MMP 作为Wnt 信号通路下游的直接靶点,β⁃catenin与膜型基质金属酶⁃1(membrane type 1 matrix metal⁃loproteinases,MT1⁃MMP)的共同作用可促进细胞的迁移、侵袭和转移[25],Zhang 等[26]发现VEGF 启动子上游具有Wnt 信号通路调节序列,Wnt 信号通路可明显上调VEGF 的表达,故本研究推测苦参碱抑制Caski 细胞侵袭迁移通过抑制经典的Wnt/β⁃catenin信号通路实现。Wnt2B 是Wnt 信号通路的胞外信号,与Wnt受体结合后可激活该通路,本研究发现苦参碱可抑制Caski 细胞Wnt2B mRNA 的表达,因此,苦参碱可能首先通过抑制Wnt2B 分泌使Caski 细胞Wnt信号通路整体处于低活性状态。研究显示Wnt信号通路的调节关键在于β⁃catenin 的稳定,当β⁃catenin 水平低下时,Wnt 通路关闭,反之,Wnt 通路开启[27];而维持β⁃catenin 稳定的关键蛋白是GSK⁃3β,在没有Wnt 信号刺激的情况下,胞质内的GSK⁃3β能与其他蛋白例如结肠腺瘤性息肉病(adenoma⁃tous polyposis coli,APC)蛋白、轴蛋白(axin)等以复合物的形式磷酸化β⁃catenin氨基末端Ser/Thr位点,使β⁃catenin 泛素化降解,维持细胞内β⁃catenin 的低水平状态。β⁃catenin 处于低水平状态,Wnt 通路关闭。在有Wnt 信号刺激的情况下,由细胞分泌的Wnt2B 蛋白与细胞表面受体卷曲同源物(frizzled,FZD)和低密度脂蛋白受体相关蛋白5/6(low density lipoprotein receptor related protein,LRP5/6)结合后,即触发细胞内的信号转导:细胞内蛋白散乱蛋白(dishevelled,Dsh)被活化,继而活化的Dsh 与Axin及Frat1 相结合,后两者与GSK⁃3β和APC 形成复合物,T 细胞淋巴瘤的原癌 基 因1(frequently rear⁃ranged in advanced T cell lymphomas⁃1,FRAT1)介导GSK⁃3β从Axin上脱离,不能磷酸化β⁃catenin。本研究发现苦参碱可诱导Caski 细胞内GSK⁃3β mRNA的表达,与空白对照组相比,随着苦参碱浓度的升高,药物处理组GSK⁃3β mRNA 表达越来越多。随着Caski 细胞内GSK⁃3β表达量的增多,其与更多的β⁃catenin结合,打破胞内β⁃catenin磷酸化平衡反应,使更多β⁃catenin 磷酸化降解,正如本研究所显示随着苦参碱处理浓度的增高,Caski细胞内β⁃catenin含量减少,p⁃β⁃catenin 含量增多。大量β⁃catenin 被苦参碱诱导降解,导致β⁃catenin 在细胞内积累受阻,抑制β⁃catenin 转移到细胞核与转录因子TCF 相结合,在其他因子的辅助下协同激活靶基因如VEGF、MMP等侵袭迁移相关因子的表达。
综上,苦参碱可通过抑制Caski 细胞Wnt/β⁃catenin 通路中Wnt2B mRNA 表达以及β⁃catenin 蛋白含量,降低Caski细胞MMP⁃9、VEGF的分泌,进而抑制Caski细胞的侵袭迁移。
