S期激酶相关蛋白2对食管鳞癌细胞增殖、迁移的影响及其作用机制
2021-02-25高媛郭敏张敏胡晓玲翟元芳师如意
高媛 ,郭敏 ,张敏 ,胡晓玲 ,翟元芳 ,师如意
1.山西医科大学医学细胞生物学与遗传学教研室,山西 太原 030001;2.山西医科大学转化医学研究中心,山西 太原 030001;3.山西医科大学药理教研室,山西 太原 030001;4.山西医科大学人体解剖教研室,山西 太原 030001
食管癌是一种消化系统的恶性肿瘤,我国食管癌的主要组织学类型为食管鳞癌(esophageal squamous cell carcinoma,ESCC)。ESCC死亡率居于第六位,发病率居于第七位,全球约一半的ESCC发生在中国[1-2]。食管癌早期缺乏特异性症状,且缺乏有效的治疗手段。临床数据表明,患者5年生存率为15%~20%[3]。S期激酶相关蛋白2(S-phase kinase associated protein 2,Skp2)是E3泛素蛋白连接酶复合物SCF(Skpl-Cullin-F-box)的底物识别组件,可识别特定的磷酸化底物并介导泛素化和随后细胞调节因子的降解[4-6],参与调节细胞周期进程,信号转导和转录[7]。在前列腺癌[8]、黑色素瘤[9]和乳腺癌[10]等癌症中,较高水平的 Skp2与肿瘤转移和较差的生存期有关[3,7,9,11],而Skp2的下调则导致肿瘤的生长和转移受到抑制[1]。但目前尚无Skp2基因在ESCC中的功能研究,因此阐明其功能具有重要意义。
本研究选取Skp2表达较高的ESCC细胞系KYSE150、KYSE180进行Skp2-shRNA和阴性对照(negative control,NC)慢病毒的感染,对敲低前后的细胞进行增殖、侵袭、迁移的功能试验后,采用RT-qPCR法检测Skp2潜在下游靶基因P53、P300的变化情况。
1 材料与方法
1.1 细胞及病毒 KYSE180和KYSE150细胞株由山西医科大学食管癌发病机理及转化研究重点实验室保存,均用含10%胎牛血清的RPMI1640培养基于37℃,5% CO2细胞培养箱中培养;Skp2-shRNA和NC病毒由上海汉恒生物科技有限公司提供。
1.2 主要试剂及仪器 胎牛血清、DMSO购自美国Sigma公司;RPMI1640培养基购自美国Hyclone公司;TRIzol试剂及反转录、RT-qPCR试剂盒购自日本TaKaRa公司;鼠抗人Skp2单克隆抗体、羊抗鼠二抗购自美国Invtriogen公司;内参GAPDH抗体购自中国proteintech 60004-1-Ig;MTT购自北京碧云天生物技术有限公司;Transwell小室及60、20 cm2培养皿购自美国Corning公司;酶标仪购自美国BioTek公司;普通PCR仪、荧光定量PCR仪购自美国Applied Biosystems公司;双色红外激光成像系统购自美国LICO R,odyssey公司。
1.3 稳敲Skp2基因细胞株的建立 将对数生长期的KYSE180和KYSE150细胞分别用含0.25%EDTA的胰酶消化后接种至96孔板,5×103个/孔,待细胞融合度约达50%时,按MOI=50加入Skp2-shRNA和NC病毒,吸弃原有培养基,利用半体积进行感染,4 h后补齐至正常体积;感染后24 h,吸弃含病毒的培养液,更换新鲜的完全培养基,37℃继续培养;感染后 48 h,KYSE180 细胞更换含 2 μg/mL Puromycin的新鲜培养液,KYSE150细胞更换含4 μg/mL Puromycin的新鲜培养液,筛选稳定转染细胞株,筛选完成后进行扩大培养,用于后续试验。比较细胞感染Skp2-shRNA慢病毒后,与空白细胞、NC病毒之间的功能差异及下游潜在靶基因的变化。
1.4 RT-qPCR法 使用TRIzol试剂提取KYSE180和KYSE150细胞总RNA,按说明书将2 μg总RNA加入20 μL混合体系中进行反转录,具体操作按RT-qPCR试剂盒说明书进行。PCR反应条件:95℃预变性30 s;95℃ 5 s,60℃ 34 s,共35个循环。RT-qPCR反应条件:95℃10 min加热激发酶活性;95℃15 s,60℃1 min,共40个循环,收集荧光数据进行分析。用于PCR扩增的寡核苷酸引物序列Skp2正义链:5′-CCATCACCCAGCTGAATCTT-3′,反义链:5′-CTGGCACGATTCCAAAAACT-3′;GAPDH 正义链:5′-GAGTCAACGGATTTGGTCGT-3′,反义链:5′-TTGATTTTGGAGGGATCTCG-3′;P53 正义链:5′-AGGTTGGCTCTGACTGTACC-3′,反义链:5′-TCTTCTTTGGCTGGGGAGAG-3′;P300 正义链:5′-TCGAGCGGAATACTACCACC-3′,反义链:5′-CGAGGCATCATCTGGTTTGG-3′。引物由生工生物工程(上海)股份有限公司合成。PCR结束后得到扩增曲线和Ct值,基因差异表达水平用2-ΔΔCt方法按下式计算。
ΔΔCt=(Ct目的基因-Ct管家基因)实验组-(Ct目的基因-Ct管家基因)对照组
1.5 Western blot分析 提取KYSE150和KYSE180细胞蛋白,BCA法测定蛋白浓度,根据上样量制备样品,经10%SDS-PAGE分离后,湿转至PVDF膜上,用5%脱脂牛奶室温封闭2 h;4℃孵育过夜;加入鼠抗人Skp2单克隆抗体(1∶250稀释),内参GAPDH抗体(1∶2 000稀释);洗膜,加入羊抗鼠二抗(1∶10 000稀释),室温避光孵育2 h;洗膜,利用odyssey红外荧光扫描成像系统进行显影。
1.6 细胞增殖能力的检测 采用MTT法。将KYSE-180、KYSE150及对应的NC序列的慢病毒和敲低Skp2基因的细胞接种至96孔板中,分别在24、48、72、96、120 h 后加入 20 μL MTT,37 ℃孵育 4 h;吸弃培养基和MTT混合液,加入200 μL DMSO,于490 nm波长处检测吸光度,利用prism软件进行数据分析。
1.7 细胞迁移能力的检测 采用Transwell小室试验。用无血清培养基将空白细胞、NC细胞及稳定敲低Skp2基因的KYSE150和KYSE180细胞悬浮,接种至Transwell小室的上室,在小室下方加入含10%FBS的培养基,48 h后吸弃培养基,用棉签将多余细胞擦去,用4%多聚甲醛固定15 min,结晶紫染色30 min,倒置显微镜下进行拍照,每个小室随机选取5个视野,统计分析数据。
1.8 细胞克隆形成能力的检测 采用克隆形成试验。将KYSE180、KYSE150及对应的NC序列的慢病毒和敲低Skp2基因的细胞接种至6孔板中,10 d后吸弃培养基,PBS洗涤,4%多聚甲醛固定15 min,结晶紫染色30 min,统计形成的有效克隆,进行比较分析。
1.9 统计学分析 采用SPSS 22.0软件进行统计学分析,数据以均数±标准差(±s)表示,组间均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 Skp2基因的表达情况 结果显示,感染Skp2-shRNA的细胞与空白组细胞和NC组细胞相比,Skp2基因的表达在RNA水平和蛋白水平均受到明显的抑制,见图1和图2。

图1 RT-qPCR法检测KYSE150细胞(A)和KYSE-180细胞(B)中Skp2基因的敲低效率Fig.1 Determination of Skp2 gene knockdown efficiency in KYSE150(A)and KYSE180(B)cells by RT-qPCR

图2 KYSE150细胞(A)和KYSE180细胞(B)中Skp2基因敲低效率的Western blot分析Fig.2 Determination of Skp2 gene knockdown efficiency in KYSE150(A)and KYSE180(B)cells by Western blot
2.2 下调Skp2基因对ESCC细胞增殖能力的影响结果显示,敲低Skp2基因的细胞与空白组细胞和NC组细胞相比,增殖在96 h后开始受到明显抑制,差异均有统计学意义(KYSE150细胞:F96h=3.407,P<0.05,F120h=4.927,P < 0.01;KYSE180 细胞:F96h=4.427,P < 0.05,F120h=5.354,P < 0.01),见图 3。

图3 Skp2基因敲低对KYSE150细胞(A)和KYSE180细胞(B)增殖的抑制作用Fig.3 Inhibition of proliferation of KYSE150(A)and KYSE180(B)cells after knockdown of Skp2 gene
2.3 下调Skp2基因对ESCC细胞迁移能力的影响结果显示,敲低Skp2基因的细胞与空白组细胞和NC组细胞相比,迁移受到明显抑制,差异均有统计学意义(KYSE150 细胞:F=10.235,P < 0.001;KYSE180细胞:F=9.560,P < 0.001),见图 4和图 5。

图4 Skp2基因敲低后对KYSE150细胞(A)和KYSE180细胞(B)迁移的抑制作用Fig.4 Inhibition of migration of KYSE150(A)and KYSE-180(B)cells after knockdown of Skp2 gene
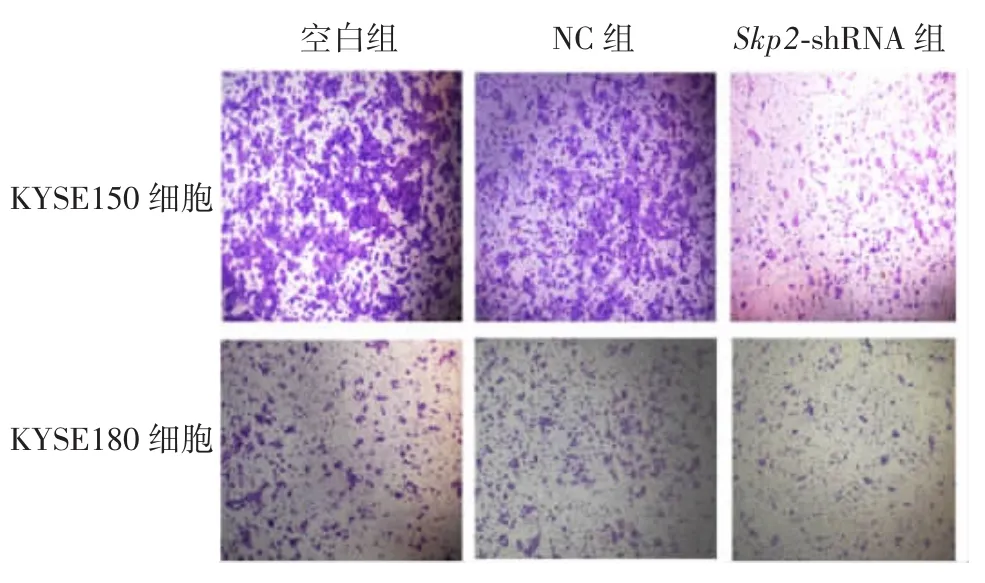
图5 Skp2基因敲低后对ESCC细胞迁移作用的显微镜观察(× 40)Fig.5 Microscopy of migration of ESCC cells after knockdown of Skp2 gene(× 40)
2.4 下调Skp2基因对ESCC细胞的克隆形成能力的影响 结果显示,敲低Skp2基因的细胞与空白组细胞和NC组细胞相比,克隆形成能力受到明显的抑制,差异均有统计学意义(KYSE150细胞:F=6.534,P < 0.01;KYSE180 细胞:F=7.356,P < 0.01),见图6和图7。
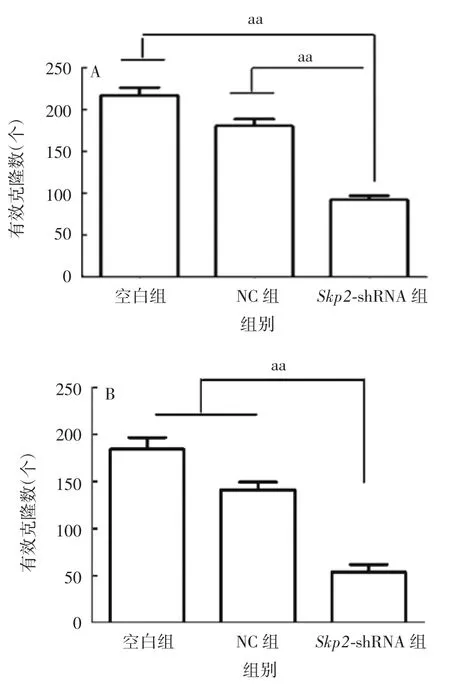
图6 Skp2基因敲低后对KYSE150细胞(A)和KYSE180细胞(B)克隆形成的抑制作用Fig.6 Inhibition of clone formation of KYSE150(A)and KYSE180(B)cells after knockdown of Skp2 gene

图7 Skp2基因敲低后对ESCC细胞克隆形成的显微镜观察Fig.7 Microscopy of clone formation of ESCC cells after knockdown of Skp2 gene
2.5 Skp2下游潜在靶基因P53和P300的表达 RT-qPCR结果显示,敲低Skp2基因的细胞与空白组细胞和NC组细胞相比,可明显增加Skp2下游靶基因P53和P300的表达。在KYSE150细胞中敲低Skp2基因后,P53、P300的表达差异有统计学意义(F分别为 4.826和4.214,P均 <0.05);在 KYSE180细胞中敲低Skp2基因后,P53、P300的表达差异也有统计学意义(F分别为4.932和3.212,P均 <0.05)。见图8。

图8 Skp2基因敲低后其潜在下游靶基因P53和P300在KYSE150细胞(A)和KYSE180细胞(B)中的变化情况Fig.8 Changes in potential downstream target genes P53 and P300 in ESCC cells after knockdown of Skp2 gene
3 讨论
食管癌是最常见的消化道恶性肿瘤,病理类型分为ESCC和食管腺癌,我国主要以ESCC为主[1]。目前关于食管癌的治疗主要为手术切除原发病灶结合术后的放化疗,由于局部侵袭和远处转移的高发生率,ESCC患者的生存率仍然很低[12-15]。近年来,基因治疗在癌症临床研究中越来越普遍,基因疗法具有许多临床治疗无法比拟的优点,包括对晚期癌症转移的高选择性和有效性,以及可能实现个性化治疗,使其成为癌症治疗的一种有效手段,并可能替代手术、放射疗法和化学疗法。因此必须准确识别癌基因或抑癌基因,为患者制定更有效的治疗策略。
Skp2是F-BOX家族成员之一,参与泛素化降解、细胞周期、细胞凋亡和衰老的调控,以及Skp2-SCF复合体形式的信号转导等[10,16],在SCF复合物中,Skp2起到底物识别因子的作用。Skp2已被证明是癌基因,与在多种肿瘤中过度表达有关,Skp2过表达可诱导前列腺增生、增生、发育不良和低分级癌[16-17]。在子宫内膜癌中,Skp2通过调控p27来调控子宫内膜癌细胞的增殖[7]。ZHANG 等[18]研究发现,Skp2在多种骨肉瘤细胞中也存在高表达的现象,在骨肉瘤小鼠模型中,使用Flavokawain A后,Skp2基因表达下降,骨肉瘤细胞侵袭及体内肺转移也会被阻断。LI等[10]研究发现,PDCD4是Skp2的重要泛素化底物,Skp2通过PDCD4降解促进乳腺癌的发生和放射耐受,放射治疗结合Skp2靶向辅助治疗可提高乳腺癌患者的临床生存率。KITAGAWA等[19]研究发现,在乳腺癌中Skp2可通过抑制P300来抑制P53依赖的凋亡。在其他癌症中也有关于Skp2促进癌细胞增殖和转移的相关报道,但Skp2基因是否在食管癌中也能起到类似的作用,且其机制如何尚未完全明确。
本研究着重探讨了Skp2基因在ESCC中的功能。在ESCC细胞系和永生化的正常食管上皮细胞系分别检测了Skp2基因的表达,结果发现,在ESCC细胞系的表达明显高于正常食管上皮细胞。然后选取KYSE150和KYSE180两个细胞株转染敲低Skp2基因的慢病毒,对相关细胞生物学行为及可能的机制进行了检测。细胞水平试验显示,在敲低Skp2基因后,细胞增殖、迁移、克隆形成能力均受到明显抑制。Skp2基因敲低后,其下游可能的潜在靶基因P53、P300的表达在RNA水平升高。本研究结果表明,在ESCC中Skp2可通过抑制P53、P300的表达促进ESCC细胞增殖、迁移。提示Skp2有可能成为ESCC一个新的治疗靶点。
