新型肿瘤免疫抑制靶点唾液酸结合免疫球蛋白样凝集素-15的生物信息学预测
2021-02-25文朝朝王晰魏艳李文龙王海龙郭睿赵虹张栋弓韬于保锋
文朝朝,王晰,魏艳,李文龙,王海龙,郭睿,赵虹,张栋,弓韬,于保锋
山西医科大学基础医学院生物化学与分子生物学教研室,山西 太原 030001
唾液酸结合免疫球蛋白样凝集素-15(sialic acid binding Ig like lectin-15,SIGLEC-15)是一种在脊椎动物多种组织中均有表达的Ⅰ型跨膜蛋白。2007年,ANGATA等[1]最先报道了SIGLEC-15在巨噬细胞亚群上的表达,发现其可优先识别一种与肿瘤相关的聚糖结构唾液酸-Tn(sTn)抗原;2013 年,TAKAMIYA等[2]研究发现,SIGLEC-15还能转导肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)中增强转化生长因子-β(transforming growth factor-β,TGF-β)分泌的信号,进一步表明巨噬细胞上的SIGLEC-15可能通过影响TGF-β介导的肿瘤内微环境来促进肿瘤进展。
近年,肿瘤免疫疗法的研究较多,免疫检查点抑制剂的研发对该领域的研究产生了较大影响,其中靶向程序性死亡受体1/程序性死亡受体-配体1(programmed cell death 1/programmed cell deathligand 1,PD-1/PD-L1)的免疫检查点抑制剂研究成为热点[3-5]。有研究表明,PD-1/PD-L1抑制剂仅可对少数(<40%)实体瘤发挥抑制作用[6-8],且长期使用易导致免疫系统激活,引起免疫耐受缺失等副作用,因此亟需寻找类似的靶点来优化肿瘤免疫疗法。2019年,WANG等[9]通过使用基因组规模的T细胞活性阵列将SIGLEC-15确定为一种免疫抑制靶点,并证明由于巨噬细胞集落刺激因子(macrophage colony stimulating factor,MCSF)的诱导和干扰素 γ(interferon γ,IFNγ)下调的影响,SIGLEC-15 在人类癌细胞和肿瘤浸润性骨髓细胞中的表达会广泛上调。另外,肿瘤组织对SIGLEC-15和PD-1的表达通常不会同时发生,因此这两个靶点将在肿瘤的诊疗领域互为补充。上述研究结果表明,SIGLEC-15有望成为癌症免疫疗法的潜在目标,对免疫疗法的研究发展具有重要意义。
ANGATA 等[1]研究表明,SIGLEC-15可能拥有两个Ig样结构域,包含1个带有赖氨酸残基的跨膜结构域,且其胞质部分的结构较短。本研究在此基础上,利用生物信息学方法对SIGLEC-15的结构、性质、功能、蛋白相互作用等特性进行预测和分析,为其在免疫疗法等抗肿瘤研究中的应用奠定基础。
1 材料与方法
1.1 氨基酸序列 从NCBI蛋白质数据库(https://www.ncbi.nlm.nih.gov/protein/)中搜索获得人SIGLEC-15蛋白(GenBank登录号:AAY40743.1)氨基酸序列信息进行后续预测分析。
1.2 SIGLEC-15理化性质的分析 应用ProtParam软件(http://web.expasy.org/protparam/)分析 SIGLEC-15的基本理化性质;Protscale软件(http://web.expasy.org/protscale/)分析亲疏水性;SignalP 4.0 Server软件(http://www.cbs.dtu.dk/services/SignalP-4.0/)分析信号肽的结构;TMHMM Server v.2.0软件(http://www.cbs.dtu.dk/services/TMHMM/)分析跨膜结构[10]。
1.3 SIGLEC-15组织表达特异性、亚细胞定位及不同肿瘤中表达情况分析 在NCBI中查找SIGLEC-15在人类正常组织中的表达情况,并对其在正常组织和肿瘤组织中的每百万碱基转录数(transcripts per million,TPM)进行分析;应用 PSORT Ⅱ软件(https://psort.hgc.jp/form2.html)预测 SIGLEC-15的亚细胞定位情况;在美国国家癌症研究所的癌症基因组图谱(https://www.cancer.gov/about-nci/organization/ccg/research/structural-genomics/tcga,TCGA)数据库中查找SIGLEC-15在不同肿瘤中的表达情况。
1.4 SIGLEC-15的二级及三级结构预测 应用SOPMA 软件(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)分析二级结构及不同类型结构域的占比;通过NCBI的Conserved Domain 数据库(https://www.ncbi.nlm.nih.gov/cdd)分析保守结构域;SWISS-MODEL软件(https://swissmodel.expasy.org/)预测三级结构。
1.5 SIGLEC-15翻译后位点修饰的预测 应用NetNGlyc 1.0 软件 Sever(http://www.cbs.dtu.dk/services/NetNGlyc/)及 NetOGlyc 4.0 软件 Server(http://www.cbs.dtu.dk/services/NetOGlyc/)预测糖基化位点;Netphos 3.1软件Server(http://www.cbs.dtu.dk/se-rvices/NetPhos/)预测磷酸化位点[11]。
1.6 SIGLEC-15相关蛋白互作关系预测 应用STRING软件(http://string-db.org/)建立与 SIGLEC-15相互作用的蛋白网络,设置高置信度(0.700),且蛋白个数不超过10进行分析,并查找SIGLEC-15及其互作蛋白在GO和KEGG数据库中的相关信息。
1.7 SIGLEC-15系统进化树的构建 在GenBank(http://www.ncbi.nlm.nih.gov/sites/entrez?db=nucleotide)中搜索不同物种的SIGLEC-15的氨基酸序列,应用ClustalX 2.0软件对得到的氨基酸序列进行比对分析,同时应用MEGA-Ⅹ软件构建进化树,并进行分析[12]。
2 结果
2.1 SIGLEC-15的理化性质
2.1.1 基本理化性质 SIGLEC-15基因位于人类第18号染色体(18q12.3),含有6个外显子,其蛋白由328个氨基酸残基组成。该蛋白分子式为C1566H2473N475O455S12,分子量为35 619.49 Da。SIGLEC-15由20种氨基酸组成,其中丙氨酸(Ala)残基44个,含量最高,占氨基酸总数的13.4%;赖氨酸(Lys)残基3个,含量最低,占氨基酸残基总数的0.9%。见图1。SIGLEC-15的理论等电点为8.86,氨基酸序列中带正电荷的残基(Arg+Lys)34个,带负电荷的残基(Asp+Glu)29个,该蛋白属碱性蛋白质。SIGLEC-15在哺乳动物的网织红细胞中半衰期为30 h,不稳定指数为48.24,判定为不稳定蛋白。该蛋白的脂肪族氨基酸指数为83.72,亲水性平均值(grand average of hydropathicity,GRAVY)为-0.217。
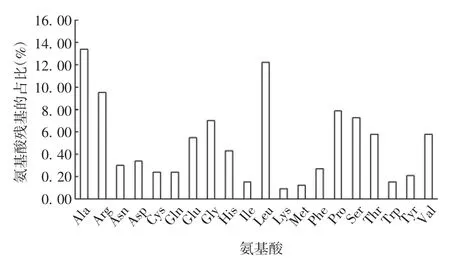
图1 SIGLEC-15的氨基酸组成Fig.1 Amino acid composition of SIGLEC-15
2.1.2 亲水性 SIGLEC-15序列第155位谷氨酸(Glu)亲水性得分最高,为-2.767,第279位亮氨酸(Leu)和280位的甘氨酸(Gly)疏水性得分最高,均为2.933。SIGLEC-15的亲水氨基酸区域明显多于疏水氨基酸区域,综合考虑其GRAVY为-0.217,因此判定该蛋白为亲水性蛋白。见图2。

图2 SIGLEC-15的亲疏水性分析Fig.2 Analysis of hydrophobicity of SIGLEC-15
2.1.3 信号肽结构 SIGLEC-15的氨基酸序列第20位处C值与Y值达最大,分别为0.221和0.435,S值平均值(1~19位)为0.848(>0.5时判定蛋白质为分泌蛋白),因此预测SIGLEC-15含有信号肽结构。见图3。

图3 SIGLEC-15信号肽的分析Fig.3 Analysis of signal peptide of SIGLEC-15
2.1.4 跨膜结构 SIGLEC-15蛋白序列的1~260位氨基酸残基位于膜外,共260个;284~328位氨基酸残基位于膜内,共45个;跨膜结构为261~283位氨基酸残基,共23个。因此判定SIGLEC-15共有1个跨膜结构域。见图4。

图4 SIGLEC-15跨膜结构的预测Fig.4 Prediction of transmembrane structure of SIGLEC-15
2.2 SIGLEC-15的组织表达特异性、亚细胞定位及在不同肿瘤中表达情况
2.2.1 组织表达特异性 SIGLEC-15在小肠中的表达水平最高,RPKM约为1.785;在心脏中的表达水平最低,RPKM约为0.001。SIGLEC-15在正常组织中的 TPM:血液 57、骨 41、脾脏 37、血管 19、皮肤14、乳腺 13、淋巴结 11;在肿瘤组织中的 TPM:软骨肉瘤36、神经胶质瘤27、皮肤肿瘤23、乳腺肿瘤21、淋巴瘤13、胰腺肿瘤9。另外,SIGLEC-15在新生儿体内的表达量高于成人,约为成人体内表达量的56倍。
2.2.2 亚细胞定位 SIGLEC-15定位在细胞外的概率最大,为34.80%,其次分别为细胞膜(30.40%)、内质网(21.70%)和高尔基体(13.00%)。
2.2.3 在不同肿瘤中的表达 14项研究的51个SIGLEC-15不同位点突变的51例癌症病例中,子宫内膜癌所占比例最大,乳腺浸润性癌所占比例最小,见图5。另外,数据库中所收录的553个病例中,由SIGLEC-15突变引起的肿瘤原发位点(primary site)共32个,其中原发于卵巢的病例最多,达111例,占病例总数的20%,见图6。由SIGLEC-15突变引起肿瘤的患者中女性多于男性,且患者均为23岁以上。
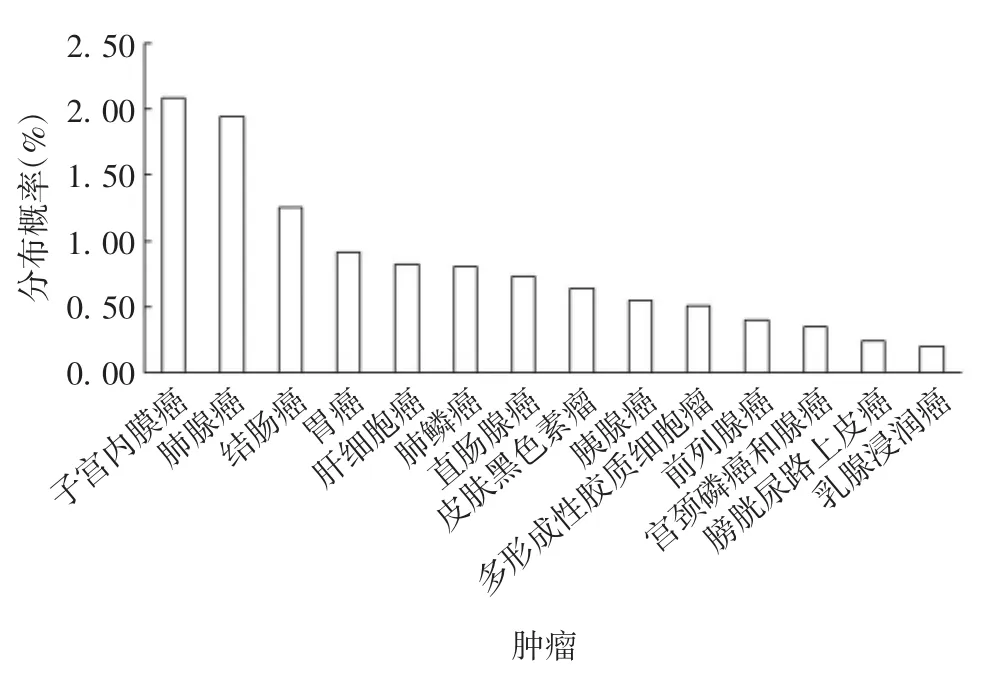
图5 SIGLEC-15突变引起的癌症分布Fig.5 Distribution of cancer caused by SIGLEC-15 mutation

图6 SIGLEC-15突变引发肿瘤的原发部位病例分布Fig.6 Case distribution of primary site of tumor induced by SIGLEC-15 mutation
2.3 SIGLEC-15的二级结构及三级结构预测结果
2.3.1 二级结构 SIGLEC-15蛋白由5.49%的β-转角、21.34%的α-螺旋、23.78%的延长链及49.39%的无规卷曲构成,无规卷曲所占比例最大,占其序列全长近一半的长度,见图7。
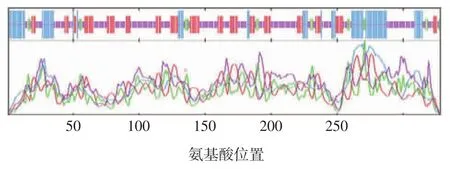
图7 SIGLEC-15的二级结构预测Fig.7 Prediction of secondary structure of SIGLEC-15
2.3.2 保守结构域 SIGLEC-15共有两个免疫球蛋白超家族结构域,分别为47~165位及187~251位,见图8。

图8 SIGLEC-15的保守结构域Fig.8 Conserved domain of SIGLEC-15
2.3.3 三级结构 SIGLEC-15可能的三级结构模型共8种,选择其中拟合度最高进行分析。该预测结果的GMQE为0.39,OMEAN为-3.64,序列相似度22.82%,模型中所示二级结构及所占比例与2.3.2项结果基本相符。SIGLEC-15的无规卷曲所占比例较大,因此其三级结构弹性较大,见图9。

图9 SIGLEC-15的三级结构预测Fig.9 Prediction of tertiary structure of SIGLEC-15
2.4 SIGLEC-15翻译后位点修饰的预测 SIGLEC-15蛋白共有两个N-糖基化位点,分别位于172和312位;共有1个O-糖基化位点,位于207位。SIGLEC-15有8个位点可能成为蛋白激酶磷酸化位点(以得分>0.8 计):53 位 Ser(0.872)、126 位 Ser(0.949)、156位Ser(0.844)、213位Ser(0.991)、235位Tyr(0.861)、299 位 Thr(0.946)、308 位 Ser(0.987)、310 位 Ser(0.970)。
2.5 SIGLEC-15相关蛋白互作关系的预测 与SIGLEC-15有物理或化学相互作用及间接作用的蛋白共4个,分别为 TYROBP(score:0.954)、CD22(即 SIGLEC-2,score:0.835)、SIGLEC-1(score:0.824)、MAG(score:0.750),所得蛋白与SIGLEC-15构成蛋白互作网络见图10。SIGLEC-15和SIGLEC-1涉及到的生物过程有破骨细胞发育调控、细胞发育调控以及防御应答,CD22 只涉及细胞黏附。SIGLEC-1、CD22、MAG均有碳水化合物结合功能,均参与细胞黏附分子通路。见表1

表1 GO生物过程分析Tab.1 GO biological process analysis

图10 SIGLEC-15蛋白互作网络图Fig.10 Protein interaction network of SIGLEC-15
2.6 SIGLEC-15的系统进化树 在GenBank中下载得到人类、猩猩、马、牛、小鼠、壁虎、蝙蝠、家犬、旱獭、青鳉鱼等22个物种的SIGLEC-15氨基酸序列。MEGA-Ⅹ构建进化树见图11,人类SIGLEC-15与猩猩、白狨猴等灵长类动物SIGLEC-15的同源性最高。SIGLEC家族的其他亚型仅存在于哺乳动物中,而SIGLEC-15不仅存在于哺乳动物中,还存在于脊椎动物的其他分支中,表明SIGLEC-15在脊椎动物进化过程中是相对保守的。

图11 22个物种的SIGLEC-15进化树Fig.11 Phylogenetic tree of SIGLEC-15 of 22 species
3 讨论
本研究应用各种生物信息学工具对一种新型肿瘤免疫抑制靶点SIGLEC-15的理化性质、结构功能、蛋白互作等进行了系统的预测分析。分析结果得出,SGLEC-15是一种碱性不稳定蛋白,亲水性较强,是具有信号肽结构的分泌蛋白。该蛋白具有1个跨膜结构域,是一种膜蛋白。有研究表明,SIGLEC-15为主要表达于肿瘤相关巨噬细胞表面的跨膜蛋白[1-3],但本实验预测结果显示,SIGLEC-15可能存在信号肽结构,可能在胞外有所分布,因此该蛋白是否确实具有分泌能力,是否能在胞外环境发挥特殊功能,还有待进一步验证。
蛋白质在真核细胞内翻译合成后,需进一步翻译修饰才能具有生物学功能,因此对蛋白质进行翻译后位点修饰的预测较重要。蛋白质的功能可通过糖基化作用进行调节,是蛋白质修饰的重要手段,主要包括以天冬酰胺、N-末端氨基酸及赖氨酸或精氨酸为连接点的N-糖基化修饰,以苏氨酸、丝氨酸、羟脯氨酸和羟赖氨酸的羟基为连接点的O-糖基化修饰及糖肽键的糖基化等修饰形式。另外,蛋白磷酸化是蛋白在激酶的作用下被激活而发挥生物学功能的翻译后修饰形式,同样对细胞信号转导具有重要意义。本研究结果显示,SIGLEC-15可能具有2个N-糖基化位点,1个O-糖基化位点及8个蛋白磷酸化位点,该结论对SIGLEC-15作为新型肿瘤免疫抑制靶点的研究具有重要意义。WANG等[9]研究已表明,SIGLEC-15在肿瘤中的高表达会持续抑制T细胞的活性,敲除或抑制SIGLEC-15可提高小鼠的抗肿瘤能力。本实验预测到上述翻译后修饰位点分散于SIGLEC-15的不同位置,结合亲疏水性及二、三级结构的预测结果,可设计不同的药物模型对SIGLEC-15进行抑制,为SIGLEC-15抑制剂的研发奠定了基础。
与SIGLEC-15有相互作用的4个蛋白中,SIGLEC-1、CD22、MAG均有碳水化合物结合功能,均参与细胞黏附分子通路,SIGLEC-15和TYROBP(也称DNAX 12 kDa活化蛋白,DAP12)在报告中均未得出相关结论,但 ORNHöFFT 等[13]报道表明,SIGLEC-15具有顺式结合碳水化合物的结构。SIGLEC-15与TYROBP的相互作用更为密切,两者共同参与免疫应答反应及细胞发育尤其是破骨细胞发育的调控。TYROBP含有免疫受体酪氨酸激活基序(immunoreceptor tyrosine-based activation motif,ITAM),该结构在信号转导中发挥重要作用,ITAM的磷酸化可迅速募集多种游离蛋白与衔接蛋白,进而传递细胞信号。ANGATA等[1]指出,TYROBP磷酸化的ITAM结构可与巨噬细胞上SIGLEC-15跨膜结构中的赖氨酸通过电荷依赖性机制相互作用,进而激活免疫系统,但这与肿瘤细胞所表达的SIGLEC-15产生的作用是相反的。WANG等[9]体外实验表明,敲除小鼠体内的SIGLEC-15基因后,并未引起小鼠自身免疫疾病的发生,虽尚无相关报道阐述其原因,但其证明了SIGLEC-15将是一个具有潜力的免疫抑制靶点。另外,SIGLEC-15互作蛋白的GO分析显示SIGLEC-15与破骨细胞的发育有关,该蛋白在骨组织发育旺盛的新生儿及青少年体内的表达量比成人高得多,但TCGA数据库现存的SIGLEC-15突变引起的癌症案例中,并无新生儿、儿童或青少年,因此推测SIGLEC-15基因在未成年人体内的突变率较低。
目前,虽然对 SIGLEC 家族,如 SIGLEC-2(CD22)、SIGLEC-3(CD33)等的研究已较深入,但SIGLEC-15在肿瘤相关免疫反应中作用的报道较少。目前,SIGLEC-15被认为是PD-1的补充靶点,其抗体的研发已进入临床试验,相关的研究也越发受到人们的关注,SIGLEC-15的研究有望在肿瘤免疫疗法的发展中发挥重要作用。
