BHK-21细胞悬浮培养狂犬病病毒(rCVS-11-dG株)工艺的建立及病毒免疫原性评价
2021-02-25李政蓉金宏丽黄培刘川玉王化磊赵永坤赵健石晶杨松涛夏咸柱
李政蓉 ,金宏丽 ,黄培 ,刘川玉 ,王化磊 ,赵永坤 ,赵健 ,石晶 ,杨松涛 ,夏咸柱
1.吉林大学动物医学学院,吉林 长春 130062;2.军事科学院军事医学研究院军事兽医研究所,吉林 长春 130122;3.吉林农业大学动物科学技术学院,吉林 长春 130118;4.长春西诺生物科技有限公司,吉林 长春 130012
狂犬病是由狂犬病病毒引起的一种人兽共患传染病,临床症状表现为恐水、恐光、狂躁不安等[1]。狂犬病病毒可感染犬、猫、狐狸等温血动物,人一旦感染,致死率几乎100%[2-4]。中国《传染病防治法》将狂犬病定为乙类法定报告传染病,在过去10年,年平均报告死亡例数约2 000例。目前虽已有商品化疫苗,但多数人在被动物咬伤后才会紧急免疫。据卫生部2009年资料统计,我国每年接种1 200万~1 500万剂狂犬病疫苗,成为全世界接种狂犬病疫苗最多的国家[5]。据国家卫生健康委员会疾病预防控制局发布的《2018年全国法定传染病疫情概况》,2018年我国狂犬病发病数为422例,死亡例数为410例[6],狂犬病仍是一个威胁人类健康的重要人兽共患传染病。因此探索狂犬病病毒兽用疫苗制备工艺,研制安全高效价的兽用疫苗,从源头控制,以切断动物散毒途径,对控制人感染狂犬病病毒事件的发生具有重大意义。
传统的兽用灭活疫苗多采用转瓶培养工艺培养,虽然较方瓶培养规模大,但仍需添加血清,既增加了兽用疫苗的生产成本,又存在血清处理不当造成污染的问题,且不利于下游分离纯化。2012年2月,国家农业部文件明确规定,各省级兽医管理部门停止受理转瓶工艺的兽用细胞苗生产线项目的兽药GMP验收申请[7],因此,兽用生物制品生产方式的转变将成为必然。相比于转瓶培养方式,生物反应器悬浮培养具有产量高、细胞密度大、培养条件可控及批间差异小等优点,已广泛应用于疫苗产业[8-9]。BHK-21细胞是WHO推荐用于兽用疫苗生产的传代细胞系,同时也可通过生物反应器进行高密度、规模化培养,目前已成功应用于狂犬病疫苗、口蹄疫疫苗和伪狂犬病疫苗等多种兽用疫苗的研究及生产[10-13]。
本研究选用实验室前期拯救的含有双G蛋白的狂犬病病毒rCVS-11-dG株[14]作为灭活疫苗株,利用5 L生物反应器悬浮培养的BHK-21细胞批次培养rCVS-11-dG株狂犬病病毒,经β-丙内酯灭活后加入佐剂制备灭活免疫原,评价其免疫效果,以期为规模化生产安全、高效价兽用狂犬病病毒灭活疫苗奠定基础。
1 材料与方法
1.1 细胞及病毒 BHK-21悬浮细胞、NA细胞由军事兽医研究所动物病毒学与特种动物疫病学实验室保存,狂犬病病毒rCVS-11-dG株由该实验室通过反向遗传技术拯救并保存。
1.2 实验动物 SPF级BALB/c小鼠,雌性,6周龄,35只,体重18~22 g,购自辽宁长生生物科技有限公司,动物合格证号:SCXK(辽)2015-0001。
1.3 主要试剂及仪器 FITC标记的抗狂犬病病毒N蛋白单克隆抗体购自瑞士FDI FUJIREBIO公司;BHK-21悬浮细胞无血清培养基、胎牛血清和铝胶佐剂购自美国Thermo公司;Gel(02)佐剂购自法国Seppic公司;茯苓多糖(PCP-2)佐剂由军事科学院军事医学研究院毒物药物研究所单俊杰研究员惠赠;5 L生物反应器(工作体积3.5 L)购自美国New Brunswick Scientific公司。
1.4 摇瓶培养条件优化
复苏BHK-21细胞,用含1%胎牛血清的培养液,于37℃,5% CO2培养箱中,130 r/min培养至细胞密度达6×106个/mL时,进行稀释后传代。
1.4.1 病毒培养温度 将生长状态良好的BHK-21细胞稀释至3×106个/mL,按照MOI=0.5接毒,分别于30、34和37℃,5% CO2培养箱中培养,每隔12 h取样,检测病毒细胞半数感染量(tissue culture infective dose,TCID50),每个样品重复检测 3 次。
1.4.2 病毒接种MOI将生长状态良好的BHK-21细胞稀释至3×106个/mL,按照MOI分别为0.01、0.05、0.1、0.5和1.0接毒后继续培养,每隔12 h取样,检测TCID50。所取样品于-80℃冻存。
1.4.3 细胞接种密度 将生长状态良好的BHK-21细胞,分别稀释至2、3和4×106个/mL,按MOI=0.01接毒,每隔12 h取样,检测病毒TCID50。所取样品于-80℃冻存。
1.5 5 L生物反应器培养条件优化
1.5.1 细胞培养阶段最适传代时间 按初始接种细胞密度为1×106个/mL接种至反应器中,培养体积为1.75 L,添加1%胎牛血清、1%双抗和2%谷氨酰胺,温度为(37±0.1)℃,pH设为7.2±0.1,DO控制为20%,搅拌转速设为90 r/min。当细胞密度增加至3×106个/mL时,DO增大至40%,转速增大至120 r/min,继续培养,每隔12 h取样并在显微镜下进行细胞计数,检测细胞密度,绘制细胞生长曲线。
1.5.2 病毒培养阶段最适收毒时间 参照摇瓶培养病毒时最适条件。生物反应器培养至细胞密度达6×106个/mL时,加入1.75 L细胞培养液,进行稀释传代,传代后细胞密度为3×106个/mL。接种MOI=0.01,pH为7.4±0.1,搅拌速度设为120 r/min,DO控制为40%,培养温度为(34±0.1)℃。重复3次。每隔12 h取样,检测病毒滴度,绘制病毒一步生长曲线,确定最佳收毒时间。收获的病毒液1 600×g离心去细胞碎片,上清分装,于-80℃冻存。
1.6 病毒TCID50检测 采用直接免疫荧光染色法。取5×104个/孔NA细胞加至96孔板中,病毒经DMEM 10倍系列稀释(10-1~10-8)后,依次加至96孔板中,50 μL/孔,37 ℃,5% CO2温箱中培育 48 h;弃上清,加入80%冷丙酮固定细胞,-20℃过夜;PBST洗涤细胞3次,每次5 min,加入含伊文思蓝和FITC标记的抗狂犬病病毒N蛋白单克隆抗体的工作液,50 μL/孔,避光,37℃温箱平放1 h;暗室中用PBST洗涤3次,每次5 min,使用倒置荧光显微镜观察绿色荧光,有1个或更多荧光标记的孔记“+”,无绿色斑点的孔记“-”,按照Reed-Muench法计算病毒滴度。
1.7 免疫原制备 将滴度为2×109TCID50/mL的病毒液按1∶2 000的比例加入β-丙内酯,4℃摇匀灭活24 h;37℃水解2 h;加至铺有NA细胞的96孔板中,50 μL/孔,37 ℃,5% CO2培养箱培养 2 d;收获细胞上清,冷丙酮固定细胞,收获的上清加至铺有NA细胞的96孔板中,继续培养2 d;弃上清,用冷丙酮固定细胞,经1.6项方法灭活验证合格后,分别与Gel(02)、PCP-2和铝胶3种佐剂混合。铝胶及Gel(02)佐剂按抗原∶佐剂 =3∶1的比例使用;PCP-2佐剂按200 μg/只小鼠进行配制。
1.8 小鼠分组及免疫 将BALB/c小鼠随机分为7组,每组5只,分别为单次免疫Gel(02)佐剂组、单次免疫PCP-2佐剂组和单次免疫铝胶佐剂组、2次免疫Gel(02)佐剂组、2次免疫PCP-2佐剂组、2次免疫铝胶佐剂组及对照组。免疫组每只小鼠后肢肌肉注射对应的0.1 mL免疫原,对照组免疫0.1 mL PBS。2次免疫组间隔14 d后再次免疫。间隔14 d采血,离心后收集血清,采用荧光抗体病毒中和试验(fluorescent antibody virus neutralization,FAVN)检测抗体效价,具体参照《中国药典》三部(2015版)规程。WHO狂犬病专家委员会及世界动物卫生组织(World Organization for Animal Health,OIE)均将血清中和抗体水平≥0.5 IU/mL作为有效抵抗狂犬病病毒感染的指标。
1.9 统计学分析 利用统计学软件GraphPad Prism 8.0.1进行统计学分析,实验数据使用One-way ANOVA方法进行分析,用平均值 ±标准偏差(mean±SD)表示,以P<0.05为差异有统计学意义。
2 结果
2.1 病毒摇瓶培养条件
2.1.1 病毒培养温度 结果显示,在37℃培养条件下,病毒增殖较慢,且在48 h后逐渐下降,108 h后,病毒滴度低于2×104TCID50/mL。34和30℃培养条件下,病毒滴度整体高于37℃条件下,且在60 h病毒滴度可达2×107.75TCID50/mL,高于30℃培养条件下的最高病毒滴度。见图1。
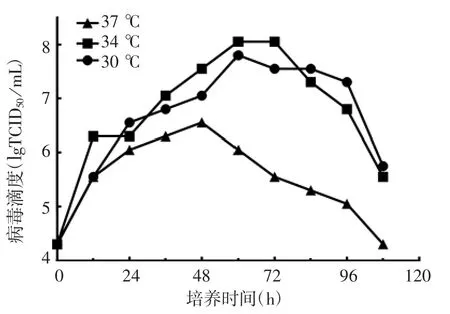
图1 摇瓶培养rCVS-11-dG株狂犬病病毒培养温度的优化Fig.1 Optimization of temperature for culture of rabies virus rCVS-11-dG strain in shake flask
2.1.2 病毒接种MOI 结果显示,当接种MOI为1和0.5时,病毒培养前36 h,病毒滴度随时间增加而增高,且1MOI培养条件下病毒滴度高于0.05MOI,随后病毒滴度下降。MOI为0.1、0.05和0.01时,病毒培养前60 h呈上升趋势,0.01 MOI在培养60 h时病毒滴度可达2×107.75TCID50/mL,高于同时间其他接种MOI的病毒滴度。60 h后病毒滴度逐渐下降,但在培养96 h时,病毒滴度仍可达2×106TCID50/mL,高于同时间其他4组。见图2。
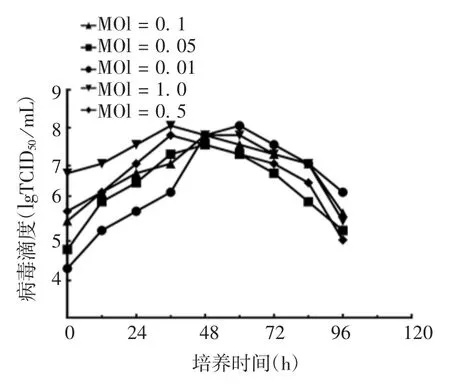
图2 rCVS-11-dG株狂犬病病毒摇瓶培养病毒接种MOI的优化Fig.2 Optimization of MOI for culture of rabies virus rCVS-11-dG strain in shake flask
2.1.3 细胞接种密度 结果显示,细胞接种密度为2×106个/mL时,病毒增殖较其他2组慢,病毒滴度也低于其他2组。细胞接种密度为3×106个/mL时,病毒培养至48 h,最高滴度高于4×106个/mL的接种密度,为2×108.25TCID50/mL。见图3。
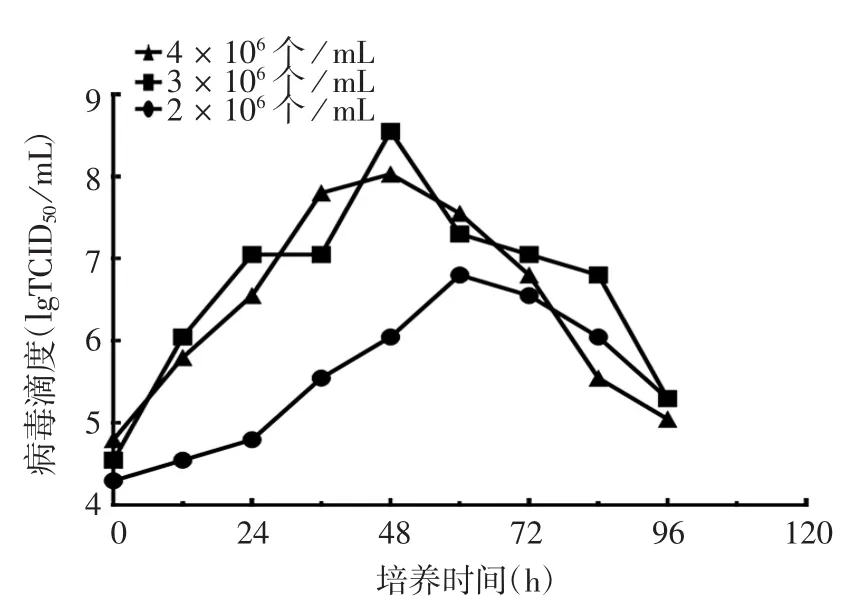
图3 rCVS-11-dG株狂犬病病毒摇瓶培养细胞接种密度的优化Fig.3 Optimization of initial cell density for culture of rabies virus rCVS-11-dG strain in shake flask
上述结果表明,rCVS-11-dG株狂犬病病毒在摇瓶中最优培养条件为:温度34℃,接种MOI=0.01,细胞接种密度为3×106个/mL时,最高病毒滴度可达2× 108.25TCID50/mL。
2.2 生物反应器培养病毒
2.2.1 细胞最适传代时间 结果显示,培养60 h时,细胞密度达6×106个/mL可进行细胞稀释传代接毒;培养84 h时,细胞密度达到最大,为7×106个/mL,之后细胞密度逐渐降低。见图4。
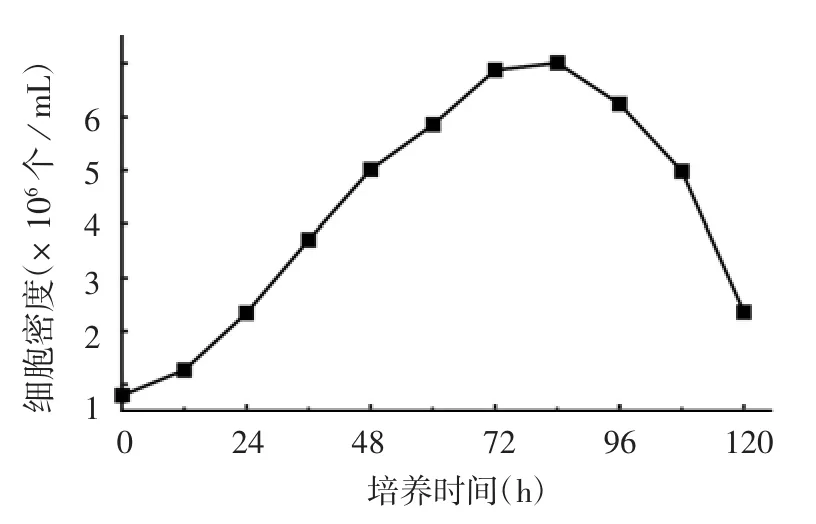
图4 BHK-21细胞在生物反应器中的生长曲线Fig.4 Growth curve of BHK-21 cells in bioreactor
2.2.2 病毒最适收毒时间 结果显示,在72~108 h时,病毒增殖进入平台期,培养108 h病毒滴度达到最高,为2×109TCID50/mL,之后病毒滴度下降,见图5。确定BHK-21细胞在生物反应器中初始细胞密度为3×106个/mL,接种MOI=0.01时,最适收毒时间为108 h。
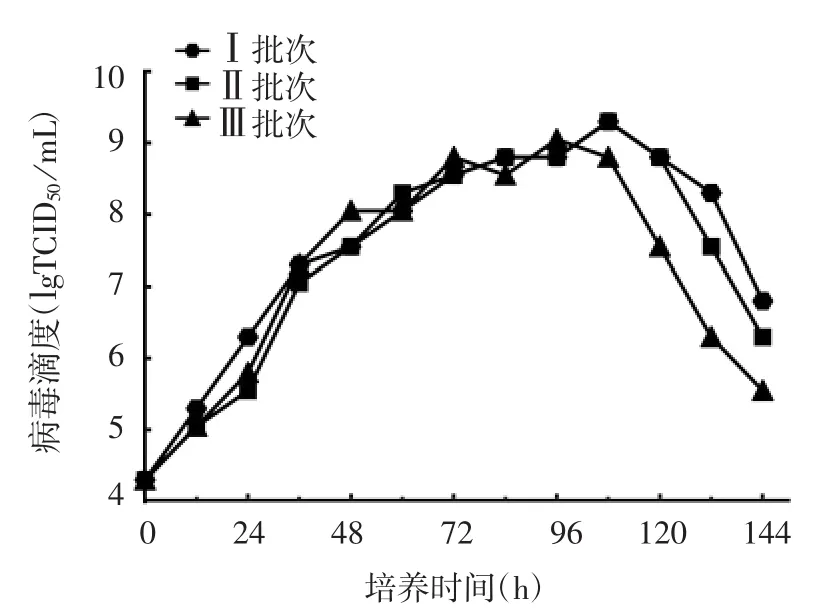
图5 生物反应器中rCVS-11-dG株狂犬病病毒一步生长曲线Fig.5 One-step growth curve of rabies virus rCVS-11-dG strain in bioreactor
2.3 小鼠免疫后抗体水平 不同佐剂组单次免疫小鼠结果显示,免疫后14 d,3种佐剂组抗体效价均高于0.5 IU/mL;免疫后28 d,Gel(02)佐剂组显著高于其他组,差异有统计学意义(P<0.001);免疫后42 d,Gel(02)佐剂组平均抗体效价为6.54 IU/mL,与其他组差异有统计学意义(P<0.001)。不同佐剂组2次免疫小鼠结果显示,28 d时Gel(02)佐剂组平均抗体效价可达42.14 IU/mL,显著高于与其他组,差异有统计学意义(P<0.001);42 d时Gel(02)佐剂组平均抗体效价略有降低,但平均抗体水平仍远高于0.5 IU/mL。见图6。综合以上结果,单次免疫组和2次免疫组首免后14 d抗体效价均高于0.5 IU/mL,表明首免后14 d即可产生保护效果,2次免疫组28、42 d抗体效价水平均高于单次免疫组,2次免疫效果优于单次免疫效果。

图6 单次(A)和2次(B)免疫后小鼠血清中和抗体效价Fig.6 Serum neutralizing antibody titers of mice immunized with one(A)and two(B)doses of immunogen
3 讨论
狂犬病自发现以来,目前尚无有效的治疗药物,因此,研制安全的兽用狂犬病疫苗,对于从源头防止人类感染狂犬病病毒至关重要。
2004年9月,在纽约曼哈顿,美国野生动物保护组织提出了“One World,One Health”,动员国际专家策划一个与威胁地球生命的疾病作斗争的方案,即曼哈顿原则。2007年12月,联合国粮食及农业组织(Food and Agriculture Organization of the United Nations,FAO)、OIE 和 WHO发起制定了“实现动物-人类-生态共同健康繁荣的全球战略框架协议”。曼哈顿原则的提出说明保护动物就是保护我们自己,认清人类和家畜或者野生动物之间发展关系对于全球健康有着重要的作用,因此兽用狂犬病疫苗研发对于人类健康有推进作用。
随着生物制品行业的发展与需要,生物反应器逐渐代替了转瓶生产模式,由于其自动化程度高、条件均一可控、产量大和成本低等优点,在国外已广泛应用于兽用疫苗领域,如印度的免疫技术公司用8 000 L生物反应器培养BHK-21细胞生产口蹄疫疫苗,美国的百特生物科技公司用6 000 L生物反应器培养Vero细胞生产流感疫苗。反应器在我国虽然起步较晚,但经过几十年的研究及实践,也有了飞速发展,吉林冠界生物有限公司和山东信德科技股份有限公司悬浮培养也已达到上千升规模,并获得生产批文。随着这一技术的发展,开展基于动物细胞大规模培养生产病毒疫苗的技术研究及建立相关技术平台,提升我国疫苗行业的产业水平和国际竞争力成为必然趋势。因此,本研究选择生物反应器作为狂犬病病毒培养工具,以期为生物反应器规模化生产狂犬病病毒及其灭活疫苗的工艺改进奠定基础。
不可避免的是,生物反应器在使用时,需要考虑剪切力的问题,哺乳动物细胞外无细胞壁的保护作用,如果搅拌转速过大,产生的剪切力较大,可能会造成细胞的大量死亡;如果搅拌速度较小则不能完全使细胞悬浮,与营养物质接触不完全。本研究开始接种细胞后,采用90 r/min的转速培养细胞,随着细胞密度的增大,再逐渐加大转速至120 r/min。在氧气供给方式上,采用液体上方供气的表层通气方式,可较大程度地避免气泡对细胞的剪切力。此外,相较于液体下方的深层通气方式,表层通气可及时将细胞代谢的废气排除,为细胞生长提供可适状态。在摇瓶优化病毒培养过程中,接种1 MOI条件下病毒培养36 h和接种0.01 MOI条件下病毒培养60 h所达到的最高病毒滴度相同,均为2×107.75TCID50/mL。但接种MOI越大,需要接入的病毒越多,且在随后的培养过程中,接种0.01 MOI条件下病毒培养96 h时,滴度仍可达到2×106TCID50/mL,高于0.1 MOI条件下病毒培养96 h时的病毒滴度,因此,选用接种0.01 MOI的培养条件。生物反应器培养病毒过程中,开始接毒后,随着细胞的增殖,病毒滴度也逐渐升高,之后进入平台期又增至最高,此过程中可能是由于病毒二次感染细胞所致,随后细胞大量死亡,病毒滴度下降。生物反应器由于可调控培养参数,使细胞在较适宜的环境中生长,因此培养时间也会延长,病毒培养108h时,病毒滴度最高可达2×109TCID50/mL,高于摇瓶培养时的病毒滴度。病毒灭活后加入3种佐剂制备成免疫原免疫小鼠,单次免疫和2次免疫后14 d抗体效价均高于0.5 IU/mL,证明利用悬浮培养的rCVS-11-dG株狂犬病病毒制备的免疫原仍可具有很好的保护作用。
综上所述,经实验优化,初步确定了BHK-21细胞从摇瓶到生物反应器的悬浮培养和放大的工艺,通过其培养的狂犬病病毒具有较高的病毒滴度,为后期规模化生产狂犬病病毒灭活疫苗的工艺改进奠定了基础。
