牛传染性鼻气管炎病毒多表位嵌合蛋白的表达及免疫原性分析
2021-02-25仝晓丹王俊冉旭华倪宏波闻晓波
仝晓丹 ,王俊 ,冉旭华 ,2,倪宏波 ,闻晓波 ,2
1.黑龙江八一农垦大学动物科技学院,黑龙江 大庆 163319;2.海南大学动物科技学院海南省热带动物繁育与疫病研究重点实验室,海南 海口 570228
牛传染性鼻气管炎病毒(infectious bovine rhinotracheitis virus,IBRV)又称牛 1型疱疹病毒(bovine herpesvirus 1,BHV-1),是危害养牛业发展的一种重要病原体,可导致鼻炎、阴道炎、肠炎、结膜炎、流产和脑炎等[1],进而继发其他病原体感染,加速动物死亡。IBRV急性感染后在三叉神经节形成潜伏感染,受到应激因素刺激后,可重新激活并向体外排毒,这给控制和消灭IBRV导致的相关疾病造成极大困难[2]。目前,一些国家通过扑杀阳性血清牛根除了该病,但耗资巨大,阳性率高的国家主要通过疫苗免疫来防控[3]。常用的疫苗主要有灭活疫苗、弱毒活疫苗、核酸疫苗和基因缺失疫苗。灭活疫苗虽能诱导较好的体液免疫,但免疫期短;弱毒活疫苗存在毒力返强可能。近年,欧洲一些发达国家多使用基因缺失疫苗用于牛传染性鼻气管炎(infectious bovine rhinotracheitis,IBR)的防治与净化,但基因缺失技术不完善,存在毒力返祖的可能性[4]。因此,研发更安全有效的疫苗在防控IBR中十分重要。由于基因工程亚单位疫苗具有稳定性强、安全性高及易制备等优势,已成为疫苗的研究热点,但其免疫原性较弱,限制了相关疫苗的研发进展[5]。与传统基因工程亚单位疫苗比较,多表位疫苗除可克服MHC类分子限制获得高效递呈外[6],还可消除多个全蛋白引起的容量限制[7]。
本研究利用基因工程方法制备含有IBRV已鉴定出的gB、gC和gD抗原表位及破伤风毒素通用T细胞表位P2的嵌合蛋白,并进行纯化,检测其在中国白兔体内的免疫原性,为进一步研发IBRV基因工程亚单位疫苗奠定基础。
1 材料与方法
1.1 细胞、毒株、质粒及菌株 MDBK细胞、IBRV、原核表达载体 pET-28a(+)、感受态 E.coli DH5α 和感受态E.coli BL21(DE3)均由黑龙江八一农垦大学预防兽医学实验室保存。
1.2 主要试剂及仪器 限制性内切酶NheⅠ和HindⅢ购自美国Fermentas公司;连接试剂盒购自日本TaKaRa公司;质粒提取及胶回收试剂盒购自美国OMEGA公司;小鼠gD单克隆抗体由黑龙江八一农垦大学动物医学重点实验室制备保存;HRP标记的山羊抗小鼠IgG和山羊抗兔IgG购自北京博奥森生物技术有限公司;DAB显色试剂盒购自北京中杉金桥生物技术有限公司;TMB显色液购自北京索莱宝科技有限公司;Ni-NTA Purification System及Micro BCA Protein Assay Kit购自美国ThermoFisher Scientific公司。
1.3 实验动物 清洁级中国白兔,雌性,70~75日龄,体重约2 kg,购自哈尔滨医科大学实验动物中心,动物合格证号为:SCXK(黑)2017-008。
1.4 IBRV多抗原表位基因串联设计 根据文献报道的 gB[8]、gC[9]和 gD[10-11]相关抗原表位序列及gD[12]B细胞表位,分别以 AAYAAY及GGGGS为linker将抗原表位及破伤风毒素通用T细胞表位P2按不同方式排列组合,应用DNASTAR Protean软件对其抗原性进行分析,选取抗原性参数较好的组合,并在串联基因上设置酶切位点,委托北京华大基因公司合成,将合成的基因序列命名为P2-gB/gC/gD(GGGGS)及 P2-gB/gC/gD(AAYAAY)。gB、gC和gD的相关抗原表位及破伤风毒素通用T细胞表位P2氨基酸序列见表1。

表1 P2及IBRV表位氨基酸序列Tab.1 Amino acid sequences of P2 and IBHV epitopes
1.5 重组质粒的构建 将两种重组的基因序列和载体pET-28a(+)分别用NheⅠ和HindⅢ双酶切,回收目的基因片段及载体片段,于16℃连接过夜;将连接产物转化至感受态E.coli DH5α,37℃培养12 h;挑取单菌落,接种至含50 μg/mL卡那霉素的LB培养基中,37℃,200 r/min振荡培养6 h;按1∶100的比例转接至3 mL含50 μg/mL卡那霉素的LB培养基中,继续培养过夜。提取质粒进行NheⅠ和HindⅢ双酶切鉴定,并将鉴定正确的质粒送至北京华大基因公司测序。
1.6 重组蛋白的表达 将两种重组质粒及空载体pET-28a(+)分别转化至感受态 E.coli BL21(DE3),37℃培养12 h;挑取单菌落,接种至含50 μg/mL卡那霉素的LB培养基,37℃,200 r/min培养过夜;按1∶100的比例转接至3 mL含50 μg/mL卡那霉素的LB培养基,继续培养至A600≈ 0.5时,加入IPTG至终浓度1 mmol/L,于37℃诱导4 h;6 000× g离心5 min,收集菌体,PBS洗涤3次,适量PBS重悬,经冰浴超声破碎,12 000×g离心20 min,分别收集上清和沉淀,进行12% SDS-PAGE分析。
1.7 重组蛋白的鉴定 采用Western blot法。沉淀菌体经12% SDS-PAGE分离后,转至PVDF膜,用5%脱脂乳于4℃封闭过夜;加入小鼠gD单克隆抗体(1∶1 000稀释),37℃孵育1 h;PBST洗涤3次,加入HRP标记的山羊抗小鼠IgG(1∶5 000稀释),37℃孵育1 h;PBST洗涤3次,加入DAB显色液,ddH2O终止显色。
1.8 重组蛋白的纯化 重组菌经大量诱导后,收集菌体,PBS洗涤3次,加入含8 mol/L尿素的Dena-t uring Binding Buffer,重悬菌体,置于冰上,超声破碎后,收集上清。Ni-NTA Purification System纯化重组蛋白,产物经12% SDS-PAGE和Western blot鉴定。用含10 mmol/L Tris和0.1% Trionx-100的透析液,将纯化产物于4℃透析过夜,以去除尿素,使蛋白复性,经Micro BCA Protein Assay Kit进行蛋白定量。
1.9 动物分组及给药 将重组蛋白用PBS溶液稀释至 200 μg/mL,按 1 ∶1(V/V)的比例加入 ISA206佐剂,进行充分乳化。取9只中国白兔,随机分为3组:P2-gB/gC/gD(GGGGS)组、P2-gB/gC/gD(AAYAAY)和佐剂对照组(PBS溶液与ISA206佐剂等比例乳化)。经白兔后腿肌肉多点注射,前2组剂量为 100 μg/(mL·只),对照组剂量为 1 mL/只。每隔3周免疫1次,共3次,在免疫前及每次免疫后3周(即初次免疫后21、42和63 d),经白兔耳缘静脉采血,分离血清,-20℃保存。
1.10 血清抗体水平的检测 采用间接ELISA法。用0.05 mol/L碳酸盐(pH 9.6)包被缓冲液稀释浓缩后的 IBRV 至 2 μg/mL,按 100 μL/孔包被 96孔板,4℃过夜;用5%脱脂乳于37℃封闭2 h;加入待检血清(1∶100稀释),100 μL/孔,重复 3孔,同时设空白对照,37℃作用1 h;加入HRP标记的山羊抗兔IgG(1∶5 000稀释),100 μL/孔,37 ℃作用1 h;加入 TMB 显色液,100 μL/孔,37 ℃显色 15 min,用酶标仪测定A450值。
1.11 统计学分析 应用GraphPad Prism 7.00软件进行统计分析,数据采用均值±标准差(±s)表示,组间比较采用Two-way ANOVA方法,以P<0.05为差异有统计学意义。
2 结果
2.1 IBRV抗原表位的选择及串联设计 DNA STAR Protean软件分析表明,以图1的方式连接抗原参数较好,抗原参数分析结果见图2。
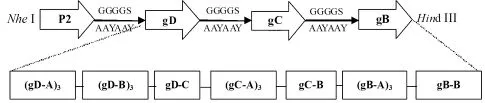
图1 多表位序列串联连接及酶切位点设置模式图Fig.1 Schematic diagram of construction of multiple-epitope recombinant protein and setting of restriction endonuclease
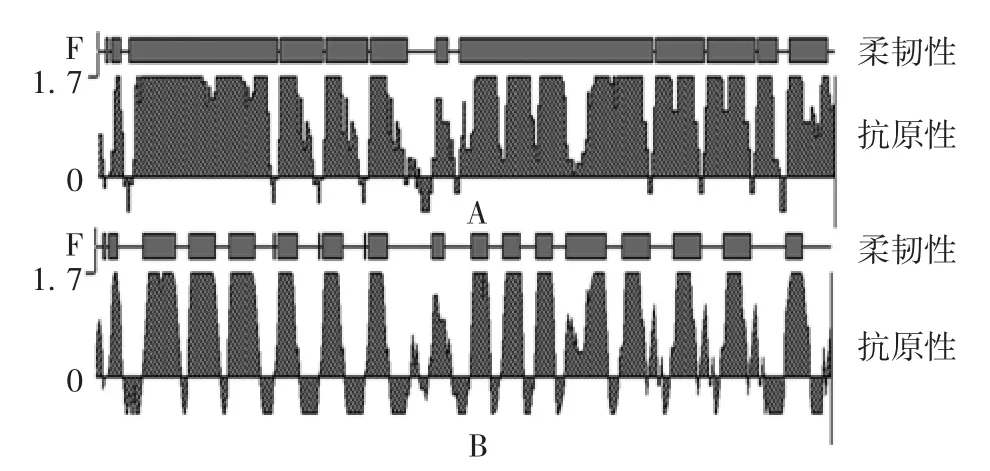
图2 多表位串联序列抗原性分析结果Fig.2 Analysis of antigenicity of multiple-epitope tandem sequences
2.2 重组质粒的鉴定 两种重组质粒双酶切(NheⅠ/HindⅢ)产物经1%琼脂糖凝胶电泳分析,均分别可见约1 100 bp的目的片段及约5 200 bp的载体条带,见图3。测序结果表明,目的片段序列与设计完全一致。
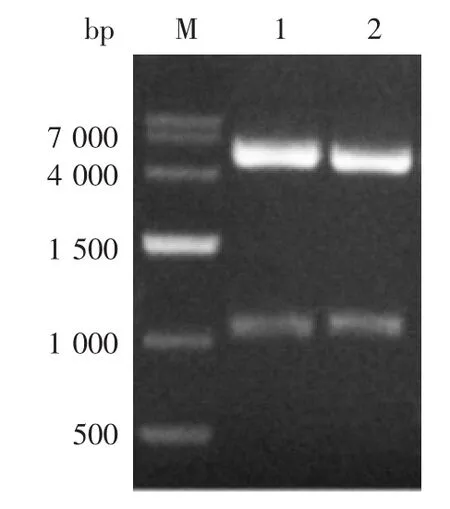
图3 重组质粒的双酶切(NheⅠ/HindⅢ)鉴定Fig.3 Restriction map of recombinant plasmids(NheⅠ/HindⅢ)
2.3 重组蛋白的鉴定 两种重组质粒P2-gB/gC/gD(GGGGS)及 P2-gB/gC/gD(AAYAAY)转染菌分别可见相对分子质量约70 000和63 000的目的蛋白条带,以包涵体形式表达,但条带大于理论值(约44 000和48 000),见图4。重组蛋白可与gD单克隆抗体发生特异性反应,且于相对分子质量约70 000和63 000处可见特异性结合条带,大于理论值,见图5。
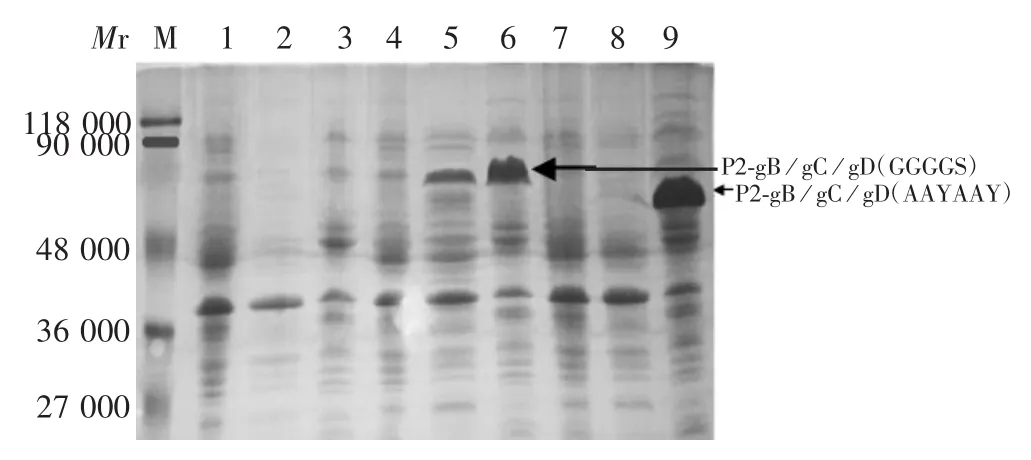
图4 重组蛋白的SDS-PAGE鉴定Fig.4 SDS-PAGE profile of recombinant chimeric proteins
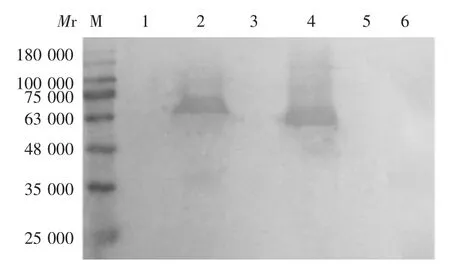
图5 重组蛋白的Western blot鉴定Fig.5 Western blotting of recombinant chimeric proteins
2.4 纯化产物的鉴定 SDS-PAGE及Western blot鉴定结果与2.3项一致,见图6。重组蛋白P2-gB/gC/gD(GGGGS)和 P2-gB/gC/gD(AAYAAY)产量分别达12.4和15.3 mg/L。

图6 纯化蛋白的SDS-PAGE(A)及Western blot(B)鉴定Fig.6 SDS-PAGE(A)and Western blot(B)profiles of purified chimeric proteins
2.5 白兔血清中的抗体水平 初次免疫后21、42和63 d,P2-gB/gC/gD(AAYAAY)组白兔血清的抗体水平均显著高于P2-gB/gC/gD(GGGGS)组(F分别为 63.2、214.2 和 579.2,P 分别为 0.011 3、<0.000 1 和 <0.000 1),见图 7。
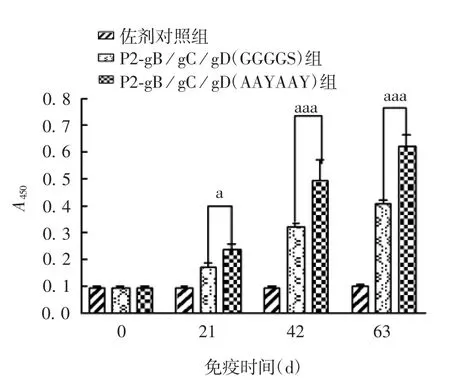
图7 各组白兔血清的抗体水平Fig.7 Serum antibody levels of rabbits in various groups
3 讨论
本研究通过查阅文献获得已鉴定出的gB、gC、gD相关抗原表位,采用原核表达系统表达多表位串联连接的重组嵌合蛋白,并以家兔为动物模型,对其免疫原性进行评价。鉴于基因工程亚单位疫苗免疫原性弱的特点,在多表位序列串联的基础上,前段串联一种通用T细胞表位P2,其为破伤风毒素表位,具有促进抗体的分泌,延长抗体持续期等作用[13-15]。为避免抗原表位间相互干扰形成新的表位,影响免疫原性,本实验在表位间采用linker进行连接。linker在嵌合蛋白表达中对蛋白的正确折叠、加工和生物活性发挥重要作用[16]。Linker按功能特性可分为刚性和柔性两种,柔性linker连接的嵌合蛋白具有良好的亲水性和伸展性;刚性linker虽亲水性较差,但可使各表位间互无干扰,维持良好的抗原参数[17],但还需根据动物免疫效果来确定。因此,为选择适合该嵌合蛋白的linker,分别设计构建了以GGGGS和AAYAAY两种linker连接的嵌合蛋白,并将两种纯化蛋白分别与ISA206佐剂乳化后免疫中国白兔,检测结果发现,AAYAAYlinker连接的嵌合蛋白诱导产生的抗体水平明显高于GGGGSlinker连接的重组蛋白(P<0.05)。且SDS-PAGE分析表明,两种不同linker连接重组蛋白的相对分子质量均比理论相对分子质量偏大,推测其除蛋白自身结构影响外,还有可能与His-Tag标签有关,His-Tag标签含有6个连续的组氨酸,属于碱性氨基酸,携带较强的正电荷,使蛋白在SDS-PAGE中的泳动速率减慢,从而导致蛋白的相对分子质量偏大[18]。另外,Western blot鉴定结果显示,该蛋白可与gD单克隆抗体发生特异性结合,表明表达的蛋白为P2-gB-gC-gD重组蛋白。
目前,疫苗接种是防控IBR的最有效途径,国外多采用基因缺失疫苗防控和净化IBRV,主要包括gE、TK和US2相关基因缺失疫苗[19-21]。但该类疫苗在怀孕母牛和犊牛的预防免疫上存在风险[22]。国内尚无商品化的基因缺失疫苗,均处于实验研究阶段[20,23],其中 IBRV-BVDV 二价灭活疫苗的安全性和免疫效果还需进一步评估。与传统疫苗比较,基因工程亚单位疫苗由于具有安全性高和易制备等优势成为研究热点[24],如侯亚兰等[25]将 IBRV gD 与BVDV E2抗原表位进行连接,表达的重组嵌合蛋白具有良好的免疫原性。本研究表达的BHV-1重组多表位嵌合蛋白具有较好的安全性,但目前仅于家兔体内进行了初步免疫学评价,今后将在犊牛、青年牛及怀孕母牛体内进行安全性和免疫效力的评价。
