植物乳杆菌UD01对具核梭杆菌生物膜形成的抑制
2021-02-25钟焱婷
钟焱婷, 杨 虹
(上海交通大学 生命科学技术学院 微生物代谢国家重点实验室, 上海 200240)
口臭是临床常见症状,在成年人中发病率约为25%[1]。具核梭杆菌(Fusobacteriumnucleatum)是引起口臭的致病菌之一,它能降解含硫氨基酸生成难闻的挥发性硫化物(VSCs)[2],更重要的是,它在口腔菌斑生物膜形成的过程中,起到桥接早晚期定植菌、为晚期定植的厌氧菌提供结合位点的重要作用。有研究发现在缺乏具核梭杆菌的情况下,其他致臭菌如牙龈卟啉单胞菌等晚期定植菌黏附率显著降低[3]。生物膜状态的菌株抗逆性远远大于浮游细菌[4]。因此,具核梭杆菌形成生物膜是造成口臭的关键,而抑制其生物膜为缓解口臭提供了可能性。
临床上治疗口臭主要采用机械法和化学法,存在复发率高、副作用较多等问题,有待开发如益生菌生物制剂等方法。研究表明,部分益生菌,如食窦魏斯氏菌[5]、唾液链球菌K12[6]、乳酸乳球菌[7]能通过抑制致臭菌生长或中和 VSCs从而缓解口臭。然而,目前尚没有益生菌作用于致臭菌生物膜的研究,而致臭菌形成生物膜是口臭不易治疗的主要原因之一[8]。
近年来,如何有效抑制致病菌生物膜形成已成为研究热点,生物膜的形成是一个动态过程,分为初始黏附、微集落形成以及生物膜的成熟与分散等3个阶段,初始黏附与菌体表面蛋白、多肽、黏附素等密切相关,EPSs对微集落形成和生物膜结构的发展至关重要[9-10]。具核梭杆菌存在多个与生物膜形成相关的外膜蛋白,其中,radD[11]、fap2[12]、aim1[13]和cmpA[14]基因编码4个类自转运蛋白,fomA[15]基因编码孔蛋白,fadA[16]基因编码黏附素,均被证实具有介导黏附的功能,与生物膜初始黏附相关。
本研究从多株益生菌中筛选到一株在中性 pH(pH 6.6)条件下仍能有效抑制具核梭杆菌生物膜形成的植物乳杆菌UD01,初步探究该菌株如何抑制具核梭杆菌生物膜形成,以期为益生菌用于缓解口臭提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株
试验菌株由嘉兴益诺康生物科技有限公司提供:植物乳杆菌LactobacillusplantarumZM02;唾液乳杆菌LactobacillussalivariusZM06;唾液链球菌StreptococcussalivariusZM252;嗜热链球菌StreptococcusthermophilusZM236;植物乳杆菌LactobacillusplantarumUD01;唾液乳杆菌LactobacillussalivariusUD06。
具核梭杆菌(F.nucleatumATCC 25586)购自美国菌种保藏中心(ATCC)。
1.1.2 试剂
MRS 培养基购于青岛海博生物技术有限公司;TSB 培养基购于北京索莱宝科技有限公司;无菌脱纤维羊血购于南京茂捷微生物科技有限公司;SYTO-9染料购于赛默飞世尔科技公司;Bradford法蛋白浓度测定试剂盒购于上海生工生物股份有限公司;RNAprep Pure Cell/Bacteria Kit购于天根生化科技有限公司;TransScript one-step gDNA removal and cDNA synthesis、TransStart Top Green qPCR SuperMix均购于北京全式金生物有限公司。
1.2 方法
1.2.1 菌株的筛选
1)益生菌无细胞发酵上清液的制备。活化后的益生菌菌株按1%接种量接种于MRS肉汤,37 ℃厌氧培养24 h,4 ℃、500 r/min离心5 min,NaOH(1mol/L)调节上清液pH值至6.6±0.02,并用0.22 μm滤膜过滤除菌。
2)生物膜形成实验。取100 μLF.nucleatum菌液(1×107CFU/mL)加入96孔板,再加入50 μL益生菌 CFS(pH 6.6)、50 μL TSB肉汤,以MRS肉汤(pH 6.6)作为对照。培养24 h后吸出培养液,200 μL PBS洗涤3次;100 μL甲醇固定15 min后,吸出甲醇,晾干;100 μL体积分数为1%的结晶紫染色5 min后,吸去结晶紫并冲洗干净;37 ℃倒置烘干;100 μL体积分数为33%的冰乙酸37 ℃溶解30 min;检测OD590。
1.2.2 UD01上清液在中性 pH 条件下对具核梭杆菌生物膜形成的抑制作用
1)MBIC的确定。96孔板的第1列加入100 μL UD01 CFS(pH 6.6),以MRS(pH 6.6)肉汤作为对照;第1~5列加入100 μL TSB肉汤,倍比稀释法将第1列液体混匀后取100 μL加入第2列,依次进行直到第4列,第4列液体混匀后弃去100 μL;在96孔板的第1~5列中各接入100 μLF.nucleatum菌液(1×107CFU/mL)。24 h后按1.2.1节生物膜形成试验的方法测定生物膜量。显著抑制F.nucleatum生物膜形成的UD01 CFS(pH 6.6)的最低体积浓度为MBIC[17]。
2)生物膜结构观察。在24孔板中央放置直径8 mm的盖玻片,加入500 μL TSB肉汤、1 mLF.nucleatum菌液(1×107CFU/mL)、500 μL UD01CFS(pH 6.6、MBIC浓度),以MRS肉汤(pH 6.6)作为对照;培养24 h后,PBS清洗生物膜3次;置于戊二醛(体积分数为2.5%)中4 ℃过夜;梯度乙醇洗脱;临界点干燥,喷金;SEM观察。
3)生物膜厚度测定。按生物膜结构观察试验的方法制取、洗涤F.nucleatum生物膜;暗室中加入200 μL SYTO-9染料,避光孵育20 min;吸去染液、PBS洗涤 1次;样品有生物膜的一面朝下盖在20 mm×20 mm的盖玻片上;CLSM对生物膜Z轴方向扫描成像。
1.2.3 探究UD01上清液在中性 pH 条件下抑制具核梭杆菌生物膜形成的机制
1)生长曲线。调节TSB肉汤使其含有MBIC浓度的UD01 CFS(pH 6.6),对照组含有等量MRS肉汤(pH 6.6),接种F.nucleatum至菌浓度为5×106CFU/mL,37 ℃厌氧孵育,每隔2 h测菌液OD600,绘制生长曲线。
2)荧光定量PCR。按生物膜结构观察试验的方法制取、洗涤F.nucleatum生物膜,用RNAprep Pure Cell/Bacteria Kit试剂盒提取生物膜RNA,TransScript one-step gDNA removal and cDNA synthesis试剂盒逆转录合成cDNA,具体步骤按说明书操作。qPCR引物序列如表1,反应条件:95 ℃ 预变性2 min;95 ℃ 变性15 s,55 ℃ 退火15 s,68 ℃ 延伸20 s,循环40次。以16S rRNA作为内参,2-ΔΔCt法计算基因相对表达量。

表1 实时荧光定量反应中的引物
3)胞外EPSs含量测定。
①热处理法提取生物膜EPSs[18]:PBS洗涤生物膜3次,将生物膜全部吹打下来并调节至OD600为2.0±0.01的菌悬液;取1 mL菌悬液80 ℃水浴30 min;5 000 r/min离心15 min,0.22 μm滤膜过滤后即为EPSs提取液。另取30 mL 生物膜悬液,5 000 r/min离心15 min,弃上清液,沉淀80 ℃烘干至恒重E1,每毫升F.nucleatum生物膜菌悬液干重为W1=E1/30。
②Bradford法测定胞外蛋白:按照Bradford法蛋白浓度测定试剂盒说明书操作,利用标准曲线计算样品的蛋白浓度α,再根据样品体积和干重计算生物膜胞外蛋白含量P(μg/mg)=α×1 mL/W1。
③硫酸苯酚法测定胞外多糖:配制5~120 μg/mL葡萄糖标准溶液;取1 mL葡萄糖标准溶液或EPSs提取液加入具塞试管,以ddH2O作为空白对照;加入1 mL苯酚(体积分数为5%)振荡10~20 s;加入5 mL浓硫酸,沸水浴15 min后测定OD490;利用标准曲线计算样品的多糖浓度β,生物膜胞外多糖含量R(μg/mg)=β×1 mL/W1。
1.2.4 统计学分析
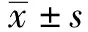
2 结果与分析
2.1 菌株的筛选
6株待筛选的益生菌中仅有UD01CFS(pH 6.6)对F.nucleatum生物膜的抑制效果是显著的,故将UD01作为后续试验菌株(表2)。

表2 益生菌上清液在中性 pH 条件下对具核梭杆菌生物膜的抑制
2.2 UD01上清液在中性 pH 条件下对具核梭杆菌生物膜形成的抑制作用
2.2.1 MBIC的确定
抑制生物膜的研究通常以药物的MBIC水平进行[17],当UD01 CFS(pH 6.6)稀释至浓度达到25%原液,F.nucleatum生物膜形成量显著下降,且此浓度下对照组的生物膜形成量不受影响(图1),由此确定UD01 CFS(pH 6.6)对F.nucleatum生物膜的MBIC为250 μL/mL。

图1 UD01上清液(pH 6.6)对具核梭杆菌生物膜形成的最低抑制浓度
2.2.2 UD01上清液在中性 pH 条件下对具核梭杆菌生物膜结构和厚度的影响
1)扫描电镜试验。对照组F.nucleatum生物膜结构致密[图2(b)(d)],而试验组结构疏松,菌体间存在较大间隙[图2(a)(c)],且在制备 SEM 样品过程中,易被水流破坏,说明 UD01 CFS(pH 6.6)导致其对玻片的黏附力降低。

(a)试验组(1 000×);(b)对照组(1 000×);(c)试验组(3 000×);(d)对照组(3 000×)
2)激光共聚焦显微镜试验。对照组生物膜最大厚度将近16 μm[图3(b)],实验组生物膜的最大厚度仅为10 μm左右[图3(a)],UD01 CFS(pH 6.6)导致F.nucleatum生物膜变薄。

(a)试验组;(b)对照组
2.3 UD01上清液在中性 pH条件下抑制具核梭杆菌生物膜形成的机理探究
2.3.1 UD01上清液在中性 pH条件下对具核梭杆菌生长的影响
试验组F.nucleatum生长曲线与对照组基本一致(图 4),说明UD01 CFS(pH 6.6)无法抑制F.nucleatum生长。

图4 UD01上清液在中性 pH条件下对具核梭杆菌生长曲线的影响
2.3.2 UD01上清液在中性 pH 条件下对具核梭杆菌外膜黏附相关蛋白的影响
F.nucleatum外膜黏附相关蛋白基因表达均显著下调,其中,cmpA基因表达下调了10 倍以上。提示UD01 CFS(pH 6.6)可能通过影响初始黏附,进而抑制F.nucleatum生物膜形成(图5)。

图5 UD01上清液在中性pH条件下对具核梭杆菌黏附相关基因表达的影响
2.3.3 UD01上清液在中性 pH 条件下对具核梭杆菌生物膜EPSs的影响
细菌通过生长增殖过程中产生的EPSs将单个菌粘连成微集落,大量微集落逐渐形成生物膜结构并不断增厚。实验组胞外蛋白和多糖的含量均显著降低,推测UD01 CFS(pH 6.6)可以通过减少胞外蛋白和多糖含量来抑制F.nucleatum生物膜结构发展(图6)。

图6 UD01 上清液在中性 pH 条件下对具核梭杆菌生物膜EPSs含量的影响
3 讨论与结论
试验用益生菌均为乳酸菌,其生长过程中会分泌大量有机酸,目前研究证实这些酸性物质虽然能抑制致病菌生物膜形成,然而,一旦pH值上升后作用效果不佳,如Nostro等[19]研究表明乙酸、乳酸在上调pH值后,对金黄色葡萄球菌及表皮葡萄球菌生物膜的抑制作用均下降。生理学指出健康口腔pH值范围为6.6~7.1[20],益生菌在口腔中使用可能会受到口腔中性pH环境的影响,使得有机酸等活性物质无法发挥作用。因此,益生菌需存在除酸以外的活性物质,才能在口腔中发挥功效,以口腔pH值作为前提条件筛选菌株与益生菌的实际应用更贴合。另外体外试验中用于培养具核梭杆菌的 TSB 肉汤pH约7.2,为确保益生菌上清液与 TSB 肉汤混合后酸碱度在口腔中性 pH 范围内,将益生菌上清液 pH值调至6.6,最终筛选出一株植物乳杆菌 UD01,其上清液(pH 6.6)显著抑制具核梭杆菌生物膜形成。
现阶段关于抑制生物膜的机制研究,多数有效成分是通过抑菌或杀菌机制来抑制细菌生物膜的形成[21-22],然而生长曲线显示 UD01 CFS(pH 6.6)无法抑制具核梭杆菌生长,这与李琛等[23]发现右旋氨基酸在不影响牙龈卟啉单胞菌生长的同时抑制其生物膜形成的情况相类似,说明其不是通过减少具核梭杆菌数量抑制生物膜的。此外,前人研究发现,一些活性物质,如唾液乳杆菌[24]、槲皮素[25],能通过下调与生物膜形成相关基因表达或影响 EPSs含量来抑制变异链球菌或单增李斯特菌生物膜形成,结合 qPCR 和 EPSs含量测定试验,本研究发现UD01 CFS(pH 6.6)既减少了具核梭杆菌生物膜胞外蛋白和多糖分泌量,又削弱了其黏附相关基因的表达水平。
本研究筛选出一株在口腔中性pH时仍能有效抑制具核梭杆菌生物膜形成的植物乳杆菌UD01,该菌株能通过下调具核梭杆菌黏附相关基因表达、降低 EPSs含量来减少具核梭杆菌生物膜形成,并使其致密度显著疏松,厚度变薄。
