淫羊藿素对人肺腺癌细胞诱导破骨细胞前体细胞向破骨细胞分化的影响及机制
2021-02-25赵雪强蒋碧佳银建华卢春兰林云
赵雪强,蒋碧佳,银建华,卢春兰,林云
桂林医学院第二附属医院,桂林541199
在各种常见恶性肿瘤中,肺癌的发病率和病死率一直居高不下。尽管随着手术、化疗、分子靶向治疗及放疗等综合治疗后患者的中位生存期较前明显延长,但肺癌骨转移的发生率也随之增高,有30%~40%的患者发生骨转移及骨痛、病理性骨折、高钙血症等骨相关事件,严重影响患者的生活质量和生存期[1]。目前肺癌是影响我国居民健康的首要恶性肿瘤,发病率和病死率呈逐年上升趋势,治疗负担日益加重,需采用积极有效的防治措施。肺癌骨转移临床大多表现为溶骨性改变,主要是过度激活的破骨细胞(OC)导致骨吸收。因此,抑制OC 分化是治疗肺癌骨转移的关键[2]。研究表明,中药可通过促进成骨细胞生成和抑制OC 的分化调节骨代谢[3]。淫羊藿及其衍生物具有调节免疫及内分泌、抗肿瘤、抗骨质疏松等药理作用[4]。陈琛[5]研究发现,淫羊藿可减轻乳腺癌骨转移所引发的溶骨性骨质受损和骨痛,其作用机制可能为抑制过度激活的OC,但其分子机制仍不明确。基于此,2019 年8 月—2020 年4月我们观察了淫羊藿素对人肺腺癌A549细胞与OC前体细胞RAW264.7 共培养后OC 分化、凋亡的影响,并探讨其可能的作用机制。
1 材料与方法
1.1 实验材料 人肺腺癌细胞株(A549 细胞)及OC 前体细胞(RAW264.7 细胞,中科院昆明细胞库),淫羊藿素(99%以上纯度,上海陶素生化科技有限公司),核因子κB 受体活化因子配体(RANKL,95%以上纯度,北京义翘神州科技股份有限公司),胎牛血清(FBS)、DMEM 培养液(美国赛默飞世尔科技公司),MTT(美国 AMEROCO 公司),TRIzol、AMV第一链cDNA 合成试剂盒[天根生化科技(北京)有限公司],PCR System(美国赛默飞世尔科技公司),鼠抗腺苷酸活化的蛋白激酶(AMPK)、磷酸化腺苷酸活化的蛋白激酶(p-AMPK,英国abcam 公司),细胞裂解液、苯甲基磺酰氟(PMSF,碧云天生物技术有限公司),β-actin 一抗、辣根过氧化物酶体标记山羊抗小鼠IgG(北京中杉金桥生物技术有限公司),0.4 μm PVDF 膜(美国Millipore 公司),BCA 蛋白浓度测定试剂盒、SDS-PAGE 电泳液、Western blotting 转膜液(碧云天生物技术有限公司),DAB 辣根过氧化物酶显色试剂盒(北京中杉金桥生物技术有限公司)。
1.2 细胞培养 将A549细胞及RAW264.7细胞分别接种于含10% FBS 的DMEM 培养液中,在37 ℃、5%CO2、饱和湿度下培养,2~3 d传代1次,待细胞生长至对数生长期用于后续实验。
1.3 淫羊藿素对RAW264.7细胞、A549细胞活力的影响 将生长活力良好的RAW264.7细胞按每孔400个加入96孔板,待细胞贴壁后分为对照组、0.1 μmol/L淫羊藿素组、1 μmol/L 淫羊藿素组、10 μmol/L 淫羊藿素组和100 μmol/L 淫羊藿素组,分别加入0、0.1、1、10、100 μmol/L 的淫羊藿素,每浓度设 3 个复孔,同时设空白对照(仅加培养液),分别干预24、48、72 h后,每孔加5 mg/mL的MTT 20 μL,继续培养4 h,弃掉培养液,每孔加DMSO 200 μL,振荡5 min,使沉淀充分溶解。用酶标仪测490 nm 波长处的吸光度(A)值。同时设置调零孔(培养基、MTT、二甲基亚砜),对照孔(细胞、相同浓度的药物溶解介质、培养液、MTT、二甲基亚砜)。A549 细胞以每孔200 个加入96 孔板,待细胞贴壁后分为对照组、10 μmol/L 淫羊藿素组、20 μmol/L 淫羊藿素组、30 μmol/L 淫羊藿素组和40 μmol/L 淫羊藿素组,分别加入 0、10、20、30、40 μmol/L 的淫羊藿素,每浓度设3 个复孔,同时设空白对照(仅加培养液)。分别干预24、48、72 h后,用上述方法测A 值。细胞活力=实验孔吸光度值/对照空吸光度值×100%。
1.4 淫羊藿素对A549细胞诱导RAW264.7细胞向OC 分化的影响检测 因10 μmol/L 以上浓度的淫羊藿素对RAW264.7 细胞活力有影响,因此选用淫羊藿素5、10 μmol/L 两个浓度进行实验。取对数生长期的A549细胞和RAW264.7细胞,分别以0.25%胰酶消化,加入DMEM 培养基分别制备5×103/mL 的A549 单细胞悬液和 1×104/mL 的 RAW264.7 单细胞悬液,在 Transwell 上室接种 A549 细胞,Transwell 下室接种RAW264.7 细胞,加入含10% FBS 的DMEM培养基(含100 U/mL青霉素和100 μg/mL链霉素)培养,将Transwell 置入6 孔板里,并置于37 ℃、5%CO2培养箱中培养7 d。不加A549 细胞的RAW264.7 细胞(1×104/mL)加RANKL(50 ng/mL),在相同培养条件下培养7 d 作为阳性对照组。将RAW264.7 细胞随机分为对照组、淫羊藿素低剂量组、淫羊藿素高剂量组,分别加入 0.01% DMSO、5 μmol/L 淫羊藿素、10 μmol/L 淫羊藿素干预48 h,做抗酒石酸磷酸酶(TRAP)染色。20 倍光镜下观察并进行TRAP 阳性细胞计数。细胞核数目≥3个且TRAP染色阳性细胞为OC。随机取5个视野计数。
1.5 OC 凋亡率测算 采用流式细胞术。RAW264.7 与 A549 细胞共培养,待 OC 融合度至70%时,用PBS 漂洗2 遍,按上述淫羊藿素浓度进行处理后,每浓度设3个复孔,继续培养48 h后收集细胞,制成单细胞悬液,70%冷乙醇固定,4 ℃过夜,检测前用 PBS 洗去固定液,加入 20 μL Rnase A,37 ℃孵育 30 min,暗处加 PI 染液,冰浴 30 min,以 300 目筛网过滤。调整细胞为1×106/mL,以流式细胞仪进行检测,激发光源为氩离子,激发波长488 nm,用Multicycle DNA 分析软件测算细胞凋亡率。
1.6 OC 中 AMPK、mTOR、CTSK mRNA 表达检测采用实时荧光定量PCR法。用TRIzol试剂从处理过的细胞中提取总RNA,提取总RNA,按北京天根生化公司提供的试剂操作步骤进行操作。用M-MLV First-Strand Syntehsis Kit 将 RNA(2 μg)逆转录成互补DNA。AMPK 上游引物序列5'-TTTGCGTGTAC⁃GAAGGAAGAAT-3',下游引物序列 5'-CTCTGTG⁃GAGTAGCAGTCCCT-3';mTOR 上 游 引 物 序 列 5'-TCCGAGAGATGAGTCAAGAGG-3',下游引物序列5'-CACCTTCCACTCCTATGAGGC-3';CTSK 上 游 引物序列 5'-ACTCAAAGTACCCCTGTCTCAT-3',下游引物序列 5'-CCACAGAGCTAAAAGCCCAAC-3';βactin 上游引物序列5'-AAAGACCTGTACGCCAA⁃CAC-3',下游引物序列 5'-GTCATACTCCTGCTT⁃GCTGAT-3'。qPCR 反 应体系 20 μL,反应条 件:94 ℃预变性3 min后,94 ℃变性15 s,60 ℃退火30 s,72 ℃延伸30 s,共30 个循环;72 ℃延伸5 min。通过2-ΔΔCt法计算基因相对表达量。
1.7 OC 中AMPK、p-AMPK、mTOR、p-mTOR 蛋白表达检测 采用Western blotting 法。用细胞裂解液提取细胞蛋白,用蛋白定量试剂盒定量。将蛋白样品用12%SDS 聚丙烯酰胺凝胶进行电泳,每个蛋白样品上样量为50 μg,蛋白进入分离胶后用120 V 恒压电泳,用湿转法进行转膜。封闭液(PBST+5 g/L脱脂奶粉)将膜置于室温封闭1 h,按工作浓度加入一抗,4 ℃封闭过夜。将膜用 TBST 漂洗 3 次后,用 HRP 偶联的二抗室温孵育1 h,TBST 漂洗3 次,而后加入化学发光试剂,用X 线曝光显影。用凝胶成像系统分析,以β-actin 做内参照,蛋白相对表达量=蛋白条带灰度值/β-actin条带灰度值。
1.8 统计学处理 用SPSS25.0 统计软件。计量资料用±s表示,多组比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 淫羊藿素对A549 细胞、RAW264.7 细胞活力的影响 各组A549 细胞、RAW264.7 细胞活力比较见表1、2。
表1 各组RAW264.7细胞活力比较(%,±s)

表1 各组RAW264.7细胞活力比较(%,±s)
注:与对照组比较,*P<0.05。
组别对照组0.1 μmol/L淫羊藿素组1 μmol/L淫羊藿素组10 μmol/L淫羊藿素组100 μmol/L淫羊藿素组细胞活力干预24 h 100.0±3.1 98.5±6.8 95.2±3.3 94.1±4.2 75.2±6.5*干预48 h 98.2±2.2 96.2±8.1 94.1±4.6 95.2±3.7 68.1±5.8*干预72 h 99.3±3.9 94.1±7.5 95.3±4.3 93.3±3.4 60.2±4.5*
表2 各组A549细胞活力比较(%,±s)
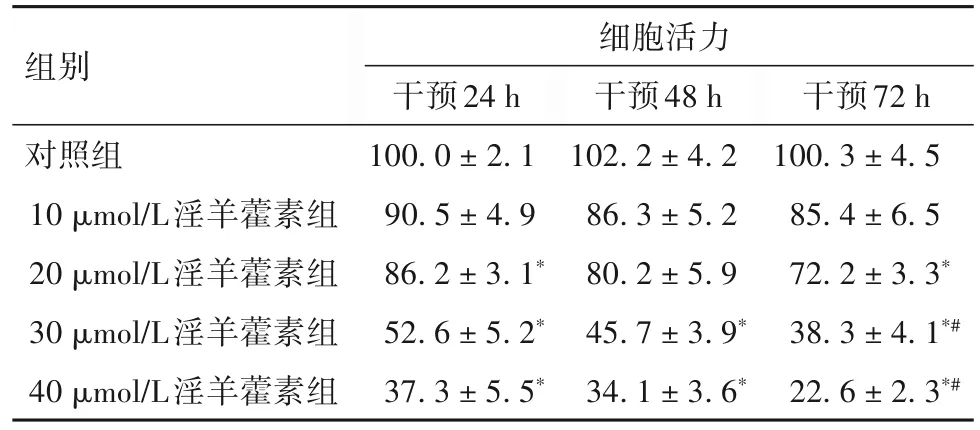
表2 各组A549细胞活力比较(%,±s)
注:与对照组比较,*P<0.05;与同组24、48 h比较,#P<0.05。
组别对照组10 μmol/L淫羊藿素组20 μmol/L淫羊藿素组30 μmol/L淫羊藿素组40 μmol/L淫羊藿素组细胞活力干预24 h 100.0±2.1 90.5±4.9 86.2±3.1*52.6±5.2*37.3±5.5*干预48 h 102.2±4.2 86.3±5.2 80.2±5.9 45.7±3.9*34.1±3.6*干预72 h 100.3±4.5 85.4±6.5 72.2±3.3*38.3±4.1*#22.6±2.3*#
2.2 淫羊藿素对A549 细胞诱导RAW264.7 向OC分化的影响 阳性对照组、对照组、5 μmol/L 淫羊藿素组、10 μmol/L 淫羊藿素组 OC 数量分别为(90 ±2)、(98 ± 3)、(34± 3)、(20± 2)个。阳性对照组与对照组OC数量比较差异无统计学意义(P>0.05);与对照组比较,5 μmol/L淫羊藿素组、10 μmol/L淫羊藿素组OC数量少(P均<0.05);与5 μmol/L淫羊藿素组比较,10 μmol/L淫羊藿素组OC数量少(P<0.05)。
2.3 淫羊藿素对OC凋亡的影响 对照组、5 μmol/L淫羊藿素组、10 μmol/L 淫羊藿素组OC 凋亡率分别为(4.8 ± 0.5)%、(7.8 ± 0.6)%、(9.7 ± 0.6)%。与对照组比较,5 μmol/L 淫羊藿素组、10 μmol/L 淫羊藿素组 OC 凋亡率高(P均<0.05);5 μmol/L 淫羊藿素组与10 μmol/L淫羊藿素组OC凋亡率比较差异无统计学意义(P>0.05)。
2.4 淫羊藿素对OC 中CTSK、AMPK、mTOR mRNA表达的影响 与对照组比较,5 μmol/L 淫羊藿素组、10 μmol/L 淫羊藿素组 OC 中 CTSK mRNA 相对表达量低、AMPK mRNA 相对表达量高、mTOR mRNA 相对表达量低(P均<0.05);与5 μmol/L 淫羊藿素组比较,10 μmol/L 淫羊藿素组 OC 中 CTSK mRNA 表达低、AMPK mRNA 相对表达量高、mTOR mRNA 相对表达量低(P均<0.05)。见表3。
表3 各组OC中CTSK、AMPK、mTOR mRNA相对表达量比较(±s)

表3 各组OC中CTSK、AMPK、mTOR mRNA相对表达量比较(±s)
注:与对照组比较,*P<0.05;与 5 μmol/L 淫羊藿素组比较,#P<0.05。
组别对照组5 μmol/L淫羊藿素组10 μmol/L淫羊藿素组CTSK mRNA 1.00±0.03 0.66±0.05*0.45±0.08*#AMPK mRNA 1.00±0.02 1.39±0.09*1.62±0.08*#mTOR mRNA 1.00±0.05 0.79±0.07*0.35±0.04*#
2.5 淫羊藿素对OC 中AMPK、p-AMPK、mTOR、pmTOR 蛋白表达比较 与对照组比较,5 μmol/L 淫羊藿素组、10 μmol/L 淫羊藿素组 OC 中 AMPK、p-AMPK蛋白相对表达量高,mTOR、p-mTOR蛋白相对表达量低(P均<0.05);与 5 μmol/L 淫羊藿素组比较,10 μmol/L 淫羊藿素组 OC AMPK、p-AMPK 蛋白相对表达量高,mTOR、p-mTOR 蛋白相对表达量低(P<0.05)。见表4。
表4 各组OC中AMPK、p-AMPK、mTOR、p-mTOR蛋白相对表达量比较(±s)
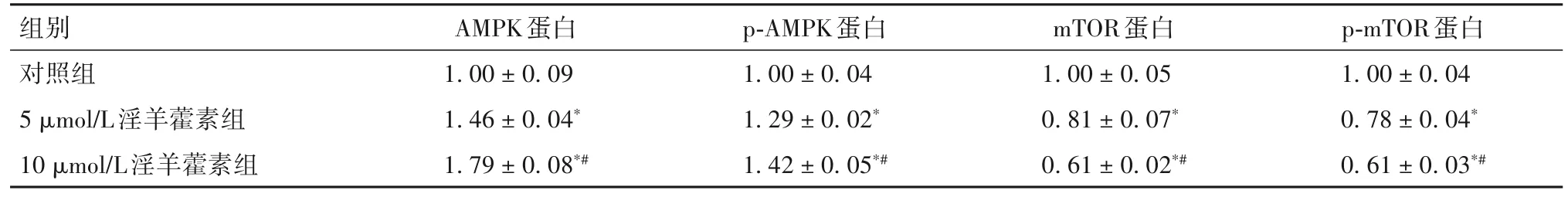
表4 各组OC中AMPK、p-AMPK、mTOR、p-mTOR蛋白相对表达量比较(±s)
注:与对照组比较,*P<0.05;与5 μmol/L淫羊藿素组比较,#P<0.05。
组别对照组5 μmol/L淫羊藿素组10 μmol/L淫羊藿素组AMPK蛋白1.00±0.09 1.46±0.04*1.79±0.08*#p-AMPK蛋白1.00±0.04 1.29±0.02*1.42±0.05*#mTOR蛋白1.00±0.05 0.81±0.07*0.61±0.02*#p-mTOR蛋白1.00±0.04 0.78±0.04*0.61±0.03*#
3 讨论
淫羊藿素是补肾壮骨中药淫羊藿的主要成分,是淫羊藿苷在动物体内代谢后脱去糖基的活性成分,是淫羊藿口服吸收后发挥药理活性的主要成分[6]。淫羊藿素分子式C21H20O6,相对分子质量为368.38。目前淫羊藿及其代谢产物在抗骨质疏松骨代谢方面已成为研究热点。研究发现,淫羊藿素可通过下调骨硬化蛋白表达来促进人骨髓间充质干细胞的成骨作用[7]。也有研究发现淫羊藿苷能通过上调OC 的雌激素受体α mRNA 表达进而下调RANK mRNA 表达来抑制RANKL诱导RAW264.7向OC分化和骨吸收活性[8];同时研究还发现,淫羊藿素可诱导骨髓间充质干细胞向成骨细胞分化[9-10]。基于此,本课题组通过建立肺癌细胞与OC前体细胞体外非接触培养模型,发现A549细胞可诱导OC前体细胞分化为OC的数量与RANKL诱导的数量相似,这说明A549细胞在体外可诱导OC分化。通过细胞活力检测发现10 μmol/L以下浓度的淫羊藿素对A549 细胞和RAW264.7 细胞无明显抑制作用,却可明显减少OC 的数量,TRAP阳性的仅20个,同时也使OC 标志物CTSK mRNA 表达降低,并且具有浓度依赖性。利用流式细胞术检测细胞凋亡情况,发现10 μmol/L的淫羊藿素可诱导OC 凋亡,但凋亡率仅9.7%,而5 μmol/L 的淫羊藿素组OC 凋亡率仅7.8%。因此,本课题组推测淫羊藿素减少肺癌A549细胞诱导RAW264.7向OC分化的数量,细胞凋亡不是占主要作用,可能主要是通过某些信号通路抑制OC的分化。
目前最新研究表明,AMPK 信号通路在骨代谢中同样起着非常重要的作用。AMPK 的活化可以在体外促进骨生成,并且AMPK α 或β 亚基的缺失可以降低大鼠骨量[11]。JANG 等[12]研究发现,AMPK 的活化可抑制成骨细胞分化,同时也有研究发现,AMPK 亦参与了OC 的成熟和分化。研究表明,在OC 活化和骨吸收溶解过程中AMPK 可能发挥了重要作用[13-14]。AMPK 是否参与肺癌细胞诱导 OC 分化,目前鲜有报道。因而本研究采用qPCR 及West⁃ern blotting 法检测发现,淫羊藿素可上调AMPK mRNA 和 AMPK 及 p-AMPK 蛋白的表达,并且高浓度淫羊藿素组较低浓度淫羊藿素组作用强。表明淫羊藿素可能通过激活AMPK 抑制肺癌细胞诱导RAW264.7向OC分化。
mTOR 是一种丝氨酸/苏氨酸蛋白激酶,其包括mTORC1、mTORC2。mTORC1 是 AMPK 下游重要的信号分子,对于蛋白质翻译、细胞生长增殖、凋亡和自噬等具有重要的调控作用[15-16]。本研究发现,淫羊藿素下调mTOR mRNA、蛋白及p-mTOR 蛋白的表达。结果表明mTOR 可能也参与了淫羊藿素抑制肺癌诱导RAW264.7向OC分化的过程。
综上所述,淫羊藿素可激活AMPK 和p-AMPK,并且下调mTOR 和p-mTOR 的表达,从而抑制RAW264.7 和A549 细胞共培养体系中OC 的分化。由此,推测淫羊藿素通过AMPK/mTOR 信号通路抑制肺癌细胞诱导RAW264.7 向OC 分化,这为肺癌骨转移的防治提供新的思路和靶点。
