革胡子鲶感染维氏气单胞菌后β-防御素基因的时空表达分析
2021-02-25冯苗苗王晓梅李转转顾晨刊陈成勋
冯苗苗,王晓梅,李转转,顾晨刊,陈成勋
(天津农学院水产学院,天津市水产生态及养殖重点实验室,天津 300384)
20 世纪60 年代,从老鼠和豚鼠的腹膜白细胞中分离得到具有抑菌活性的溶酶体阳离子蛋白[1]。1985年Lehrer 小组将从人类嗜中性白细胞中分离得到的具有广谱抗菌活性的小分子蛋白命名为“defensin(防御素)”[2],后来用防御素这一术语来描述在其他物种中发现的同源分子[3]。研究表明:防御素具有广谱的抗菌活性,广泛存在于动、植物体内[4]。脊椎动物的防御素主要分为α-防御素、β-防御素和θ-防御素3 大类[5],而鱼体内主要是β-防御素[6]。目前,已克隆了斑马鱼(Danio rerio)[7]、虹鳟(Oncorhynchus mykiss)[8]、青(Oryzias latipes)[9]等多种鱼类的β-防御素基因;研究发现鱼类的多种组织器官均有β-防御素基因的表达,但表达水平具有种属和组织器官差异[10,11];病原微生物也会影响β-防御素基因的表达谱[12]。
革胡子鲶(Clarias gariepinus)原产于非洲,由于生长快、适应能力强、可高密度养殖、抗病性强,已引种至东南亚、欧洲和南美洲的部分国家,并成为重要的淡水养殖鱼类[13,14],我国于1981 年引进[15]。对革胡子鲶已有的研究报道主要集中在养殖条件(如水的理化因子、养殖密度和饲料)对其生长性能、血液生理生化指标、组织抗氧化指标的影响[14,16-22]或是水化因子及病原菌引起该鱼的组织病理学变化[22,23],但对革胡子鲶高抗病性的分子机制研究报道较少。因此,本研究应用维氏气单胞菌(Aeromonas veronii)感染革胡子鲶幼鱼,应用实时荧光定量PCR(qPCR)技术分析该鱼3 种淋巴组织(脾脏、肾脏和头肾)和3 种粘膜相关的淋巴组织(皮肤、鳃和肠道)中β-防御素基因的表达谱,旨在为从分子水平探讨革胡子鲶对病原菌感染的免疫应答机制积累基础数据。
1 材料与方法
1.1 试验鱼及攻菌
试验用鱼和攻菌试验与Li 等[24]的研究方法相同。革胡子鲶取自天津市德仁农业发展有限公司,在实验室暂养10 d 后,挑选体质量(63.84±5.91)g,体长(18.51±1.34)cm 的个体用于攻菌试验。每尾鱼腹腔注射0.2 mL 浓度为4×108CFU/mL 的维氏气单胞菌,对照组注射同等剂量的生理盐水。
1.2 采样、RNA 提取及cDNA 第一条链的合成
注射后3 h、6 h、12 h、24 h、36 h、48 h、72 h 和96 h 时感染组和对照组各取鱼15 尾。试验鱼用200 mg/L 的MS-222 麻醉后,取脾脏、肾脏、头肾、肠道、皮肤和鳃。应用Trizol 试剂(生工生物工程(上海)股份有限公司)提取组织的总RNA,检测其完整性、纯度和浓度后,应用RevertAid cDNA 第一条链合成试剂盒(美国Thermo 公司)合成cDNA 的第一条链。
1.3 引物的设计与评估
基于本实验室革胡子鲶脾脏转录组分析数据中注释为β-防御素基因的CDS 区,利用NCBI 在线设计扩增β-防御素基因片段的引物,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehy-drogenase,GAPDH)为内参基因,其引物序列引自Li等[24]。引物由生工生物工程(上海)股份有限公司合成,用常规PCR 和qPCR 检测与评估后用于基因表达分析。引物序列见表1。
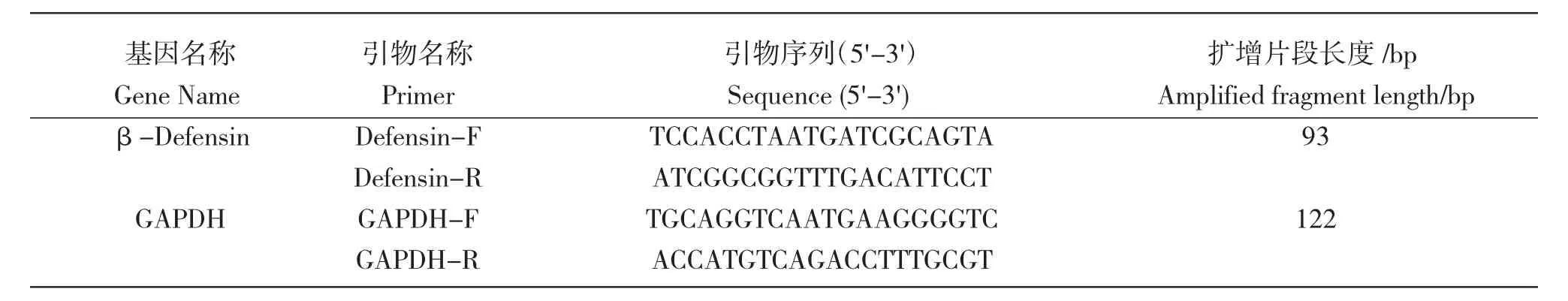
表1 实时荧光定量PCR 的引物信息Tab.1 Information on the primers for qPCR used in the experiment
应用2×rTaq PCR MasterMix 试剂盒(美国Quanta biotech 公司)进行常规PCR 扩增(25 μL),扩增体系包括:1×rTaq PCR 混合液,引物Defensin-F 和Defensin-R 的终浓度均为0.3 μmol/L,cDNA 1 μL;循环参数为:94℃预变性5 min,94℃变性1 min,56℃退火1 min,72℃延伸1 min,共35 个循环,72℃延伸补平5 min,每个反应设置3 个技术重复。
1.4 组织样本的基因表达及数据统计分析
qPCR 扩增体系与循环参数同1.3。以GAPDH基因作为内参基因,采用2ΔCT法分析革胡子鲶6 种组织β-防御素基因的表达水平,数据以“平均值±标准误”表示,应用SPSS17.0 软件进行单因素方差分析(One-Way ANOVA),采用Duncan 法多重比较数据间的差异显著性(P<0.05)。
2 结果与分析
2.1 引物评估结果
β-防御素基因片段常规PCR 扩增的琼脂糖凝胶电泳结果(图1)显示:扩增产物为一条泳带,片段大小约为100 bp,与理论值相符。

图1 β-防御素基因片段常规PCR 扩增的琼脂糖凝胶电泳结果Fig.1 The agarose gel electrophoresis of β-defensin gene fragments amplified by PCR
β-防御素基因片段qPCR 扩增的熔解曲线为单一尖锐峰(图2-A),引物的扩增效率E=97.6%,R2=0.997(图2-B)。这些结果说明:该对引物的特异性良好,扩增效率符合qPCR 的试验要求,可用于后续组织样本的β-防御素基因的表达水平分析。
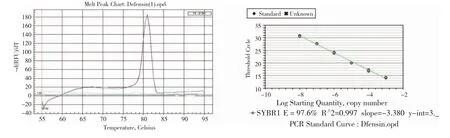
图2 β-防御素基因片段qPCR 扩增的熔解曲线峰值图(A)和标准曲线(B)Fig.2 Melt peak chart(A)and the standard curve(B)of qPCR amplification of β-defensin gene fragment
2.2 健康(对照组)革胡子鲶β-防御素基因的表达分析
由图3 可知:对照组革胡子鲶6 种组织中均有β-防御素基因的表达,脾脏的表达量显著高于其他5种组织(P<0.05),肠道的表达量显著高于皮肤和头肾的表达量(P<0.05),但与鳃和肾脏的表达量差异不显著(P>0.05)。
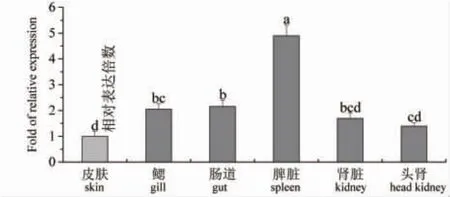
图3 对照组革胡子鲶6 种组织中β-防御素基因的相对表达量分析Fig.3 Relative expression levels of β-defensin gene in six tissues of African catfish C.gariepinus in the control group
2.3 革胡子鲶感染维氏气单胞菌后6 种组织β-防御素基因的时序表达分析
由图4 可知:革胡子鲶感染维氏气单胞菌3~96 h,6 种组织β-防御素基因的表达水平均上调,但时序表达谱有差异。试验鱼感染病原菌3 h,β-防御素基因在头肾、皮肤和鳃中的表达量显著高于对照组及感染后的其他时间点,分别为对照组的6.48、3.86 和1.80 倍(P<0.05)。头肾中该基因的表达量在12 h 回到对照组水平,而皮肤和鳃中该基因的表达量在6 h 回到对照组水平。脾脏中β-防御素基因的表达量在24 h 显著高于对照组及感染后的其他时间点(P<0.05),是对照组的2.76 倍。3 h 时肾脏和肠道中该基因的表达量最高,但与对照组差异不显著(P>0.05)。
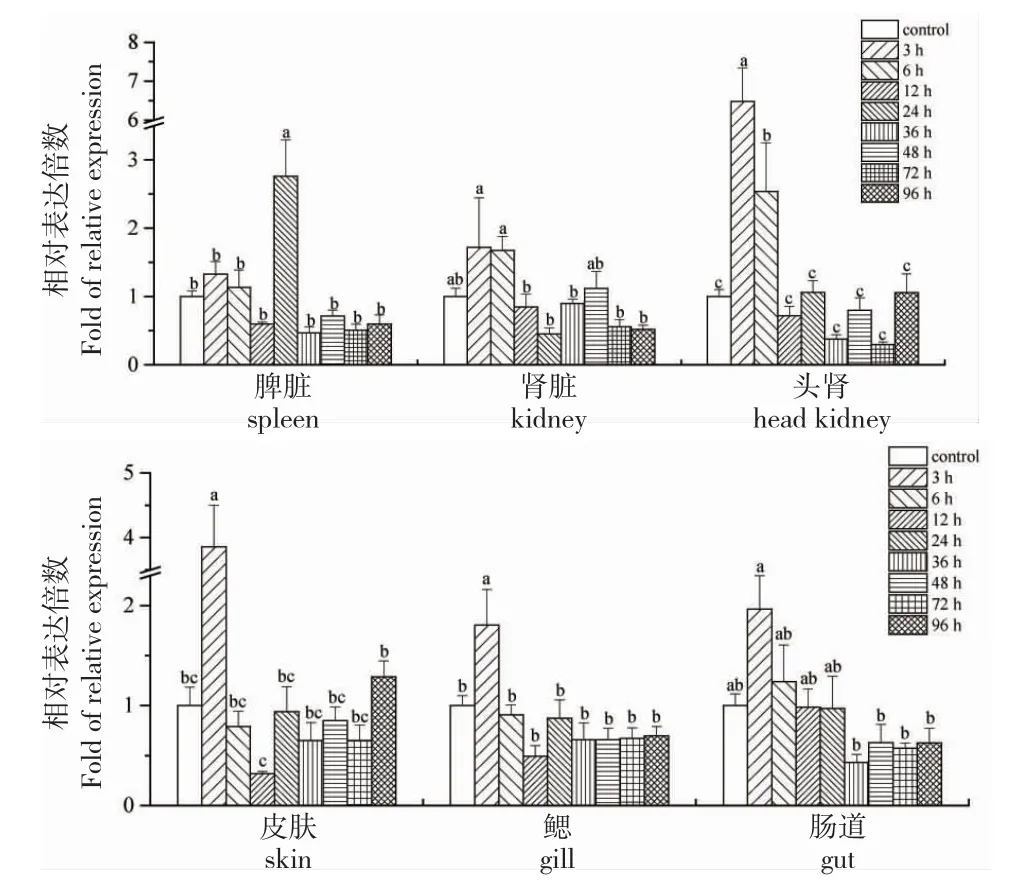
图4 感染维氏气单胞菌后革胡子鲶淋巴组织(A)和粘膜相关淋巴组织(B)β-防御素基因的表达模式Fig.4 Expression profiles of β-defensin gene in lymphoid tissue(A)and mucosa-associated lymphoid tissue(B)of African catfish C.gariepinus challenged with A.veronii
2.4 革胡子鲶感染维氏气单胞菌后6 种组织间β-防御素基因表达的差异分析
由图5 可知:在试验鱼感染病原菌后3 h,头肾中β-防御素基因的表达量最高,显著高于除脾脏外的其他组织,是对照(皮肤)组的2.34 倍(P<0.05);感染6 h,脾脏中该基因的表达最高且显著高于除头肾外的其他组织,是皮肤表达量的7.01 倍(P<0.05);12~96 h,该基因的表达量仍然在脾脏中最高,并且显著高于其他5 种组织,达到皮肤中表达量的2.28~14.41 倍(P<0.05)。
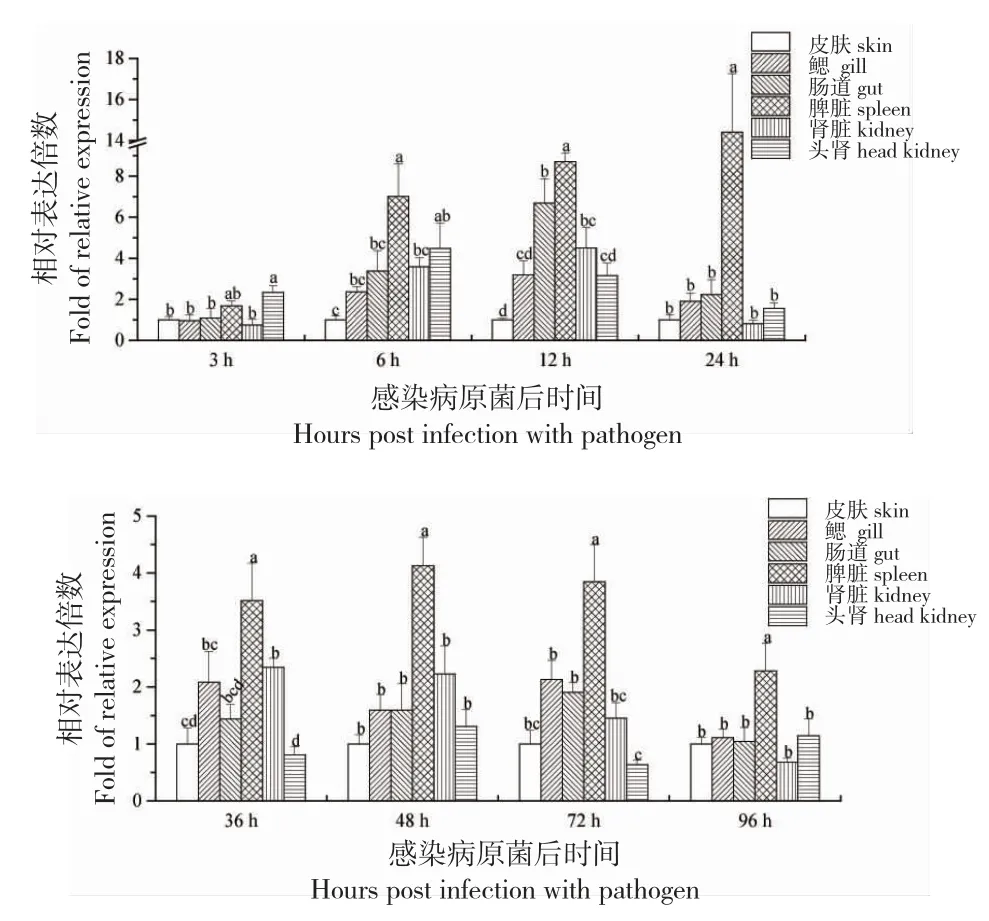
图5 感染维氏气单胞菌后各时间点革胡子鲶6 种组织β-防御素基因相对表达量Fig.5 Relative expression levels of β-defensin gene in six tissues of African catfish C.gariepinus challenged with A.veronii at eight time points
3 讨论
硬骨鱼类的免疫器官和组织主要包括淋巴组织(如胸腺、肾脏和脾脏)和粘膜相关的淋巴组织(如肠道、皮肤和鳃),它们在鱼类的免疫应答过程中发挥着重要的作用[25,26]。
本实验结果表明:健康鱼(对照组)革胡子鲶革胡子鲶6 种组织中均有β-防御素基因表达,但表达存在差异。其中脾脏β-防御素基因的表达量显著高于其他5 种组织;肠道该基因的表达量显著高于皮肤和头肾,但与鳃和肾脏的表达量差异不显著。已有研究结果显示,β-防御素基因1 和3 在健康斑马鱼的脾脏、肠道、皮肤、鳃和肌肉中均有较高表达;β-防御素基因2 仅在肠道呈弱表达[7];健康虹鳟β-防御素基因1 和2 在头肾、脾脏、皮肤、肠道和鳃中呈低水平表达,而β-防御素基因3 和4在上述组织中的表达水平较高[27];而健康卵形鲳鲹(Trachinotus ovatus)β-防御素基因在肠道表达量最高,在皮肤和脾脏表达量较高,在鳃、头肾和肾脏的表达水平中等,而心脏和肝脏表达水平较低[28]。本研究中,β-防御素基因在健康革胡子鲶体内的表达与上述研究结果相似,都显示β-防御素基因在健康鱼体的多种组织器官可表达,说明该基因在鱼体内呈组成型表达,但表达水平存在组织差异性。
革胡子鲶感染维氏气单胞菌后,β-防御素基因在6 种组织的时序表达分析发现:感染病原菌后3-96 h,β-防御素基因在头肾、皮肤和鳃中的表达水平在3 h 显著高于对照组和感染后的其他时间点;该基因在肾脏、肠道的表达量也是在3 h 达到峰值,但与对照组差异都不显著;而脾脏中该基因的表达水平在24 h 最高并显著高于对照组和感染后的其他时间点。Zhao 等[9]使用革兰氏阴性菌外膜的主要成分LPS(脂多糖,lipopolysaccharide,LPS)模拟细菌感染青鳉,发现感染6 h β-防御素基因在鱼眼组织中的表达水平在显著升高,12 h 达到峰值,为非感染组的12.9 倍。刘巧红等[28]研究人工感染创伤弧菌(Vibrio vulnificus)的卵形鲳鲹时发现:感染8 h 头肾中β-防御素基因表达量最高,72 h 时降低恢复至正常水平;脾脏在感染12 h 表达最高;肠道在12 h 表达量明显增加,并在24 h 达到峰值。嗜水气单胞菌(A.hydrophila)感染俄罗斯鲟(Acipenser gueldenstaedti)可强烈影响β-防御素基因的表达;感染6 h 后头肾的表达量显著增多;感染24 h 肠道和脾脏表达量最大且显著高于对照组;24~72 h 脾脏的表达一直保持较高水平[29]。本研究结果与他人的研究结果均说明,β-防御素基因可被病原菌诱导上调表达,随着感染时间的推移而逐渐恢复到正常水平,但该基因的时序表达谱存在种属差异和组织器官差异。
革胡子鲶感染维氏气单胞菌后相同时间点,β-防御素基因的表达水平具有组织差异性。感染病原菌3 h,该基因在头肾中的表达水平显著高于在皮肤、鳃、肠道和肾脏中的表达水平,但与在脾脏的表达水平差异不显著。6~96 h 该基因在脾脏的表达一直保持最高水平,6 h 显著高于除头肾外的其他4 种组织,12~96 h 显著高于其他组织。根据本试验结果推测:在感染病原菌的早期(3 h 和6 h),革胡子鲶6 种组织中头肾和脾脏在抵御病原菌入侵时起重要作用,而在感染中后期脾脏起主要作用。虹鳟感染鲁氏耶尔森氏菌(Yersinia ruckeri)后48 h,3 种粘膜组织(皮肤、鳃和肠道)中β-防御素基因的表达均有变化:β-防御素基因2 在肠道中的表达水平显著高于皮肤和鳃的表达水平,而β-防御素基因3 的表达水平为鳃高于皮肤和肠道[27]。链球菌(Streptococcusdysgalactiae)感染梭鱼(Lizahaematocheila)24 h 后,脾脏、肾脏、肠道和肝脏β-防御素基因的表达均上调并且显著高于对照组,此时脾脏中该基因的表达水平高于肾脏、肠道和肝脏该基因的表达水平[30]。这些结果说明:鱼类感染病原菌后的同一时间点,不同组织器官中β-防御素基因的表达水平存在差异。
总之,本研究结果说明:革胡子鲶6 种组织都参与病原菌感染的免疫应答反应,在感染早期(3 h),头肾、皮肤和鳃中的β-防御素基因对维氏气单胞菌的应答较快。在抵御病原菌侵染的过程中,笔者推测脾脏起更为重要的免疫防御作用。本研究结果为探讨革胡子鲶抗病的分子机制积累了基础数据,有助于鱼类养殖过程中饲料免疫添加剂的开发和疾病防治的研究。
