Cu2+、Zn2+、Fe3+离子对早期卤虫幼体(Artemia saline)急性毒性研究
2021-02-25蒋湘朱文燕许乐乐吕美霞魏亦彤王锂韫陈道海
蒋湘,朱文燕,许乐乐,吕美霞,魏亦彤,王锂韫,陈道海
(1.岭南师范学院生命科学与技术学院,广东 湛江 524048;2.广东省粤西海鲜资源可持续利用工程技术研究中心,广东 湛江 524048)
卤虫(Artemia salina)又称盐水丰年虫、丰年虾、盐虾或鳃足虫,为广温耐高盐甲壳动物。卤虫分布很广,世界各地沿海高盐水域、海岸盐田及内陆盐湖等均有分布,中国主要产地为长江以北沿海各地,天津长芦盐场是最著名的卤虫产地[2]。卤虫生长迅速,繁殖周期短,幼体和成体是海水、淡水养殖动物的优良鲜活饵料、天然诱食剂[3];卤虫能滤食盐田中的藻类和固体悬浮颗粒,改良水质,提高产盐质量[4]。卤虫的生活习性和生理结构常用于环境污染物评价和生态毒理学研究中,是标准的实验生物[5,6]。
近年来,卤虫作为一种水产高蛋白食物原料在沿海各地已经被广泛开展养殖。随着沿岸地域资源开发,滩涂面积缩减,加之抗生素等渔药滥用、水体富营养化、无序粗放的养殖模式等等严重影响到了卤虫养殖业发展。在污染较为严重的某些海域,一些重金属污染指数如Hg、Cd、As 等达到中等生态危害及以上级别[7],广泛开展了重金属离子对卤虫等水生动物毒性的相关研究。宫春光等[8]研究重金属Hg2+、Cu2+、Cd2+对渤海湾卤虫无节幼体的急性毒性。张明兴等[9]研究了重金属Cu2+、Cd2+和聚苯乙烯微球对卤虫的复合毒性效应。吴宗凡等[10]评价及预测了重金属Zn2+、Cd2+与有机磷农药二元混合物对卤虫的联合毒性。Nogueira 等[11]研究NiO、Fe2O3和TiO2三种金属废弃物对6 种水生动物毒性。Marilena 等[12]研究了重金属污染物对意大利本地与外地卤虫品种的毒性。以上研究多集中在北方、内陆等地域并通过人工调配海水开展卤虫毒理研究,而有关南方广东沿海海域利用天然卤水开展金属离子的卤虫毒理研究报道较少。地域及水化学成分差异等条件下卤虫对金属离子的耐受性尚不清楚。
本实验在前人研究基础上通过开展Fe3+、Cu2+、Zn2+离子对卤虫早期幼体毒性研究,以期为广东沿海卤虫养殖及海域污染监测提供可行的观测指标和参考数据。
1 材料与方法
1.1 实验地点与材料
2019 年7 月20 日实验在湛江岭南师范学院水生动物实训基地内开展。实验用卤虫休眠卵为湛江海神生物科技有限公司提供,卤虫卵化28~30 h,孵化水温27℃、光照2 000 lx、盐度30,溶解氧>7 mg/L,孵化密度0.5 g/L,全程持续增氧。孵化用卤水来自湛江坡头区南三岛南三盐场,卤水盐度58,释稀至30,实验用水经过滤、消毒、曝气、沉淀、增氧。孵化前淡水浸泡30 min 左右,上午8 点开始孵化,次日12 点于恒温光照培养箱中开始毒理实验。实验容器为直径11 cm、高3 cm 圆柱形食品级塑料容器,有效水体200 mL。所用实验试剂为分析纯CuSO4·5H2O、ZnSO4·7H2O、Fe2(SO4)3。实验溶液的配制:通过分析天平称取一定质量的CuSO4·5H2O、ZnSO4·7H2O、Fe2(SO4)3,用去离子纯净水配制质量浓度为1 g/L 的Cu2+、Zn2+和Fe3+母液,定容500 mL,根据实验浓度计算母液体积,用移液枪控制精度,减少实验误差。
1.2 实验设计
按水生动物毒理学试验方法开展预实验[13],按等比间距设置浓度区间找到3 种金属离子对卤虫的24 h 全死亡和48 h 全存活浓度,再根据浓度区间上下限按等对数间距设置浓度梯度开展正式实验(表1),Cu2+浓度区间为0.5~257.24 mg/L;Zn2+浓度区间为4.01~512.86 mg/L;Fe3+浓度区间为32.14~127.74 mg/L,1 个浓度梯度设置3 个平行组,1 种金属离子设置3 个对照组,每组放卤虫幼体30只,试验开始后不充气、不换水、不投喂,6 h、12 h、24 h、48 h 观察幼虫的存活状态,统计死亡幼体数量并用吸管出死亡幼体,计算所有试验组的平均死亡数量,毒性实验重复2~3 次,可根据实验结果按对数间距再添加适宜浓度梯度。死亡判断标准为:幼体沉于底部,碰触附肢10 s 不动。
1.3 数据分析
用SPSS21.0 软件处理数据,建立概率单位-质量浓度的直线回归方程,绘制出根据模型拟合的毒性预测回归曲线,估算Cu2+、Zn2+、Fe3+对卤虫幼体的24 h、48 h 半致死浓度(LC50)及95%置信区间,实验中对照组出现死亡的数据校正方法,根据公式:P=校正[13],其中P'为实验组死亡百分数,c 为对照组死亡百分数,P 为校正后的死亡百分数。安全浓度(Sc)公式:Sc=[14]。
2 结果与分析
2.1 重金属离子对卤虫毒性试验结果
3 种重金属离子对卤虫毒性试验结果如表1 所示。由表1 可知,随着离子浓度的增加卤虫死亡数量明显上升,Cu2+、Zn2+、Fe3+浓度为257.24 mg/L、512.86 mg/L、127.74 mg/L 时,卤虫48 h 死亡率均达到100%,配对样本双侧t 检验得到,同一浓度下的Cu2+、Zn2+的24 h 与48 h 平均死亡数量存显著差异(P<0.05);而同一浓度的Fe3+的24 h 与48 h 平均死亡数量没有显著差异(P>0.05)。由此推测,Fe3+对卤虫毒性效应时间比Cu2+、Zn2+要短。Cu2+、Zn2+对照组有死亡个体(≤10%),需对照死亡数量进行校正。
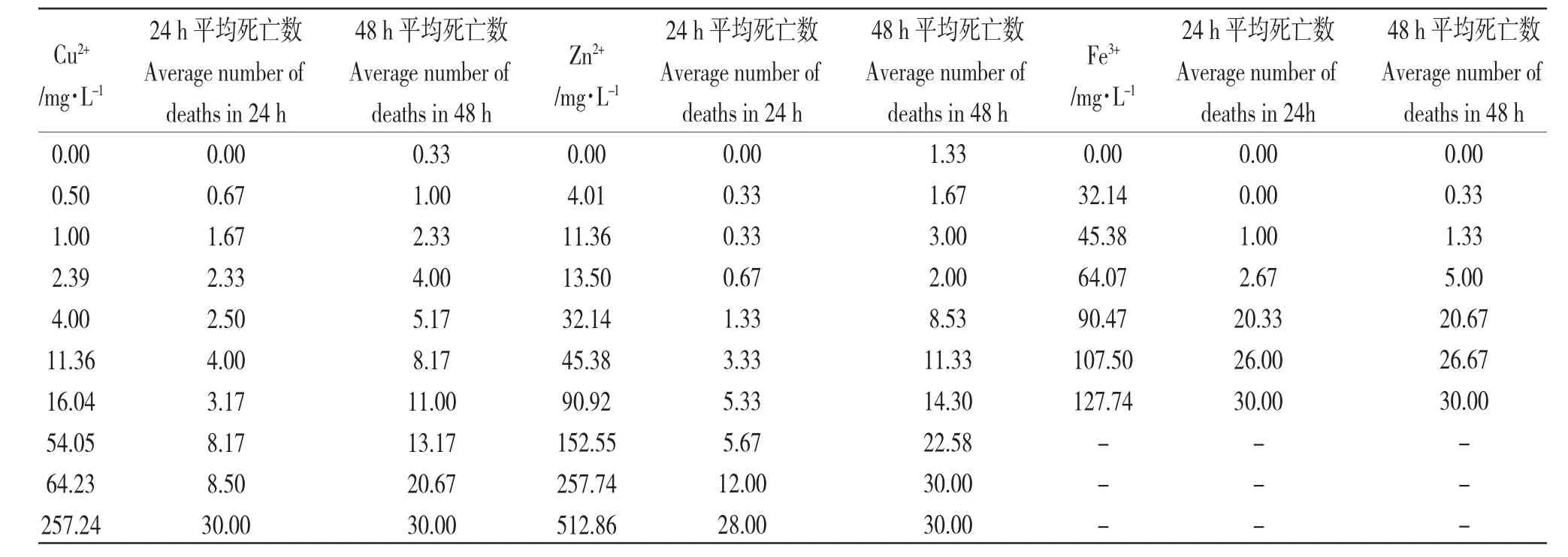
表1 重金属离子对卤虫毒性试验结果Tab.1 Test results of the toxicity of heavy metal ions to early larvae of brine shrimp Artemia saline
2.2 概率单位回归分析结果
Cu2+、Zn2+和Fe3+对卤虫急剧毒性影响概率单位法分析结果如表2、表3 和表4 所示。在PROBIT回归分析中,当协变量(浓度)与概率之间不存在线性关系时,需要选择对协变量(浓度)的转换方式(自然对数或常用对数变换),SPSS 默认无转换。模型通常用累积标准正态分布函数的反函数来转换响应比例。由表2 可知3 种离子24 h、48 h 的概率单位(PROBIT)转换值与浓度或浓度对数的回归直线及其参数估计值、估计标准误、显著性检验、95%置信区间等。所有参数估计均达到极显著性水平。
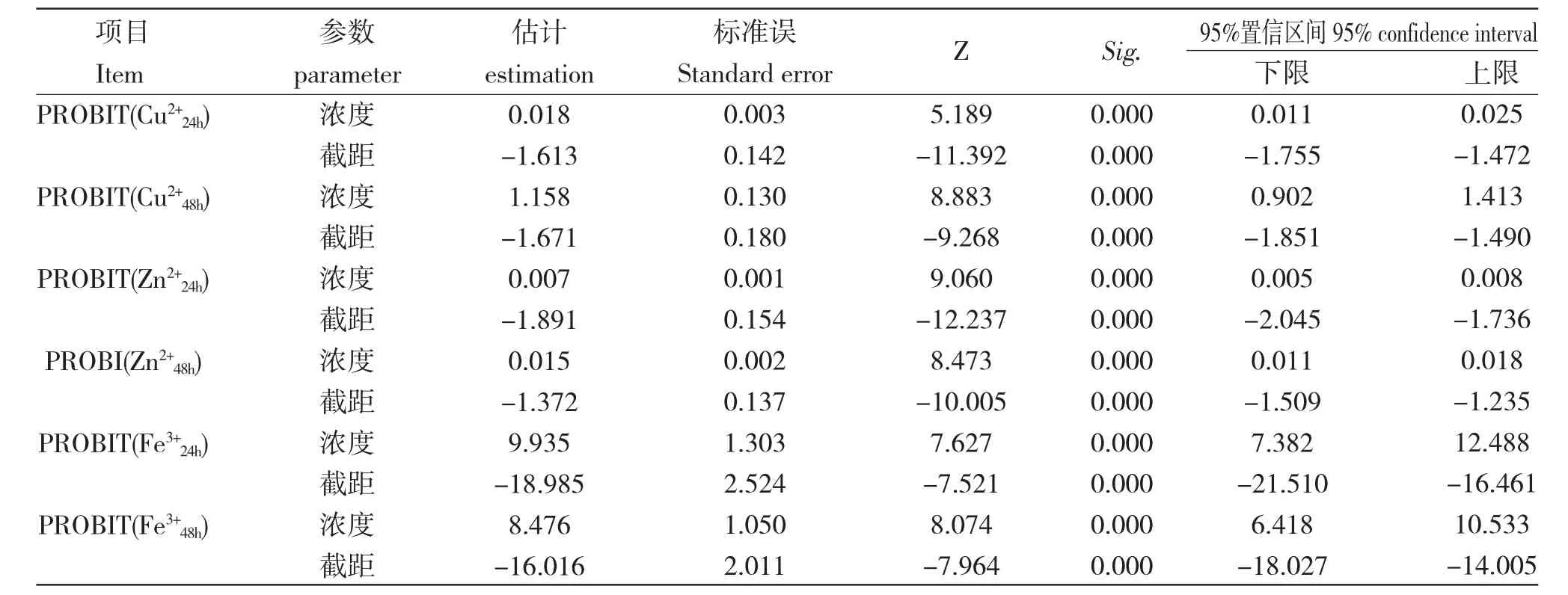
表2 概率单位回归参数及置信区间估计表Tab.2 The estimation table of probability unit regression parameters and confidence interval
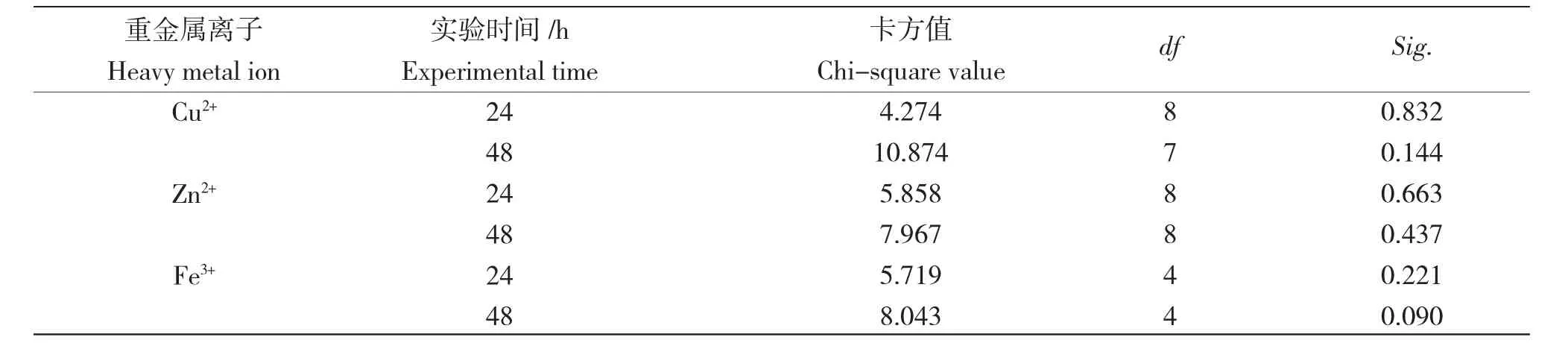
表3 概率回归拟合度卡方检验表Tab.3 Chi-square test table of probabilistic regression fit
回归方程:
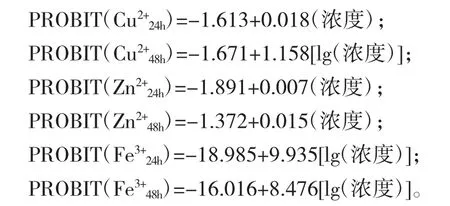
表3 中显示概率回归拟合度卡方检验结果。Pearson 拟合优度检验值均大于0.05 显著性水平,说明模型能较理想地拟合实验数据。由表4 可知3种重金属离子24 h 和48 h 的半致死浓度与安全浓度值,通过以上拟合的回归方程估算半致死浓度及浓度95%的置信区间,并求得3 种离子的安全浓度值。由表4 可知,Cu2+对卤虫幼体的24 h、48 h 半致死质量浓度为89.875 mg/L、27.726 mg/L;Zn2+对卤虫幼体的24 h、48 h 半致死质量浓度为283.445 mg/L、92.268 mg/L;Fe3+对卤虫幼体的24 h、48 h 半致死质量浓度为81.452 mg/L、77.567 mg/L;Cu2+、Zn2+、Fe3+安全浓度分别为0.792 mg/L、2.933 mg/L、21.103 mg/L。卤虫幼体对3 种重金属离子的敏感顺序依次为Cu2+>Zn2+>Fe3+。
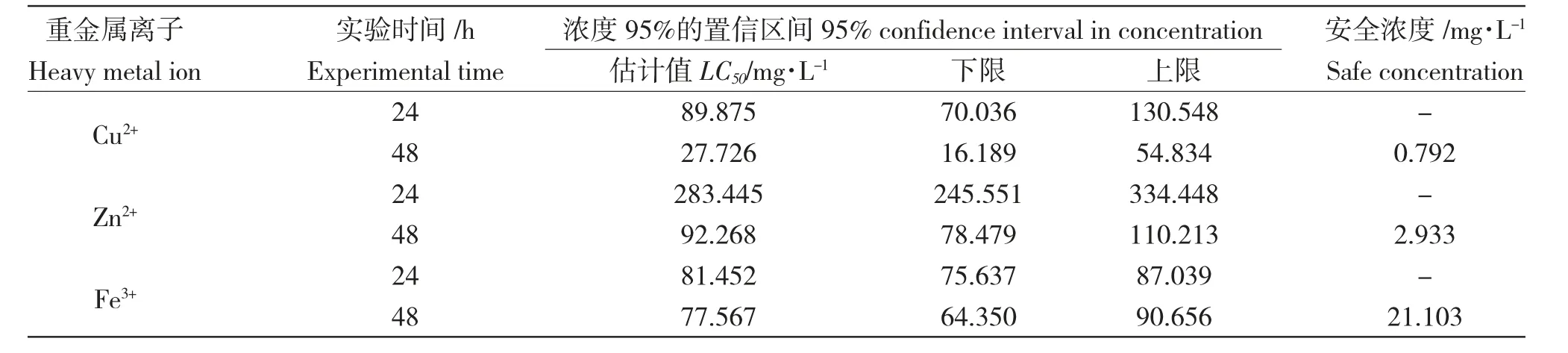
表4 半致死浓度与安全浓度Tab.4 LC50 and safe concentration of Cu2+,Zn2+,and Fe3+to early larvae of brine shrimp Artemia saline
2.3 拟合回归曲线图
图1~图6 表示3 种离子24 h、48 h 的概率单位(PROBIT)转换值与浓度或浓度对数的散点图,PROBIT 回归过程中参数估计采用极大似然估计法,实验卤虫样本通过随机方式抽取开展实验,样本与总体分布具有同一性。图中添加拟合回归曲线;对所有试验组数据的死亡率(二项分布数据)经PROBIT 转换得到对应累积标准正态分布函数的反函数值Φ-1(P),(死亡率0%、100%转换后的反函数值无穷小或无穷大,故不参与模型拟合),概率单位函数y=Φ-1(P)+5,因此可求得:当概率单位y=5 时,Φ-1(P)=0,x0=μ=LC50,即纵轴上刻度0 值所对应的横轴浓度即为所估算的半致死浓度值。如图1~图6 所示:Cu2+、Zn2+、Fe3+浓度或浓度对数对应的(PROBIT)转换值与所拟合曲线基本上一致,大部分散点落在拟合曲线上或靠近曲线。由图1~图6 可知:24 h Cu2+、24 h Zn2+、48 h Zn2+在回归分析过程中,协变量(浓度)不作对数变换;48 h Cu2+、24 h Fe3+、48 h Fe3+回归分析中,协变量(浓度)作常用对数变换均能较好地拟合试验数据,求得回归方程。
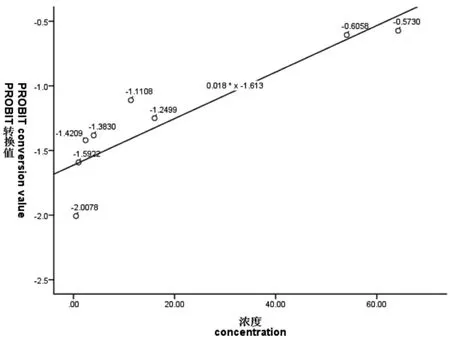
图1 24 h Cu2+浓度与概率单位线性回归散点图Fig.1 Scatter plot of linear regression between Cu2+ concentration and probability unit at 24 h

图2 48 h Cu2+浓度对数与概率单位线性回归散点图Fig.2 Scatter plot of linear regression between Cu2+ concentration and probability unit at 48 h
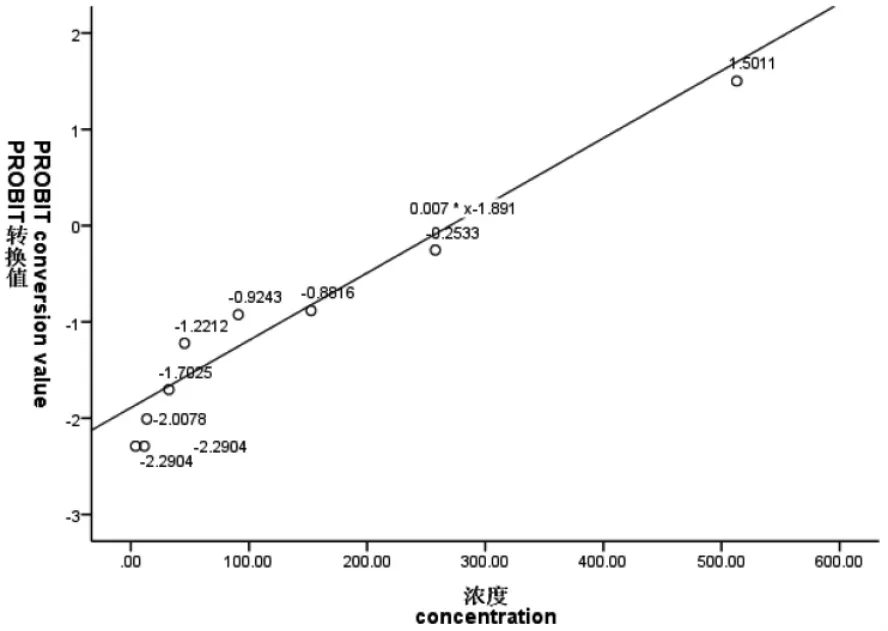
图3 24 h Zn2+浓度与概率单位线性回归散点图Fig.3 Scatter plot of linear regression between Zn2+ concentration and probability unit at 24 h
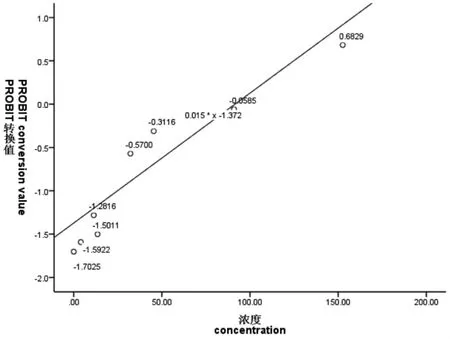
图4 48 h Zn2+浓度与概率单位线性回归散点图Fig.4 Scatter plot of linear regression between Zn2+ concentration and probability unit at 48 h
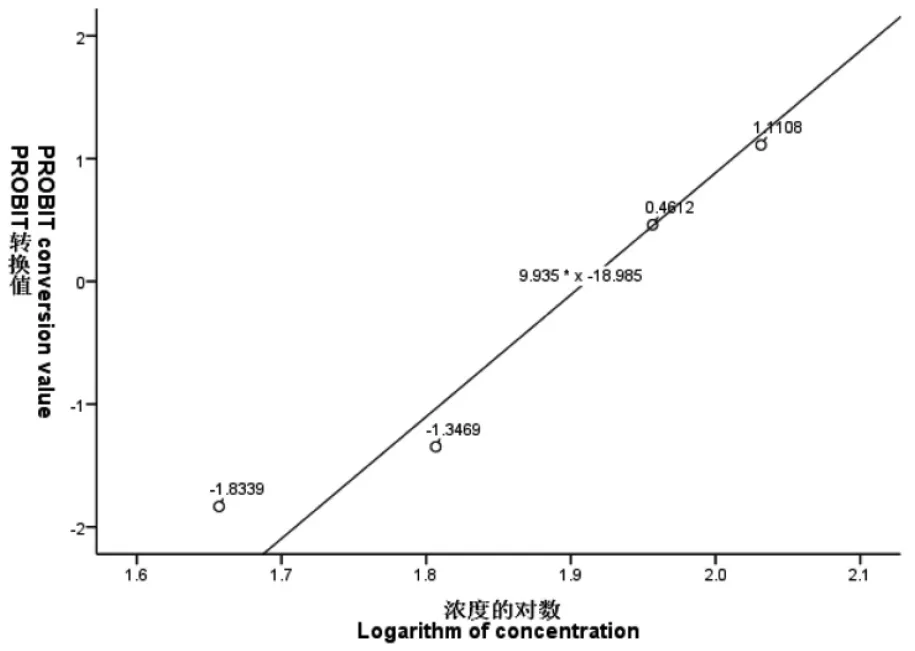
图5 24 h Fe3+浓度对数与概率单位线性回归散点图Fig.5 Scatter plot of linear regression between Fe3+ concentration and probability unit at 24 h
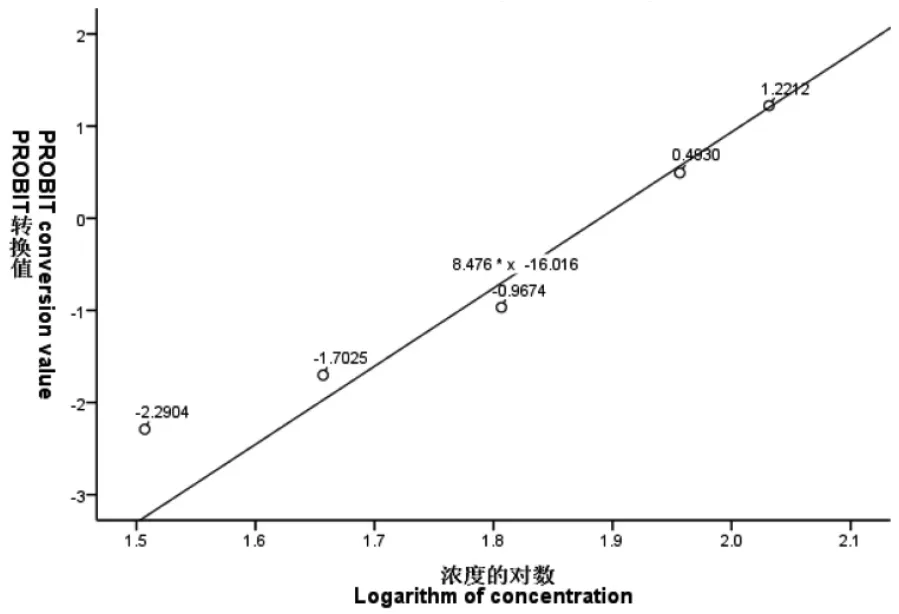
图6 48 h Fe3+浓度对数与概率单位线性回归散点图Fig.6 Scatter plot of linear regression between Fe3+ concentration and probability unit at 48 h
3 讨论
根据水生生物急剧毒性试验质量控制要求[13,15],对照组死亡率≤10%;试验组中有≤37%和≥67%组存在;试验需设置至少5 个及上的浓度梯度;用相同配制溶液、相同试剂、相同操作方法得到的二次重复试验结果之比小于2,本实验设计方案及实验结果均符合以上要求标准。半致死浓度的计算方法较多,国内普遍采用的方法有3 种[16]:(1)改良寇氏法,限制条件多,要求大致正态分布,浓度按等比级数设置,各组动物数相等;(2)概率单位法(Bliss法)要求少,适合科研,根据对数(剂量)与经验概率单位构成的散点绘制一条直线,由该直线可找到对数剂量相当的期望概率单位值。计算作业概率单位,对期望概率单位值进行校正,用作直线检验,如果各点不显著偏离直线,得到该直线回归方程,求得半致死浓度值。Bliss 法是目前可靠性、准确性最高的半致死浓度计算方法;(3)线性回归法(又称直线内插法),简单易行,节省动物,但是求得LC50置信区间范围大,不够精确。本实验通过概率单位法(Bliss 法)研究3 种重金属离子对卤虫幼体的毒性效应,拟合回归直线求得半致死浓度与安全浓度值,在数据分析方法上进一步提高实验结论的准确性与可信度。
3.1 Cu2+对早期卤虫幼体的急剧毒性效应
Cu2+是动物生命活动所需的一种微量元素,是多种酶的组成成分和酶活性中心,浓度过高会引起动物中毒。水中铜离子累积来自铜及其化合物排入[17]。水产养殖上Cu2+可用于防治原生动物引起的鱼病,控制有害藻生长。陈婕等[18]研究Cu2+对卤虫I期无节幼体的毒性,得到Cu2+24 h 半致死浓度为66.87 mg/L;宫春光等[8]用线性回归法研究重金属Hg2+、Cu2+、Cd2+对渤海湾卤虫无节幼体的急性毒性,发现Cu2+24 h、48 h 半致死质量浓度为197.17 mg/L、7.50 mg/L,安全浓度为0.08 mg/L;张永刚等[19]利用寇氏法计算Cu2+、Mn2+、Zn2+3 种重金属离子对卤虫的半致死浓度与安全浓度,得到48 h Cu2+半致死浓度为4 mg/L,安全浓度为0.4 mg/L。张青田等[20]通过死亡率-浓度对数线性回归法研究五种重金属离子对俄罗斯卤虫的联合毒性,建立卤虫死亡率-Cu2+等联合毒性的回归方程。李娜等[21]采用连续充气和动态活水法研究渤海主要重金属污染物对卤虫无节幼体的毒性,利用最小二乘法建立重金属浓度(常用对数)与死亡率的概率单位之间的回归方程,求得48 h Cu2+半致死浓度为4.06 mg/L,安全浓度为0.4 mg/L。本研究通过概率单位法得到Cu2+对卤虫幼体的24 h、48 h 半致死质量浓度为89.875 mg/L、27.726 mg/L,安全浓度为0.792 mg/L,与以上多位学者结果有所差异,与陈婕等[18]、张永刚等[19]、李娜等[21]结果相近,高于宫春光[8]等研究结果。引起实验结果差异的原因有多方面,如统计分析方法差异,不同统计分析方法会引起结果差异,尤其在安全浓度的计算上;卤虫的品种,虫卵产地差异。周银环等[22]认为,不同产地卤虫遗传差异对重金属耐受性不同;卤虫的孵化条件,如充气、光照、盐度、pH等差异、实验卤虫活动状态,有无挑选活力较好的卤虫等;卤虫的生长阶段。已有研究[18,19]表明,不同生长阶段卤虫对重金属离子耐受性有明显差异。但是,本文认为,卤虫品种及卤虫孵化、毒性实验的环境因子包括水化学成分差异是引起结论差异的主要原因。由此可以推测,同一品种卤虫卵在不同地理条件或水化学条件下的半致浓度与安全浓度会有差异;不同品种卤虫在相同的地理条件或水化学条件下的半致死浓度与安全浓度也不同,相关学者研究结果可作参考。以上研究结果可为广东南方沿海的卤虫养殖及海洋水质评价提供参考数据。
3.2 Zn2+对早期卤虫幼体的急剧毒性效应
Zn2+是水生动物所必需的一种微量元素,是很多金属酶的重要组成部分,并可作为一种辅酶参与动物新陈代谢,但是,高浓度的Zn2+会在动物组织细胞中蓄积,抑制多种重要酶的活性导致中毒死亡[23,24]。朱丽岩等[25]研究表明,海洋生物对Zn2+富集能力很强,海水中Zn2+过高会对生物产生毒害。关于Zn2+对卤虫的毒性效应研究不多。许永香等[26]研究了镉、锌离子对两种水生物的联合毒性,得到Zn2+对中期卤虫的24 h 半致死浓度为85.3 mg/L。张永刚等[19]利用寇氏法计算Zn2+的48 h 半致死浓度为115.95 mg/L,安全浓度为11.6 mg/L,毒性大小顺序为Cu2+>Zn2+。修瑞琴等[27]研究得到Zn2+的24 h、48 h 半致死浓度为164.3mg/L、19.1 mg/L;24 h、48 h Cu2+半致死浓度为4.7 mg/L、1.36 mg/L,离子毒性大小顺序为Cu2+>Zn2+。以上Zn2+研究结果与本实验结果有所差异。本实验得到Zn2+对卤虫幼体的24 h、48 h 半致死质量浓度为283.445 mg/L、92.268 mg/L,安全浓度2.933 mg/L,低于张永刚等[19]的安全浓度,高于许永香等[26]、修瑞琴等[27]结果,推测主要原因来自卤虫产地、水化学成分以及统计分析方法等;而对于离子毒性顺序(Cu2+>Zn2+)的结论,本研究结果与以上研究结果一致。因此在海水养殖业中应当及时检测和控制海水中Cu2+、Zn2+的含量。
3.3 Fe3+对早期卤虫幼体的急剧毒性效应
Fe3+是水生动物所必需的一种微量矿物元素,是细胞色素氧化酶、过氧化物酶等多种代谢相关酶的关键部分;Fe3+参与血红蛋白与肌红蛋白的组成,运载体内氧和二氧化碳,构成动物生理防御机能。但水中Fe3+含量过高会引起水生动物中毒甚至死亡。Fe3+对早期卤虫幼体的急剧毒性研究尚未见报道。Lavens 等[28]研究表明,低溶解氧与铁盐能够引起卤虫体内血红蛋白含量的升高,提高卤虫产生休眠卵的比例。Versichele 等[29]指出:铁盐可诱导卤虫产卵,浓度高时诱导的时间缩短,卵虫比也高。柳光宇等[30]研究Fe3+对卤虫生存与繁殖的影响,发现Fe3+对卤虫的生殖比、平均生殖量和生殖次数影响不显著,但对二次产卵率影响显著,讨论中指出高浓度的Fe3+对卤虫有毒害作用,45 mg/L 的Fe3+实验组卤虫的存活率明显减少。陈立婧等[31]通过设置0 mg/L、2.5 mg/L、5 mg/L、10 mg/L、20 mg/L 的5 个铁盐浓度研究铁盐对卤虫存活率的影响,结果表明不同浓度间卤虫存活率无显著差异。本研究得到Fe3+对卤虫幼体的24 h、48 h 半致死质量浓度为81.452 mg/L、77.567 mg/L,安全浓度为21.103 mg/L。从本研究结果中可推断,柳光宇等[30]认为Fe3+浓度45 mg/L时卤虫的存活率明显减少,高于本研究的安全浓度21.103 mg/L,存活率会明显减少。陈立婧等[31]表明,5 种浓度铁盐的卤虫存活率无显著差异,其设置最高浓度为20 mg/L,低于本研究的安全浓度,因此不会对卤虫的存活率产生影响。SPSS 配对样本T 检验表明:卤虫24 h、48 h 死亡数量差异不显著,说明Fe3+对卤虫的毒性效应时间短,死亡时间集中在前24 h,而Cu2+和Zn2+对卤虫的24 h、48 h 平均死亡数量达到显著或极显著程度,推测这种现象与不同重金属离子对卤虫的毒性机制或卤虫对不同重金属离子的耐受性等密切相关,该机制有待于进一步深入研究。
