鹿茸皮肤完全再生机理的研究进展
2021-02-25孙红梅赵海平李春义丛培强
孙红梅,赵海平,李春义,丛培强
(1.中国农业科学院特产研究所,吉林 长春130112;2.长春科技学院,吉林 长春130600;3.山东省威海市文登区畜牧兽医技术服务中心,山东 威海264400)
皮肤是哺乳动物最大的器官,具有保护、感觉和控温等诸多功能。自然情况下成年哺乳动物皮肤损伤的最终结果是伤疤。众所周知,伤疤会给人类生理和心理上带来巨大的影响,据统计,全球每年用于伤口护理上的花费可达150多亿美元,因此皮肤损伤的无伤疤愈合一直是人类梦寐以求的。然而,幸运的是,自然界中存在着能够进行无伤疤愈合的特例——鹿茸,这样就为我们了解自然界如何解决无伤疤愈合的问题提供了优秀的模型。鹿茸是鹿科动物的头部附属物,是目前所知的唯一一个能够完全再生的复杂哺乳动物器官。鹿茸的再生始于角柄残桩远端皮肤的快速无伤疤愈合(7d完成直径10 cm伤口的愈合,且不留伤疤)。在生长期,鹿茸以每天1~2 cm的速度延伸,它的皮肤(茸皮)也以同样的速度进行生长。因此,对鹿茸皮肤再生机制的了解,将为实现哺乳动物伤口的无伤疤愈合提供理论指导。本文将对鹿茸皮肤的结构特点、发生与再生过程及其调控机制进行系统的综述,旨在为阐明鹿茸皮肤再生的机制及其诱导分子的调控作用,为临床上治疗无伤疤伤口愈合和慢性伤口愈合提供新的候选药物奠定理论基础。
鹿茸的皮肤是鹿茸外表覆盖的带有柔软绒毛的皮,因此也叫茸皮。茸皮是头部皮肤(头皮)的延伸,在茸角生长结束、骨化后自行脱落,每年随新茸的生成而再生。
1 茸皮的结构
茸皮由表皮和真皮两部分构成。鹿茸的表皮比一般表皮厚得多,真皮含有丰富的血管、神经纤维以及毛囊和皮脂腺,多数没有汗腺[1-2]。
在鹿茸的顶部,真皮与软骨膜相连,在茸的四周,真皮下面有一个密集平行的胶原组织束构成的管状层。胶原组织由结缔组织与茸骨分开,这种结缔组织相当于正常骨骼的骨膜。茸皮没有皮下疏松结缔组织层,茸皮中含有精确定向的胶原纤维束,这种胶原纤维束沿鹿茸的长轴排列成行,在鹿的顶端构成一个帽状结构,覆盖在鹿茸顶部,呈辐射状,被矩形胶原纤维紧紧围绕。除鹿茸顶部外,茸干骨膜与茸皮之间很少有辐射胶原纤维,因此,这些地方的茸皮很容易被剥离。
茸皮上生长的茸毛起源于鹿茸生长点的顶端。有些鹿种(如梅花鹿)的茸毛是稀疏的,而另一些鹿种(如马鹿、驯鹿)的茸毛则是稠密的。鹿茸生长点顶部的茸皮能不断分化出新的毛囊,这是绝大多数哺乳动物的皮肤所不具有的。从纵切面可以观察到生长点的毛囊发生和形成的过程,每个毛囊在分化的过程中都伴有皮脂腺的生成,皮脂腺分泌油脂使茸皮的表面具有光泽。发育成熟的茸毛几乎是垂直地生长于茸皮的表面,但其没有竖毛肌,这与身体其他部位的毛不同。
系统比较茸皮与头皮的区别发现:茸皮虽然来源于角柄皮肤(头皮的延伸,为典型的头皮[3]),但与角柄皮肤却有着明显不同的特征[1-4],从形态学方面来看,茸皮上附着的毛短、细且稀疏,与皮肤表面呈直角长出,颜色更浅。从组织学水平来看,茸皮的表皮较角柄皮肤的表皮更厚,茸皮的表皮厚度达0.149 mm,角柄皮肤的表皮厚度仅为0.01~0.03 mm(图1 A、B)[2]。茸皮具有独特的成熟的毛囊,与角柄皮肤的毛囊相比,毛囊发育阶段不同。茸皮有较大的皮脂腺,缺乏竖毛肌和汗腺,而且茸皮的血管管壁较厚,管腔较小。角柄皮肤血管管壁较薄,管腔较大(图1 C、D)。但茸皮与角柄皮肤的神经纤维在组织学上没有差别(图1 E、F)。

图1茸皮和角柄皮肤组织学比较[5]Fig.1 Histological comparison of velvet skin and pedicle skin(scalp skin)
2 茸皮的发生
茸皮来源于角柄皮肤。鹿不是出生就带有角柄的,是发育到青春期,体重到一个阈值(对赤鹿来说是5~7个月,56 kg)时从鹿的额外嵴发育而来的[5]。起初,角柄上覆盖着典型的头皮,当其长到特定高度时(赤鹿,50~60 mm),初角茸开始自发地从角柄的顶端形成,覆盖其上的皮肤也随之发生(图2)。角柄和初角茸的发生一生只有1次。

图2茸皮的发生过程[24]Fig.2 Process of generation of velvet skin
鹿茸内部组织结构——骨、软骨的发生经历了4个阶段,即膜内成骨阶段(IMO)、成骨模式转化阶段(OPC)、角柄软骨内成骨阶段(PECO)及鹿茸软骨内成骨阶段(AECO)[4,6],与此同时,其外部结构——皮肤也经历了相应的变化。皮肤的改变标志着鹿茸的发生。
膜内成骨阶段:额外嵴皮肤由表皮、真皮和疏松结缔组织组成,表皮较薄,呈波状(图3 A、B)。真皮包含毛囊及其附属结构,如竖毛肌、大量的汗腺和单叶的皮脂腺(图3 E)。疏松结缔组织(SLCT)很厚,很疏松,其中分布着血管层(图3 I)。表皮中未发现BrdU标记细胞,在真皮和毛囊中只有少数的BrdU标记细胞。
成骨模式转变阶段:早期,SLCT明显变薄、变密,与其下面骨膜的界限不易分清,OPC后期,SLCT更薄、更密,已经与骨膜的纤维层有融合(图3 J),与IMO阶段相比,表皮变厚,有较多的汗腺,较大的皮脂腺,含有竖毛肌,但皮脂腺为单叶,表皮为波状,但波的振幅和频率都变小(图3 F)。BrdU标记细胞在真皮中比IMO阶段更多(图3 M)。
角柄软骨内成骨阶段:在早期,皮肤的主要特点是形成新的毛囊,新形成的毛囊位于角柄顶端。与OPC阶段相比,表皮更厚,不再呈波状,皮脂腺更大,多为双叶。汗腺无明显变化。在中期,顶部皮肤毛囊类型发生了改变,大的皮脂腺双叶或多叶,无汗腺和竖毛肌(图3 G)。表皮更厚、更平(图3 C)。BrdU标记细胞主要分布在真皮中的皮脂腺、毛囊等处(图3 N)。
鹿茸软骨内成骨阶段:与PECO后期阶段基本相同。表皮厚度无明显变化,SLTC呈很窄的一条带(只有2~3层细胞)(图3 L)。电镜观察发现基膜不完整,呈碎片状(图3 P)。
综上,总结茸皮的发生过程,可以将其分成3个组织学上可以鉴别的阶段(图4):1)额外嵴顶部疏松结缔组织层压缩阶段(角柄高度15 mm);2)矫正表皮波状结构阶段(角柄高度25 mm);3)覆盖的皮肤及相关附属物的生成阶段(角柄高度30 mm左右)。茸皮类型的改变发生在角柄软骨内骨化阶段的后期,主要表现在毛囊类型的改变上。角柄皮肤是典型的初级毛囊,茸皮为次级毛囊[7]。从这3个阶段的组织学过程来看,驱动茸皮形成和扩张的因素可能是由皮下间质组织扩张引起的机械压力。当角柄开始生长时,第一个信号为疏松结缔组织压缩,接着为波状表皮变平,直到表皮被完全拉伸,才形成新的皮肤和附属物。
3 茸皮的再生
每年春季,由于体内激素水平的降低,鹿的老角脱落,形成角柄残桩,脱落处的角柄残桩远端由一层发亮的皮肤环所包裹(此时已具有茸皮的特性)。随着鹿茸或角柄内部组织再生的推进,皮肤环进一步向心迁移,直至覆盖伤口,形成茸芽,完成愈合,茸芽不断向上推进,形成鹿茸的主干和眉枝,皮肤也随之向上生长。
鹿茸的再生始于角柄残桩皮肤的再生性伤口愈合。老角脱落后,角柄残桩表面出血,中间的骨质部分内陷,形成碗状结构,血液留在碗内,逐渐干枯,形成结痂,外周由逐渐向里生长的皮肤环所包围。新形成的无毛的表皮及其真皮组织向内迁移,迁移表皮的表层细胞在愈合中移入位于结痂之上的干死组织和位于结痂之下的存活组织之间,中层细胞则移入皮层和角柄前端的骨质之间,形成舌头样的结构,大多数舌头样的结构都有特定的角度,像钉子一样将愈合表皮的前端固定到下面与它相连的组织上。因此,表皮不仅封住角柄皮肤的真皮,而且表皮前缘牢牢地与角柄骨膜和膜下骨相连。随着伤口愈合的推进,皮肤环进一步向心迁移,结痂逐渐变小,最后外周愈合的皮肤在顶端相遇,结痂被向心形成的主干和眉枝所取代,最终脱落[8](图5)。随着皮下组织的迅速膨胀,产生压力,皮肤必须快速生长[9]。
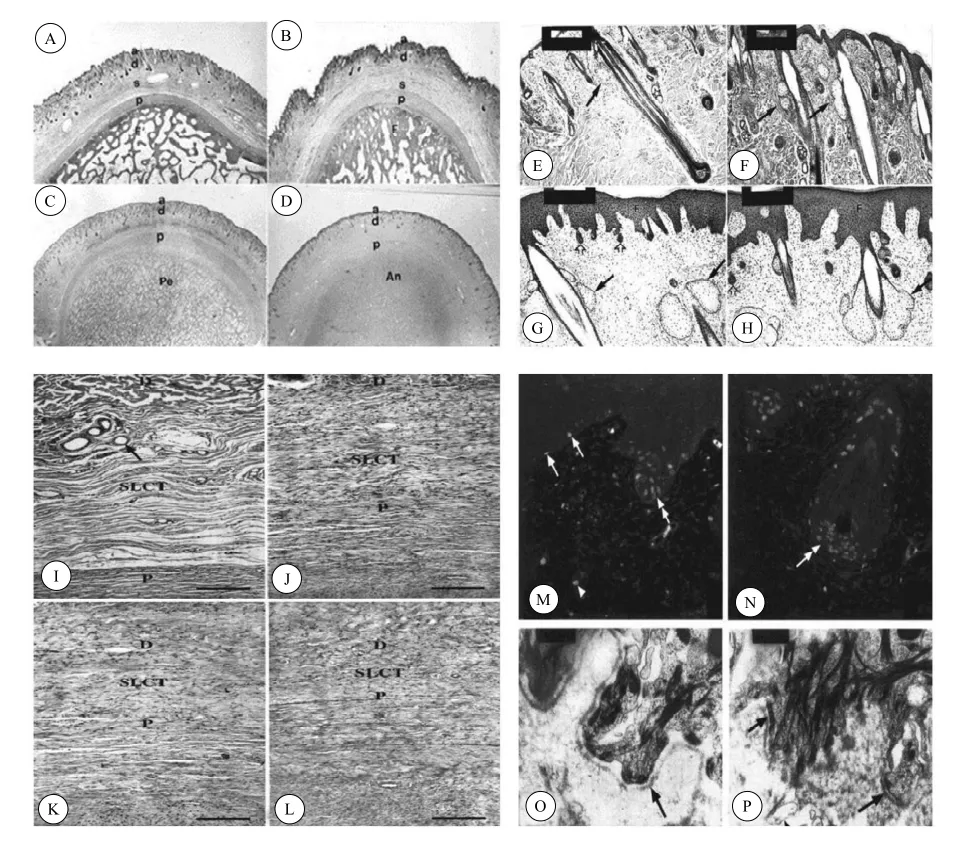
图3鹿茸发生过程中茸皮的形态学与组织学[24,25,26]Fig.3 Histogenesis of velvet skin in antler generation

图4茸皮的再生过程[24]Fig.4 Process of regeneration of velvet skin
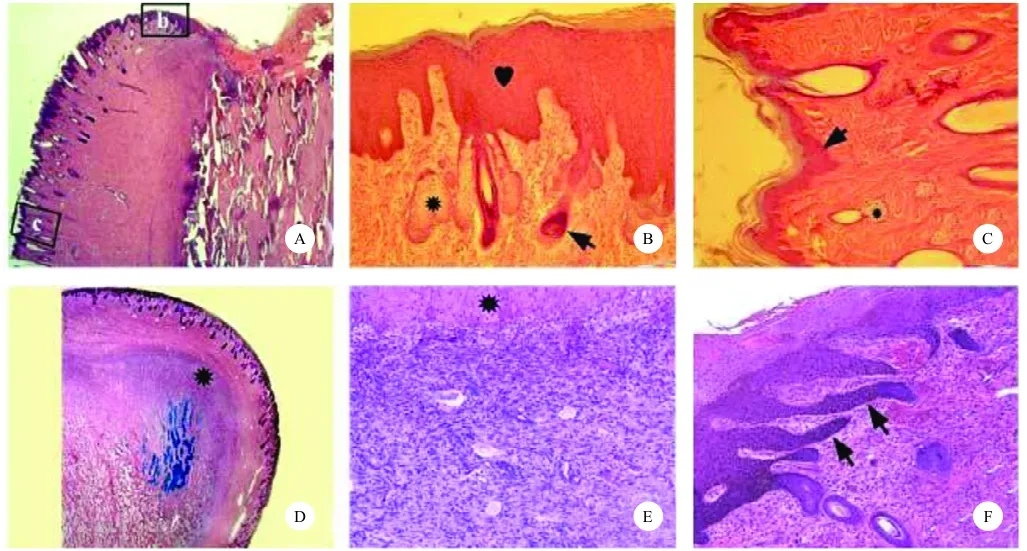
图5茸皮再生过程的组织学观察[24]Fig.5 Histogenesis of velvet skin in antler skin regeneration
4 茸皮再生机制
茸皮的主要特征是具有能够与内部组织同步再生和快速延伸的能力。然而是什么驱动并维持这种能力的呢?目前有两种假说,一种是机械张力刺激鹿茸皮肤再生假说,另一种是化学诱导假说。
4.1 机械刺激在茸皮中的作用
在鹿茸发生阶段,组织学观察发现,当角柄开始生长时,第一个信号为疏松结缔组织压缩,接着为波状表皮变平,直到表皮被完全拉伸,才形成新的皮肤和附属物,因此,驱动角柄皮肤形成和扩张的因素可能是由皮下间质组织扩张引起的机械压力[4]。在实验条件下,使用皮肤膨胀器牵拉皮肤,已经形成了新的皮肤[10-12]。Austad和Rose[10]认为皮肤的扩张是通过提高其表面积来适应其皮下组织体积膨胀的一种生理过程。Francis和Marks[13]发现,皮肤的拉伸能刺激表皮细胞的增殖,使之释放压力,驱动鹿角柄皮肤或茸皮快速生长的动力可能是来源于皮下间质组织膨胀所产生的机械力,因为快速形成的鹿茸组织,可以看做特殊类型的组织扩张器。而且,Li等[14]检测了鹿茸内部组织成分生长过程中对鹿茸皮肤产生的机械压力,结果表明,生长鹿茸尖部可以直接穿透能够承受1 040 g/cm2压力的铁氟龙膜(图6),所以鹿茸生长产生的压力一定大于1 040 g/cm2,所以可以得出角柄骨膜(Pedicle periosteum,PP)来源的鹿茸内部结构的膨胀产生的机械压力是足够驱动鹿茸皮肤生长的。
图6机械张力与皮肤形成[1]Fig.6 Mechanical tension and skin formation
鹿茸再生过程中,鹿角脱落前,远端角柄皮肤与角柄骨膜是紧密融合的,已获得一些茸皮特征;但在近端,仍为典型的头皮,当硬角脱落后,封住脱落面的皮肤为典型的茸皮。如果说角柄皮肤和初角茸的茸皮在发生过程中的快速生长是由生茸区骨膜的膨胀形成的机械张力所引起的,那么,在鹿茸再生开始阶段,驱动鹿茸皮肤延伸的是什么因素呢?
表面上看,鹿茸再生早期,鹿茸皮肤所包裹的膨大的间质层没有建立,不会产生机械张力[15,16]。然而,对其组织学观察发现,即使是在鹿茸再生的早期,茸皮的生长也是由机械张力所引起的。因为:1)鹿茸主干和眉枝的生长中心定位在角柄残桩的前、后角,而不在角柄残桩的中心地带。在向心迁移的皮肤封闭中心地带时,再生的皮肤在几天前就已经覆盖在生长中心的前、后角。2)在老角脱落后,远端角柄皮肤与真皮下的角柄骨膜紧密融合,并且表皮不仅封住角柄皮肤的真皮,而且表皮前缘牢牢地与角柄骨膜和膜下骨相连,末端的角柄骨膜增厚,产生压力,因此,皮肤为解除压力,必须生长。3)在鹿茸再生早期阶段,愈合的表皮下面形成呈特定角度的舌头样结构,像钉子一样牢固地将迁移的表皮的边缘锚定到其下的结缔组织,角柄骨膜来源组织在前后角的快速膨胀,逐渐向上推并且形成初期的眉枝和主干。在这段时期,新形成的茸皮覆盖前后角的面积实质上是变大的。有趣的是,在这样的由下面组织膨胀引起的机械压力下,愈合皮肤的前缘仍然结合到其下的结缔组织,而且保持向心延伸,因此,角柄皮肤和鹿茸茸皮在鹿茸发生和再生过程中可能均由快速膨胀的间质组织的机械压力所驱动。这一结论揭示了鹿茸是怎样完成与鹿茸的内部结构同步进行快速延伸的。
4.2 化学诱导在茸皮再生中的作用
皮肤在初角茸发生阶段向茸皮的转变是发生在出生后的成熟皮肤的转变,因此,被认为是一个独特的动物学现象[3]。最近几年,在揭示这一转变的机制方面取得了较大的进展。生茸区骨膜(AP)移植实验[4,17,18]已经清楚地确立了生茸组织在这个过程中的角色。皮肤转变之前去除AP,阻止了鹿茸的形成和在原来位置的皮肤的转变,然而,皮下的AP在身体的其他部位如前额、前腿、后腿等诱导了异位鹿茸的发育和皮肤的转变。说明机械压力与膨胀的AP组织在皮肤转变过程中均扮演着不可或缺的角色,只有机械压力是不可能完成的,因为机械压力只能驱动皮肤的延伸,而不能改变皮肤的类型,所以,AP获得组织的分子诱导也是不可缺少的。
后来,化学诱导假说得到了Li等[4]所做的电镜研究结果的支持,结果表明,在皮肤转变阶段的早期,发生了角柄/鹿茸皮肤基膜完整性的破坏,而此前,尖部皮肤的基膜是完整的,已知在表皮和真皮之间完整的基膜能够有效阻止皮肤的相互作用,因此抑制鹿茸的再生。Neufeld[19]报道,基底膜(基膜的上层)从动物肢体截肢断面开始消失,直到再生芽基形成后期才重建完整的连续性,因此延迟基底膜闭合的能力是区别再生与非再生肢体的一个特征。在鹿头皮转变成茸皮时期的这一发现,至少部分解释了为什么鹿茸再生过程中没有基膜的物理性破坏,再生仍能进行。
为了进一步检测茸皮转变的化学诱导假说,并观察这种诱导的本质,Li等[20]进行了膜插入试验。在研究中,分别将非通透性膜和孔径0.45m的通透性膜插入到前额的AP和覆盖着的皮肤之间,2年后发现,非通透性膜插入组皮肤仍然保持着原来的头皮特征,而通透性膜插入组皮肤已经明显转变成了茸皮,这一发现清楚地表明皮肤的转变依赖于AP的诱导,并且这种诱导是通过扩散分子而实现的,因为通透性膜虽然延迟了,但并未阻止皮肤的转变,因此,解释了转变的机制:鹿茸发生或再生开始之前,较厚的疏松结缔组织插入在两种相互作用的组织生茸区骨膜(AP)/角柄骨膜(PP)与皮肤之间,一旦这两种相互作用的组织变得紧密接触,比如SLCT层被压缩成狭窄的一条时,发生中的AP细胞和再生中的PP细胞释放诱导扩散分子,穿过很窄的SLCT和真皮层,以长距离旁分泌的方式作用到与表皮相接处的真皮细胞,被激活的真皮细胞通过旁分泌和近分泌机制对表皮细胞发挥作用,转变成茸皮(图7)。最后分离和鉴别这些推断的诱导分子可能对发明一种更好的促进伤口愈合或完整组织再生的治疗方法具有重要意义。

图7角柄皮肤向茸皮转变的诱导过程示意图[24]Fig.7 Schematic drawing of the induction of transformation from pedicle skin into velvet skin
目前,普遍被人们接受的观点是茸皮的再生是机械张力与化学诱导共同作用的结果。只有机械张力,能引起角柄皮肤的生长,但不能诱导皮肤类型的转变。如果只有化学诱导,而没有机械张力的作用,同样也不能完成鹿茸皮肤的转变,因为当Li等[21,22]将生茸组织放到弥散腔中进行皮下移植时,由于生茸组织向外生长受到限制,不能对皮肤产生机械压力,移植后2个月,没有引起皮肤类型的转变,因此鹿茸皮肤的转变可能是通过机械刺激和化学诱导两方面的作用来完成的,机械刺激驱动皮肤的形成,而化学诱导决定皮肤类型的转变,启动皮肤的再生。
5 前景展望
尽管成年哺乳动物伤口不能实现再生性愈合,但胎儿皮肤受损后是可以实现再生性愈合的[27,28]。研究发现胎儿皮肤具有再生性愈合的能力主要是由于胎儿的伤口愈合与成年的有很多不同[29,30]:1)无急性炎症期,伤口处只检测到巨噬细胞,而无白细胞和淋巴细胞出现,促炎性因子种类和水平都很低,而抗炎性因子却很高;2)伤口处成纤维细胞的分裂和迁移速度显著高于成年的成纤维细胞;3)由成纤维细胞分化为成肌纤维细胞的比例显著低于成年伤口愈合的情况,因此不出现伤口收缩的现象;4)成纤维细胞分泌更多的III型胶原(Col III),更少的Col I,使两者的比率保持在3∶1,而不是1∶3(成年伤口);5)成纤维细胞分泌更多的TGF-3,更少的TGF-1,使TGF-3/TGF-1显著高于成年。研究表明,间充质干细胞可以将成年皮肤成纤维细胞诱导成胎儿样成纤维细胞,Huang等[31]将BMMSC(源于骨髓)与成年皮肤成纤维细胞放到一起离体共培养,可以通过旁分泌途径有效诱导成纤维细胞变成具有胎儿成纤维细胞特性的细胞,转变成的胎儿成纤维细胞可以有效降低炎症反应、提高分裂和迁移速度以及ColIII和TGF-3的分泌量。同样,荣小丽等[32]也证明鹿茸干细胞(鹿茸再生的基础,茸皮再生化学诱导来源)注射或条件培养液的涂抹,均能促进大鼠皮肤损伤的再生性愈合,因此,鹿茸再生时角柄末端伤口直径可达60~70 mm,最大可达100 mm,在5 d左右的时间完全愈合,茸皮实现再生性愈合可能也是通过在鹿茸再生过程中,鹿茸干细胞分泌的化学诱导分子将其周围的成纤维细胞诱导成了胎儿样的成纤维细胞来实现的。因此,分离、鉴别这些诱导因子,将为皮肤的无伤疤愈合提供新的有效途径;弄清鹿茸皮肤再生的机制及其诱导分子的调控作用,可为临床上治疗无伤疤伤口愈合和慢性伤口愈合提供新的候选药物,为人类健康做出重大贡献。
