长链非编码RNA HOXA簇反义RNA2在重度子痫前期患者胎盘组织中的表达及其作用
2021-02-25钟黎黎杨春芬郭江虹阳双健
盛 莹,钟黎黎,杨春芬,郭江虹,阳双健
0 引 言
子痫前期是妊娠期特有疾病,其在初产孕妇中发病率为5%~8%,是造成孕产妇和围产儿死亡的主要原因[1]。妊娠早期胎盘滋养细胞浸润不足导致的子宫螺旋动脉重塑障碍被认为是导致子痫前期发生的关键因素[2]。滋养细胞的浸润行为与肿瘤细胞类似,均与细胞的上皮-间质转化(epithelial-mesenchymal transition,EMT)过程相关。长链非编码RNA(long noncoding RNA,LncRNA)是指一类长度超过200 nt的非编码RNA,可在表观遗传、转录及转录后等水平调控基因表达,并参与多种生理病理过程,例如成骨分化[3]、肿瘤侵袭转移[4]等。作为一种具有致癌作用的LncRNA,HOXA簇反义RNA2(HOXA cluster antisense RNA2,HOXA-AS2)在多种恶性肿瘤组织中高表达,并且是肿瘤细胞增殖、侵袭、转移以及EMT的重要调控因子[5-6]。此外,HOXA-AS2在HOXA簇中位于HOXA3和HOXA4之间,已有HOXA簇其他成员参与子痫前期病理机制的调控[7-8],然而HOXA-AS2在子痫前期患者胎盘组织中的表达水平及其对子痫前期病理机制的影响,目前还尚不清楚。因此,本研究旨在分析重度子痫前期(severe preeclampsia,SPE)患者胎盘组织中HOXA-AS2表达水平及其对胎盘滋养细胞EMT的影响,明确HOXA-AS2在子痫前期发病机制中的作用,以期为子痫前期的临床早期诊断和治疗提供理论依据。
1 资料与方法
1.1 研究对象选取2017年2月至2019年4月在南华大学附属第一医院妇产科42例住院行剖宫产分娩的SPE患者,SPE诊断标准依据《妇产科学》第8版[9]。根据发病孕龄不同,将孕龄≤34孕周的SPE孕妇纳入早发型SPE组(n=19),将孕龄>34孕周的SPE孕妇纳入晚发型SPE组(n=23)。同时,选择同期行剖宫产分娩的30例正常妊娠晚期孕妇作为对照,其中14例因宫颈机能不全、胎膜早破、前置胎盘等病因而终止妊娠者作为早发型对照组,16例因胎儿窘迫、胎位异常、脐带绕颈等而终止妊娠者作为晚发型对照组。纳入标准:①行剖宫产分娩者;②单胎妊娠且属于初产者。排除标准:①生殖器官畸形者;②合并其他妊娠相关并发症者,如妊娠期糖尿病、原发性高血压、慢性肾炎等;③先天性遗传性疾病者。本研究经过医院伦理委员会批准(批号:2017B061),患者均签署知情同意书。
1.2标本收集及HOXA-AS2检测取剖宫产分娩后的无菌胎盘组织,在胎盘母体面距脐带附着处2~3 cm范围内取材,避开出血灶、钙化灶等,采用无菌等渗盐水清洗干净,分割成约1 cm×1 cm×1 cm大小的组织块,液氮中保存。采用qRT-PCR法检测各组胎盘组织中HOXA-AS2表达水平。
1.3细胞培养及转染复苏人胎盘滋养细胞系HTR-8/SVneo(美国ATCC公司)于含有5% 胎牛血清(FBS,美国HyClone公司)的RPMI-1640培养基(美国Gibco公司)中,并置于37 ℃、5% CO2的培养箱中培养、传代。取对数生长期HTR-8/SVneo细胞,以1×105个/孔的细胞接种量接种于6孔板中培养,设置空白对照组(不做任何处理)、空载质粒组(转染空载质粒)和过表达组(转染pcDNA3.1-HOXA-AS2质粒)。当细胞达到70%~80%融合度时,按照LipofectamineTM2000 Transfection Reagent(美国ThermoFisher公司)说明书,分别取终浓度为15 μg/mL的过表达质粒pcDNA3.1-HOXA-AS2或其空载质粒按照体积比50∶1与Lipofectamine 2000混合均匀并室温孵育20 min,再向每孔中加入100 μL混合物,混匀后置于培养箱中培养,6 h后更换新鲜培养液继续培养,培养48 h后采用qRT-PCR法检测过表达效果。
1.4qRT-PCR检测细胞中HOXA-AS2表达水平取胎盘组织或转染后细胞,采用Trizol法提取总RNA,采用分光光度计测定总RNA浓度。按照lnRcute lncRNA荧光定量检测试剂盒(北京天根公司)说明书操作,取2 μg RNA逆转录成cDNA,以cDNA为模板进行qRT-PCR扩增。引物序列为HOXA-AS2,Forward:5'-CCC GTAGGAAGAACCGATGA-3',Reverse:5'-TTTAGGCCTTCGCAGACAGC-3'; GAPD,Forward:5'-GGACCTGACCTGCCGTCTAG-3',Reverse:5'-GTAGCCCAG GATGCCCTTGA-3'。PCR扩增条件:95 ℃预变性3 min,95 ℃变性5 s,60℃退火15 s,60 ℃延伸15 s,共40个循环。以GAPDH为内参,采用2-△△Ct法计算HOXA-AS2相对表达量。
1.5CCK-8检测细胞增殖活性取对数生长期HTR-8/SVneo细胞,按照每孔3×103个细胞接种于96孔板中培养,每组设置5个复孔,经转染后分别培养12 h、24 h、48 h、72 h和96 h,培养时间结束后每孔加入15 μL CCK-8(上海碧云天公司),37℃继续培养4 h,采用酶标仪检测各组在450 nm波长下吸光度值(A值)。
1.6Transwell检测细胞侵袭和迁移能力侵袭实验需要提前将50 μL Matrigel基质胶(美国Corning公司)平铺于Transwell小室(滤膜孔径:8.0 μm,美国Corning公司)上室,侵袭实验不需要铺Matrigel基质胶。HTR-8/SVneo细胞经分组转染48 h后,0.1%胰蛋白酶消化后重悬并计数,调整细胞浓度为4×105个/mL,取200 μL细胞悬液接种于上室,每组设置3个复孔,下室添加800 μL含有15%FBS的RPMI -1640培养基,置于37 ℃继续培养48 h,加入1 mL多聚甲醛固定30 min,再采用0.1%结晶紫(美国Sigma公司)室温染色30 min,倒置显微镜下观察,每个小室随机取5个视野观察并计数,取平均值表示侵袭或迁移细胞数目。
1.7Western blot检测相关蛋白表达HTR-8/SVneo细胞经分组转染48 h后,收集各组细胞并提取总蛋白,采用BCA法测定蛋白浓度。取30 μg蛋白经高温变性后上样,经10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,采用湿转法将蛋白转移至PVDF膜上,5%脱脂牛奶室温封闭1 h,分别加入一抗即小鼠抗上皮钙黏蛋白(E-cadherin)单克隆抗体(1∶1000,美国Abcam公司)、小鼠抗N-cadherin单克隆抗体(1∶1000,美国CST公司)、小鼠抗波形蛋白(Vimentin)单克隆抗体(1∶1000,美国Abcam公司)、兔抗糖原合成酶激酶3β(GSK3β)单克隆抗体(1∶1000,美国CST公司)、兔抗p-GSK3β (Ser9) 单克隆抗体(1∶500,美国CST公司)、兔抗β-catenin单克隆抗体(1∶1000,美国CST公司)、山羊抗蜗牛家族转录抑制因子1(Snail1)多克隆抗体(1∶1000,美国Abcam公司)和兔抗GAPDH单克隆抗体(1∶1000,美国CST公司),4℃孵育过夜,洗膜后加入相应二抗,室温孵育1 h,滴加显影液显影。采用Image-Pro Plus6.0软件进行灰度分析,以目的蛋白条带灰度值与内参GAPDH条带灰度值的比值表达其相对表达量。
2 结 果
2.1 一般临床资料比较早发型SPE组和晚发型SPE组收缩压和舒张压均显著高于早发型对照组和晚发型对照组,差异有统计学意义(P<0.001)。见表1。

表 1 入组患者的一般资料比较
2.2胎盘组织中HOXA-AS2的表达情况早发型对照组胎盘组织中HOXA-AS2表达水平最高,而早发型SPE组最低(P<0.05)。与早发型对照组比较,早发型SPE组、晚发型对照组及晚发型SPE组胎盘组织中HOXA-AS2表达水平明显降低(P<0.01);与早发型SPE组比较,晚发型SPE组、晚发型对照组胎盘组织中HOXA-AS2表达水平明显升高(P<0.01)。见图1。
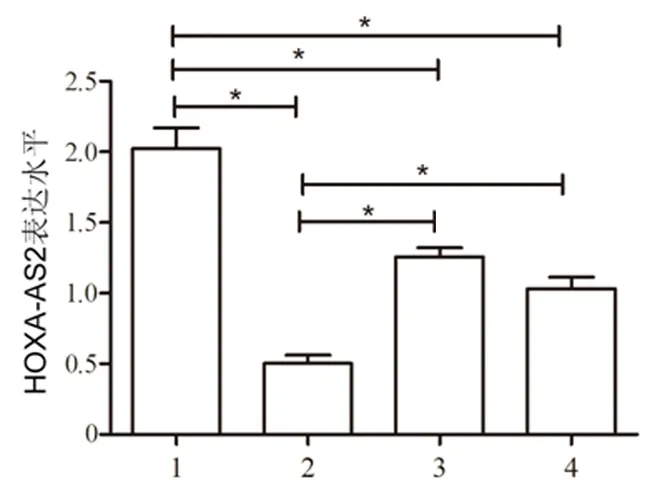
1:早发型对照组;2:早发型SPE组;3:晚发型对照组;4:晚发型SPE组
2.3过表达HOXA-AS2对HTR-8/SVneo细胞增殖活性的影响过表达组细胞中HOXA-AS2表达水平(41.28±4.01)显著高于空白对照组(1.00±0.03)和空载质粒组(1.04±0.04),差异有统计学意义(P<0.01)。细胞转染48 h后,过表达组细胞增殖活性显著高于空白对照组和空载质粒组,差异有统计学意义(P<0.05)。见图2。
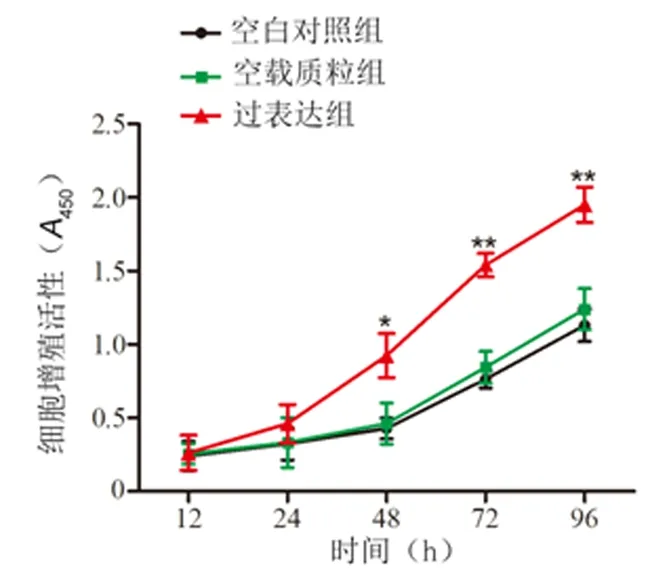
与空白对照组及空载质粒组比较,*P<0.01, **P<0.001
2.4过表达HOXA-AS2对HTR-8/SVneo细胞侵袭和迁移的影响与空白对照组和空载质粒组比较,过表达组细胞侵袭和迁移能力显著增强(P<0.01)。见图3,表2。
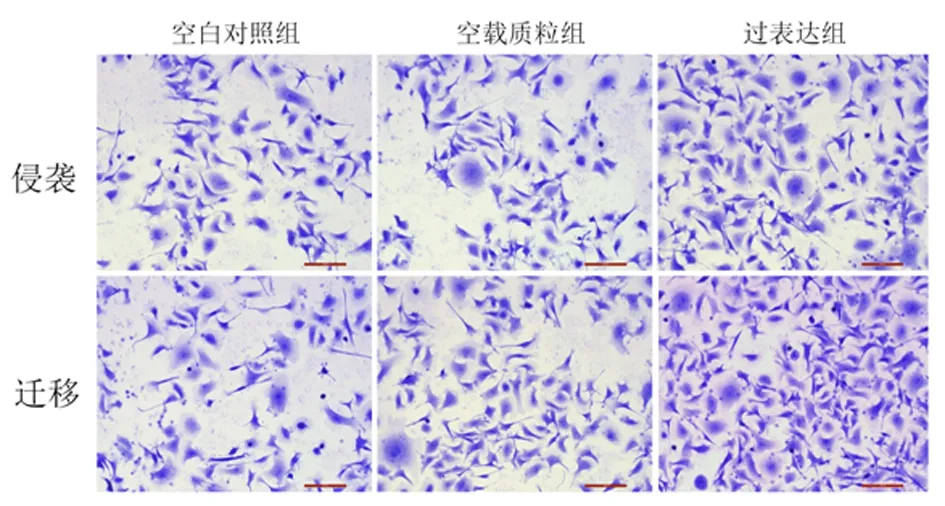
图示HOXA-AS2过表达可促进HTR-8/SVneo细胞侵袭和迁移

表 2 各组细胞侵袭和迁移数量比较
2.5过表达HOXA-AS2对HTR-8/SVneo细胞EMT的影响与空白对照组和空载质粒组比较,过表达组细胞中间质标志物蛋白Vimentin和N-cadherin显著上调(P<0.05),而上皮标志物蛋白E-cadherin显著下调(P<0.01)。见图4,表3。
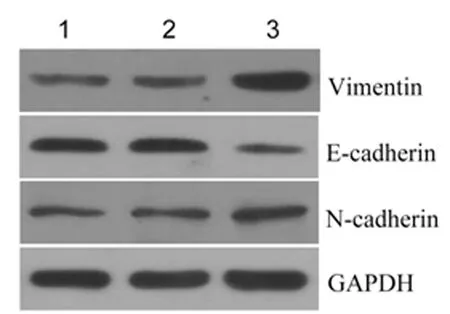
1:空白对照组;2:空载质粒组;3:过表达组

表 3 各组细胞中Vimentin、E-cadherin和N-cadherin蛋白相对表达水平
2.6过表达HOXA-AS2对Wnt/β-catenin信号通路的影响与空白对照组和空载质粒组比较,过表达组细胞中p-GSK3β蛋白水平显著下调(P<0.001),GSK3β蛋白水平无显著变化(P>0.05),而β-catenin和Snail1蛋白水平显著上调(P<0.05)。见图5,表4。
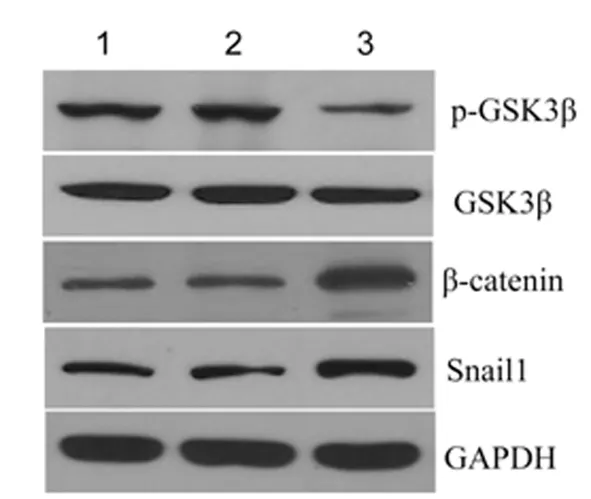
1:空白对照组;2:空载质粒组;3:过表达组

表 4 各组细胞中β-catenin、Snail1及p-GSK3β/GSK3β蛋白相对表达水平
3 讨 论
胎盘是胎儿与母体之间进行物质交换的重要器官,也是保证胎儿正常发育的重要场所。生理妊娠早期,胚胎发育是胎盘滋养细胞不断向母体子宫内膜浸润,启动血管重铸,形成循环脉管系统,促进子宫-胎盘界面血供及物质交换的过程。如果妊娠早期滋养细胞浸润不足,将会导致子宫螺旋动脉重塑障碍,引起胎盘着床较浅、血流灌注不足以及缺血缺氧等病理变化,最终诱发PE[10]。因此,深入了解影响滋养细胞浸润不足的病理机制,将有助于为临床预防和治疗PE提供理论依据。
临床上将SPE发病孕周≤34周划分为早发型SPE,而发病孕周>34周为晚发型SPE[9]。而早发型SPE妊娠并发症比晚发型SPE多且严重,如胎盘早剥、脑梗塞、脑出血等,而晚发型SPE妊娠妇女及胎儿预后相对较好[11]。既往研究[12]显示,早发型SPE与晚发型SPE的发病机制并不相同,前者属于胎盘源性疾病,与滋养细胞浸润不足有关;而后者属于母源性疾病,与母体血管系统损伤及胎盘动脉硬化有关。本研究发现,HOXA-AS2在早发型对照组患者胎盘组织中高表达,而在早发型SPE组患者胎盘组织中低表达。此外,晚发型对照组和晚发型SPE组患者胎盘组织中HOXA-AS2表达无显著性差异,且均低于早发型对照组,这主要是因为孕周>34周后胎盘发育成熟,且晚发型SPE发病机制与滋养细胞浸润不足无关。提示,HOXA-AS2在早发型SPE患者胎盘组织中低表达可能与胎盘滋养细胞浸润不足有关。
近年来,LncRNAs新的生物学功能被不断发掘,涉及包括胚胎发育、肿瘤发生发展等热门领域。众多LncRNAs,包括GHET1[13]、TINCR[14]、TCL6[15]等,已被证实参与PE发病机制的调控。而HOXA-AS2已被发现与许多癌症的发展密切相关,例如Zhang等[6]研究显示,HOXA-AS2在胆囊癌组织及细胞中高表达,其过表达可促进胆囊癌细胞增殖、迁移、侵袭及EMT。Wang等[16]报道称,HOXA-AS2在骨肉瘤组织及细胞株中高表达,敲低HOXA-AS2表达可显著抑制骨肉瘤细胞增殖、侵袭和迁移。众所周知,胎盘滋养细胞浸润行为与肿瘤细胞极为相似,因此推测HOXA-AS2可能参与胎盘滋养细胞浸润行为的调控。为了进一步证实推测,本研究采用HOXA-AS2过表达质粒转染滋养细胞HTR-8/SVneo,结果显示,HOXA-AS2过表达可促进HTR-8/SVneo细胞增殖、迁移与侵袭,并上调间质标志物蛋白Vimentin和N-cadherin,下调上皮标志物蛋白E-cadherin,说明HOXA-AS2可促进滋养细胞增殖、迁移、侵袭及EMT。表明,妊娠早期HOXA-AS2可以作为滋养细胞浸润的关键调控因子,其低表达可能是导致滋养细胞浸润不足的原因。此外,Jiang等[17]研究报道称,HOXA-AS2过表达可上调Wnt/β-catenin信号通路相关蛋白表达,进而调控乳头状甲状腺癌进程。然而,HOXA-AS2是否通过Wnt/β-catenin信号通路调控人胎盘滋养细胞EMT目前尚不清楚。
Wnt/β-catenin信号通路的激活是导致肿瘤起始和发展的关键,Wnt信号进入细胞后,通过抑制由GSK3β介导的β-catenin磷酸化,使β-catenin不被降解而在胞质中积累,并向细胞核内转移,激活下游Snail1、VEGF、COX-2等靶基因表达,参与肿瘤细胞增殖、转移、EMT等过程的调控[18-19],而滋养细胞中Wnt/β-catenin信号通路的激活机制与肿瘤细胞中相同[20]。有研究显示[21],Wnt/β-catenin信号通路的适度激活有助于滋养细胞浸润,而其被抑制将导致PE。因此,HOXA-AS2极有可能通过Wnt/β-catenin信号通路调控滋养细胞侵袭、迁移及EMT。本研究结果显示,HOXA-AS2过表达可下调HTR-8/SVneo细胞中p-GSK3β蛋白水平,上调β-catenin和Snail1蛋白水平,说明HOXA-AS2过表达可激活HTR-8/SVneo细胞中Wnt/β-catenin信号通路的转导,进而促进HTR-8/SVneo细胞增殖、迁移、侵袭及EMT。
综上所述,HOXA-AS2在ESPE胎盘组织中低表达,其过表达可通过激活Wnt/β-catenin信号通路促进滋养细胞EMT过程,并提高细胞侵袭和迁移能力。因此,HOXA-AS2低表达导致的滋养细胞浸润能力下降可能是诱发PE的一个重要原因,其有可能成为PE临床早期诊断和治疗的潜在靶点。