嗜酸乳杆菌-地衣芽孢杆菌融合子的制备工艺优化
2021-02-24高媛惠马林峰霍乃蕊
高媛惠,马林峰,霍乃蕊
(1.太原海关技术中心,山西太原 030024;2.山西农业大学动物医学学院,山西太谷 030801)
细胞融合是指2 个或2 个以上的亲代细胞通过细胞膜融合,细胞质混合,甚至细胞核融合后形成杂交细胞的现象,形成的子代细胞将兼具亲本细胞的表型[1]。细胞融合可自然发生[2],也可在体外通过促融剂来制备融合子。作为细胞生物学的一项核心技术[3],细胞融合技术在科学研究、动植物育种[4]、单克隆抗体[5-7]、疫苗、药物[8]制备和研发中广泛应用。菌体细胞融合之前需要制备成没有细胞壁的原生质体,原生质体融合时,2 个亲株整套基因发生接触、交换和组合,得到多种类型的重组子,从而可获得性能优良的菌株[9]。原生质体融合技术是21 世纪初发展起来的基于全基因组的定向微生物菌种改良技术[10],广泛用于食品添加剂[11]、药物[12]、食用菌[13]等的生产及生物治污。
本研究采用单因素试验考察菌龄、溶菌酶浓度、酶解温度和时间对原生质体形成率和再生率的影响,并以原生质体形成率为指标,通过正交试验优化原生质体制备工艺,旨在优化嗜酸乳杆菌和地衣芽孢杆菌的原生质体制备工艺来获得融合子,为产芽孢乳酸菌的育种和改良提供新的思路。
1 材料和方法
1.1 材料
嗜酸乳杆菌(Lactobacillus acidophilus)购自中国工业微生物菌种保藏管理中心。地衣芽孢杆菌(Bacillus licheniformis)BL20386 无毒菌株从整肠生胶囊(东北制药集团沈阳第一制药有限公司)中分离纯化。
1.2 试剂与仪器
柠檬酸三铵(天津市化学试剂六厂)、顺丁烯二酸(北京奥博星生物技术有限责任公司)、吐温-80(天津市风船化学试剂科技有限公司)。溶菌酶(sigma,活力为4 000 U/g)溶液为200 U/mL,过滤除菌-20 ℃储存备用。MRS 培养基、CM培养基、CMR培养基(地衣芽孢杆菌高渗再生培养基)、乳酸菌原生质体再生培养基、HMM(高渗MM)培养基、原生质体稳定液(SMM)均按文献[14]配制。
数字酸度计(PHS-25C,上大普仪器有限公司);可见分光光度计(WFJ2100,尤尼柯仪器有限公司);usb 数码成像显微镜(南京江南永新光学有限公司)等。
1.3 方法
1.3.1 酶解前活菌计数 嗜酸乳杆菌和地衣芽孢杆菌的活化菌种以0.5%(体积比)分别接种到MRS培养基和CM培养基,培养至对数生长期中期,取1.5 mL 离心收集菌体(3 500 r/min,10 min),生理盐水洗涤2 次,用1.5 mL SMM制成菌悬液。取0.1 mL菌悬液,生理盐水稀释并平板计数。地衣芽孢杆菌采用涂布法,乳酸菌采用浇注法或双层琼脂法,将稀释至10-5时的菌数计为A。
1.3.2 原生质体制备 菌悬液中加入适量溶菌酶,42 ℃水浴恒温酶解,期间每隔20 min 取样一次,并用0.5 mol/L 蔗糖液制片,结晶紫染色镜检,大部分菌体形成球形原生质体后停止酶解,进行原生质体计数。离心收集原生质体(3 500 r/min,15 min),并用高渗液洗涤除酶,悬浮于高渗缓冲液(0.2 mol/L磷酸盐缓冲液(pH 值6.0)中加入0.8 mol/L 甘露醇)备用。
1.3.3 裂解计数 取0.1 mL 酶解后的菌液,离心收集菌体并用PBS 溶液洗涤,蒸馏水稀释至10-5,分别涂布于CM和MRS 平板上计数,菌落数记为B,代表未脱壁菌数。等量吸取酶解后的菌液,用高渗缓冲液稀释至10-5,在再生培养基平板上计数,菌落数计为C,代表再生平板上的总菌数。
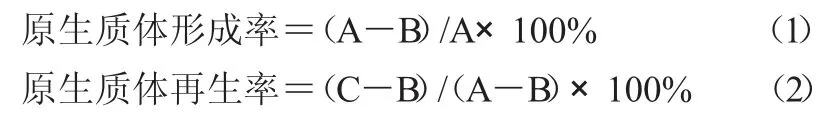
1.3.4 原生质体制备工艺的优化 分别收集培养8、12、16、18 h 的嗜酸乳杆菌菌液及培养4、6、8、10 h的地衣芽孢杆菌菌液,以5 mg/mL 溶菌酶37 ℃酶解4 h,考察菌龄对原生质体形成率和再生率的影响。
将嗜酸乳杆菌对数生长期菌体分别用1、5、10 mg/mL 的溶菌酶37 ℃酶解4 h,地衣芽孢杆菌则分别用0.25、0.50、1.00、1.50、2.00、2.50 mg/mL 溶菌酶37 ℃酶解4 h,考察酶浓度对原生质体制备的影响。
对数生长期嗜酸乳杆菌用5 mg/mL 溶菌酶分别酶解30、40、50 min,地衣芽孢杆菌用2.0 mg/mL的溶菌酶处理,每隔1 h 取样分析,考察酶解时间对原生质体制备的影响。
分别在30、37、42 ℃下用5 mg/mL 溶菌酶酶解嗜酸乳杆菌40 min,分别在25、37、40、42 ℃酶解地衣芽孢杆菌4 h,考察酶解温度对原生质体形成率和再生率的影响。
根据单因素试验结果,进行正交试验,各因素所设水平如表1 所示。
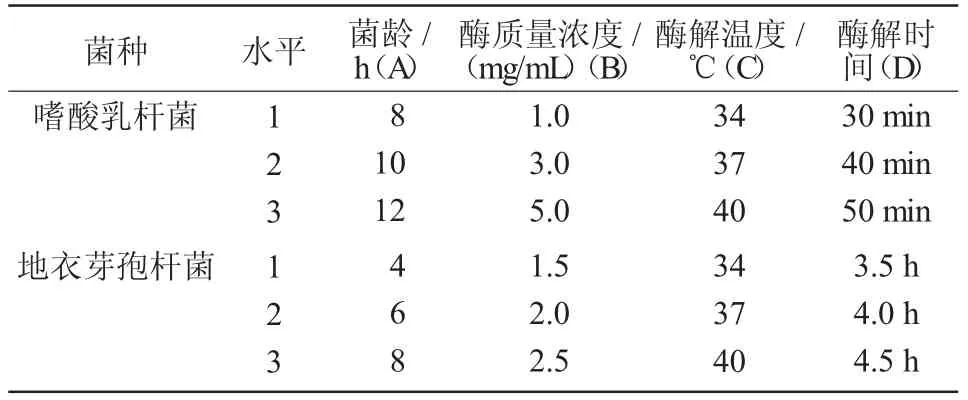
表1 嗜酸乳杆菌和地衣芽孢杆菌原生质体制备的因素水平
1.3.5 原生质体融合 分别取0.1 mL 悬浮在高渗缓冲液中的嗜酸乳杆菌和地衣芽孢杆菌原生质体,加0.9 mL 40%的PEG6000,混匀,室温下放置2 min融合,加1.5 mL 高渗缓冲液,离心收集沉淀,洗涤2 次,适当稀释后涂布于HMM平板,37 ℃培养7 d,菌落计数为D。
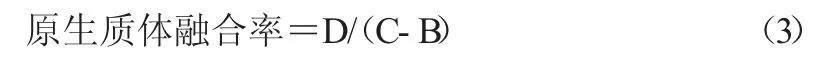
1.4 数据分析
试验采用Excel 软件进行数据整理与作图。
2 结果与分析
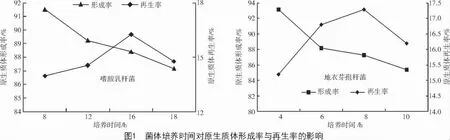
2.1 菌龄对原生质体形成率与再生率的影响
由图1 可知,随着培养时间的延长,原生质体形成率呈下降趋势,再生率呈先升高后下降。在对数生长期中期,嗜酸乳杆菌培养8~12 h,地衣芽孢杆菌培养4~8 h,原生质体形成率较高;对数生长末期,嗜酸乳杆菌(16 h)和地衣芽孢杆菌(8 h)的再生率最高,随后快速下降,故选择对数生长中期的菌体可兼顾较高的原生质体形成率和再生率。
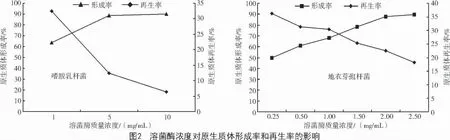
2.2 溶菌酶浓度对原生质体形成率与再生率的影响
由图2 可知,随着酶质量浓度的增加,原生质体的形成率呈上升趋势,而再生率逐渐下降。制备融合子,在保证一定形成率的前提下,更多地应考虑再生率。溶菌酶质量浓度为1.0~5.0 mg/mL(嗜酸乳杆菌)和2.0 mg/mL(地衣芽孢杆菌)时,可兼顾较高的原生质体形成率和再生率。
2.3 酶解时间对原生质体形成率与再生率的影响
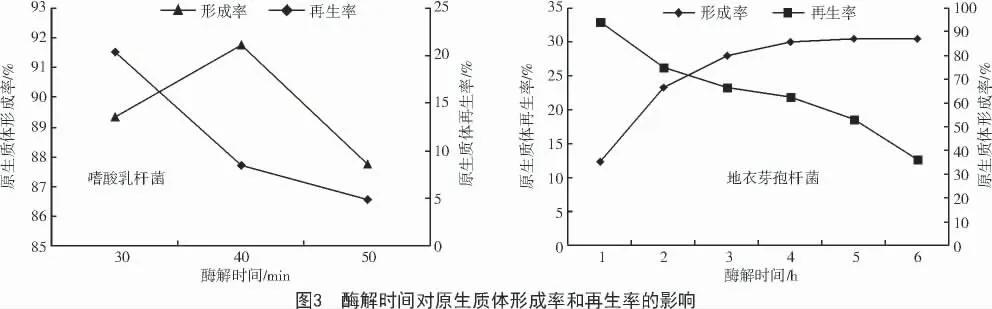
在制备原生质体时,酶解时间是一个很重要的因素。酶解时间延长,溶菌酶进一步破坏原生质体膜,使其完整性受损,影响细胞壁的再生。另外,酶解时间过长也可使原生质体的生理状态变差,无核原生质体的数量增加,再生能力减弱。由图3 可知,当酶解时间为40 min 时,大多数嗜酸乳杆菌已形成原生质体,原生质体形成率达到91.76%,随后开始下降,说明酶解时间的延长会引起原生质体的死亡,进而降低原生质体再生率。同理,地衣芽孢杆菌原生质体的形成率随酶解时间的延长而逐渐增加并在后期趋于平缓,再生率则呈现下降趋势,在酶解4 h 时,可兼顾较高的原生质体形成率(85.8%)和再生率(21.8%)。
2.4 酶解温度对原生质体形成率与再生率的影响
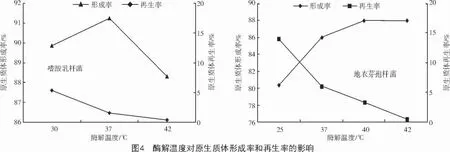
温度对酶解作用具有多重影响。温度升高,酶解反应速度加快,同时引起酶的钝化[14-15];另外,温度升高也加大了酶对原生质体的毒害作用,影响原生质体的再生率。由图4 可知,酶解温度对再生率影响较大。30~42 ℃范围内,嗜酸乳杆菌的再生率由5.35%降至0.32%;25~42 ℃范围内,地衣芽孢杆菌的再生率由14.1%降至0.6%。考虑到脱壁与再生的共同效应,兼顾原生质体形成率和再生率,确定2 个亲本菌株的酶解温度为37 ℃。
2.5 原生质体制备工艺的优化
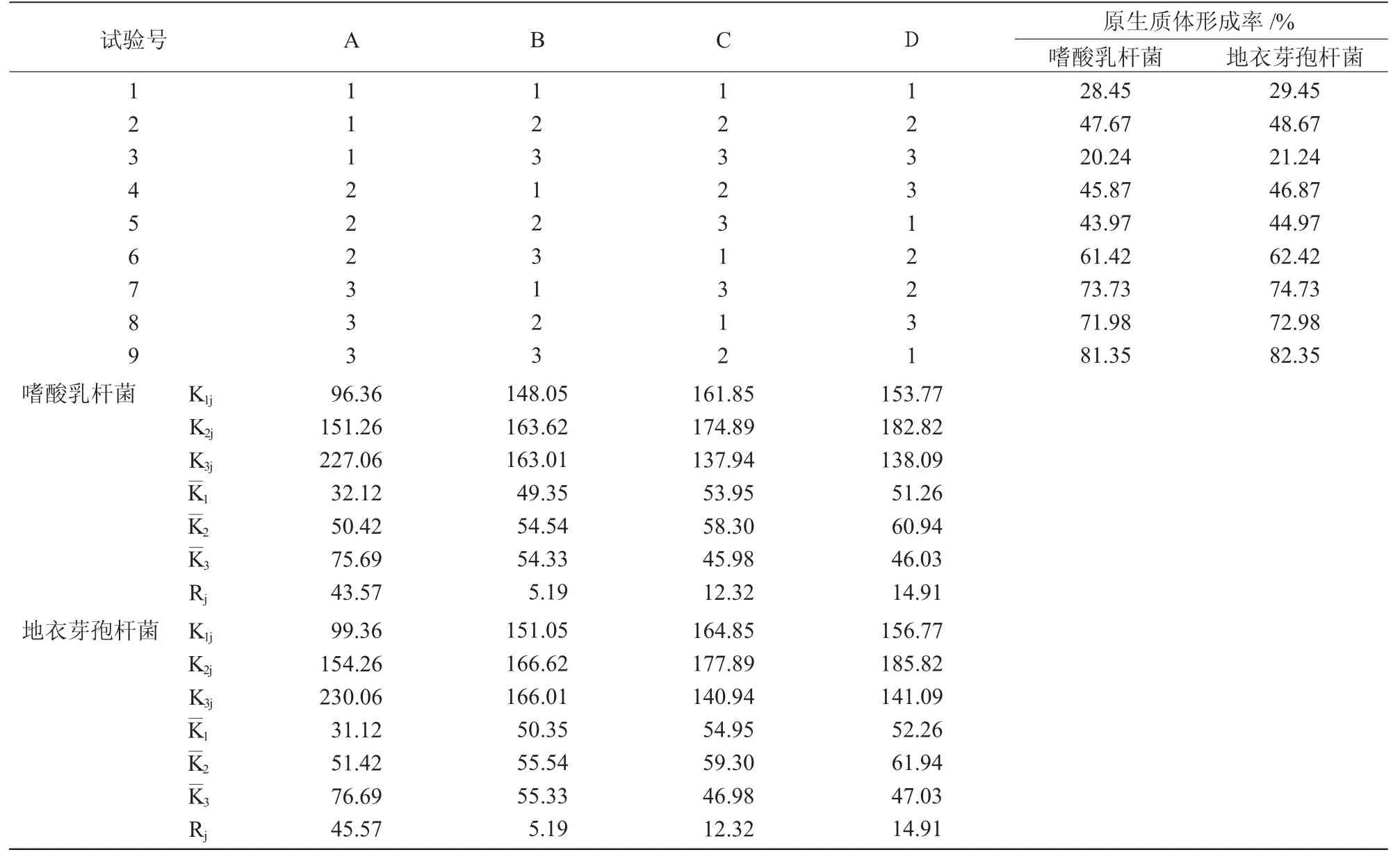
表2 嗜酸乳杆菌和地衣芽孢杆菌原生质体制备的正交试验结果L9(34)
由表2 可知,组合9(A3B3C2D1)的2 个亲本菌株的原生质体形成率均最高,嗜酸乳杆菌对应的参数为:培养12 h 的菌体用5.0 mg/mL 溶菌酶37 ℃酶解30 min;地衣芽孢杆菌对应的参数为:培养8 h的菌体用2.5 mg/mL 溶菌酶37 ℃酶解3 h。影响2 个亲本菌株原生质体制备的4 个因素从大到小排序为:A(菌龄)>D(酶解时间)>C(酶解温度)>B(酶浓度)。
以组合9 的条件分别制备嗜酸乳杆菌和地衣芽孢杆菌的原生质体,以PEG6000 为融合剂制备融合子,结果如表3 所示,原生质体融合率分别为4.6×10-6和3.8×10-6。经鉴定,再生培养基上形成的融合子均为杂合子,既可产酸,也可形成芽孢,具有不同于2 个亲本菌株的典型菌落特征。

表3 原生质体制备、再生与融合结果
3 结论
在嗜酸乳杆菌和地衣芽孢杆菌原生质体制备过程中,菌龄和酶解时间对原生质体形成率影响最大,其次为酶解温度和溶菌酶浓度。经过单因素试验和正交试验得出,嗜酸乳杆菌原生质体制备的最优工艺为取培养12 h 的对数生长中后期菌体用5.0 mg/mL 溶菌酶37 ℃酶解30 min;地衣芽孢杆菌则取培养8 h(对数生长中后期)的菌体用2.5 mg/mL溶菌酶37 ℃酶解3 h。在上述条件下分别制备原生质体,以PEG6000 为融合剂制备融合子,嗜酸乳杆菌和地衣芽孢杆菌的原生质体融合率分别为4.6×10-6和3.8×10-6,为产芽孢乳酸菌的原生质体育种及后续优良菌株的筛选奠定了基础。
