基于lncRNA-mRNA共表达网络的HBV相关肝癌生物靶点筛选及综合分析
2021-02-22农顺强陈晓昊许桂丹韦武均彭彬周律邓益斌
农顺强 陈晓昊 许桂丹 韦武均 彭彬 周律 邓益斌

【摘要】 目的 對公共基因表达数据库(GEO)中的HBV相关肝癌数据进行生物信息学分析,探讨长链非编码RNA(lncRNA)与mRNA在HBV相关肝癌中的作用。方法 从GEO数据库下载HBV相关肝癌数据集,利用相应R包对数据集的差异表达基因进行计算与比较,获取差异基因并构建lncRNA-mRNA共表达网络、蛋白质相互作用(PPI)网络和模块分析;继而对共表达网络中的mRNA进行基因本体论(GO)功能注释和京都基因与基因组百科全书(KEGG)路径分析;并分析与关键lncRNA高度相关的mRNA与患者生存曲线的相关性。结果 通过基因分析获得HBV相关肝癌高度相关的差异lncRNA 30个,mRNA 676个。共表达的mRNA主要参与的GO通路有细胞黏附、细胞运动的负调控、生物黏附、酶联受体蛋白信号通路、细胞趋化性;KEGG通路主要有类固醇激素生物合成、视黄醇代谢、PI3K-Akt信号通路、ECM-受体相互作用、化学致癌作用、黏着斑、Rap1信号通路等。与关键lncRNA(DNM3OS、HAND2-AS1、HELLPAR、AC126118.1、FAM230E、LINC01139、LINC01943、AL022344.1和PCAT7)高度相关的mRNA(GGT5、CEP55、DPT、TEK、TRIP13、STAB2、ESM1和MS4A1)与患者生存曲线有显著相关性(P<0.01)。结论 lncRNA (DNM3OS、HAND2-AS1、HELLPAR、AC126118.1、FAM230E、LINC01139、LINC01943、AL022344.1和PCAT7)对HBV相关肝癌的发生发展及预后具有重要作用,为HBV相关HCC发生发展的机制研究、预后指标、药物治疗靶点的选择等提供参考。
【关键词】 乙肝病毒;肝细胞癌;lncRNA-mRNA共表达网络;生物标志物
中图分类号:R735.7 文献标志码:A DOI:10.3969/j.issn.1003-1383.2021.01.004
【Abstract】 Objective To perform bioinformatics analysis on HBV related liver cancer data in public gene expression omnibus (GEO), so as to investigate the role of long non-coding RNA (lncRNA) and mRNA in HBV related hepatocellular carcinoma(HCC).Methods Data set of HBV related HCC were downloaded from GEO, and differentially expressed genes in the data set were calculated and compared by corresponding R packets to obtain differentially expressed genes and construct lncRNA-mRNA co-expression network, protein-protein interaction (PPI) network and module analysis. And then, gene ontology (GO) functional annotation and Kyoto encyclopedia of genes and genomes (KEGG) pathway analysis were performed on mRNA in co-expression networks, and correlation between mRNA highly related to key lncRNA and patient survival curve was analyzed.Results By genetic analysis, 30 highly correlated differential lncRNAs and 676 mRNAs were obtained for HBV related HCC. Main GO pathways involved in co-expressed mRNA were cell adhesion, negative regulation of cell movement, bioadhesion, enzyme-linked receptor protein signaling pathway and chemotaxis. KEGG pathways included steroid hormone biosynthesis, retinol metabolism, PI3K-Akt signaling pathway, ECM-receptor interaction, chemical carcinogenesis, focal adhesion and Rap1 signaling pathway, etc. mRNAs (GGT5, CEP55, DPT, TEK, TRIP13, STAB2, ESM1 and MS4A1) that highly co-expressed with the key lncRNAs (DNM3OS, HAND2-AS1, HELLPAR, AC126118.1, FAM230E, LINC01139, LINC01943, AL022344.1 and PCAT7) were significantly correlated with the survival curve of HBV related HCC patient(P < 0.01).Conclusion lncRNA (DNM3OS, HAND2-AS1, HELLPAR, AC126118.1, FAM230E, LINC01139, LINC01943, AL022344.1 and PCAT7) plays a crucial role in the occurrence, development and prognosis of HBV-related HCC, and provide reference for the study of mechanism, prognostic index, and selection of drug therapeutic targets, etc.
【Key words】 HBV; HCC; lncRNA-mRNA co-expression network; biomarker
肝细胞癌(hepatocellular carcinoma,HCC)是常见的恶性肿瘤之一,且恶性程度较高,其发病率居全球第六位、病死率居第四位[1]。慢性乙型肝炎病毒(HBV)感染是大多数高危HCC地区的主要危险因素。HBV参与肝细胞的癌变、侵袭和转移,在肝癌的发生发展中起着至关重要的作用[2~4]。由于缺乏特征性临床表现,HCC的大部分诊断多处于晚期,预后较差。尽管部分文献报道了一些用于早期诊断的血清生物标志物,但结果并不十分令人满意[5~7]。因此,探求新的早期发现与早期干预标志物,对于改善肝癌患者预后和提高其长期生存率尤为重要。
长链非编码RNA(lncRNA)一般是指长度大于200个核苷酸(nucleotide,nt),缺乏或者仅有微弱蛋白编码能力的RNA[8]。lncRNA以多種方式调节表观遗传、转录及转录后、翻译和翻译后水平的基因表达[9~10],积极参与肿瘤生长、转移和复发等多方面的调节[11~12]。lncRNA已经被证实与肝癌细胞的增殖、凋亡、侵袭和转移、血管生成及预后密切相关[13~14],参与肝癌进展过程中的各种生物学过程。例如,肝癌中表达上调的ZEB1-AS1通过调节上皮-间质转化诱导标志物的表达水平,参与HCC中的肿瘤生长和转移,且高表达ZEB1-AS1的患者与高转移复发和预后不良相关[15]。HULC在HCC中上调,与HBV感染及HCC患者肿瘤生长相关,并与其肿瘤分级、转移和耐药性相关[11]。虽然与HCC的lncRNA相关研究在逐日增多,但lncRNA在HBV相关肝癌发生发展进程中的作用及机制研究仍旧十分局限。
芯片技术、二代测序和其他基因检测技术及生物信息学的发展,为疾病的诊断和治疗靶点的发掘提供了新的技术手段[16]。本研究利用生物信息学方法,从GEO数据库中下载获得HBV相关肝癌基因数据,构建lncRNA-mRNA共表达网络,获取关键lncRNA,通过基因本体论(gene ontology,GO)和京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)分析HBV相关肝癌共表达mRNA所富集的信号通路,分析与关键lncRNA共表达的mRNA及HBV相关肝癌患者生存时间的相关性,探究关键lncRNA在肝癌发生、发展进程中的作用机制,从而为lncRNA在作为HBV相关肝癌的诊断、预后和治疗靶点的潜在生物标志物提供新的见解及有价值的信息。
1 资料与方法
1.1 数据材料
从美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GEO数据库中,检索HBV相关肝癌芯片表达数据集。选取GSE55092、GSE19665芯片表达数据集行后续分析。所选数据集均基于Affmetrix公司[HG-U133_Plus_2]平台,其中GSE55092包括49例肝癌和91例癌旁正常样本,GSE19665包括肝癌和癌旁正常样本各5例。以GSE14520的218例HBV相关肝癌数据做共表达mRNA的生存分析。
1.2 筛选差异表达基因
首先,我们从Affymetrix官方网站(www.affymetrix.com)下载芯片探针序列FASTA格式文件。然后,使用SeqMap工具将HG-U133_Plus_2芯片的探针序列与GENCODE的人类基因组(GRCh38)(https://www.gencodegenes.org/)(release 30)和lncRNA基因序列进行比对,获取非编码RNA(non-coding RNA)和信使RNA(mRNA)探针信息。使用R语言中的limma[17]包标准化数据,将HBV肝癌组与HBV正常组比较,以差异倍数2倍(|logFC|>1),P<0.05为标准,获取差异基因;使用R语言中Robust Rank Aggreg包[18],根据log Fold Change值对基因进行排序,并选出两个数据集中都存在差异表达的基因。
1.3 基因共表达分析
选取在2个数据集中,HBV肝癌和HBV正常患者中均差异表达的lncRNA和mRNA,纳入共表达分析网络。根据基因表达值,计算所有筛选出的差异表达lncRNA与mRNA两两间的皮尔森相关系数,选取相关系数绝对值|r|>0.75,且校正后P<0.05的lncRNA和mRNA对,导入Cytoscape 3.72构建共表达网络。
1.4 差异表达基因功能和通路富集分析
利用DAVID(https://david.ncifcrf.gov/)对共表达的差异基因进行GO富集分析及KEGG分析,以P<0.05为富集标准。
1.5 蛋白质相互作用网络构建
将共表达的mRNA,用在线数据String(https://string-db.org/)进行蛋白质互作(PPI)分析及MCODE模块识别,将结果网络引入Cytoscape进行可视化,选取基因模块,利用DAVID网站进行信号通路分析。
1.6 生存分析
使用R语言的“Survival”包行Kaplan-Meier生存分析,分析与lncRNA存在共表达关系的差异mRNA和HBV肝癌患者生存时间相关性,检验方法为Log-rankχ2,以α=0.05为检验水准。
2 结 果
2.1 差异基因筛选
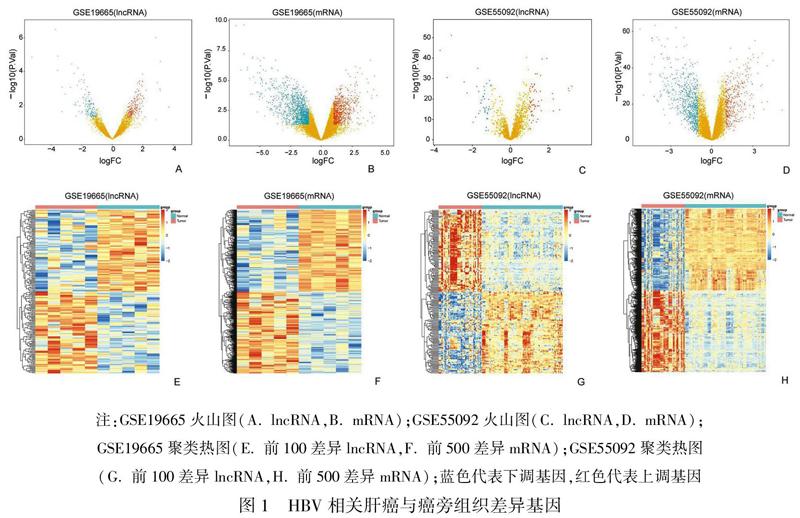
根据筛选条件,在数据集GSE55092中得到差异mRNA 1182个,上调基因412个,下调基因770个;差异lncRNA 103个,上调基因59个,下调基因44个。在数据集GSE19665中得到差异mRNA 2147个,上调基因833个,下调基因1314个;差异lncRNA 333个,上调基因195个,下调基因138个(图1)。根据log Fold Change值,对2个数据集差异基因进行排序,然后对2个数据集进行Robust Rank Aggreg分析,得到HBV肝癌相关可信度高的差异lncRNA 30个、mRNA 676个。
2.2 LncRNA-mRNA共表达网络分析
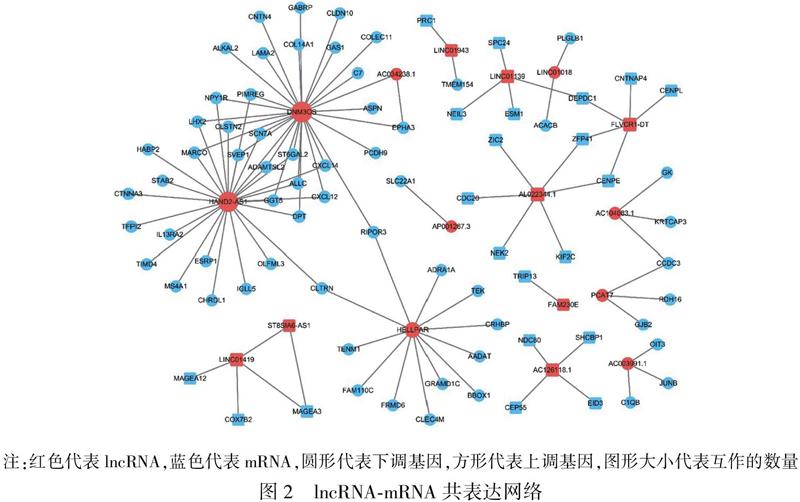
通过共表达网络构建(共表达相关系数绝对值|r|>0.75,且校正后P<0.05),发现有17个lncRNA及82个mRNA具有高度共表达关系。其中DNM3OS、HAND2-AS1、HELLPAR居于共表达网络核心位置,与众多mRNA均具有共表达关系(图2)。
2.3 差异基因功能富集及通路富集分析
對共表达的mRNA,通过DAVID进行GO分析发现,差异基因主要参与多细胞生物过程的负向调控、细胞黏附、细胞运动的负调控、生物黏附、酶联受体蛋白信号通路、细胞趋化性、单加氧酶活性跨膜受体蛋白酪氨酸激酶活性等。KEGG分析发现,共表达差异基因主要参与类固醇激素生物合成、补体和凝血级联、视黄醇代谢信号通路、ECM-受体相互作用、化学致癌作用、黏着斑、Rap1信号通路等(图3)。
2.4 共表达差异mRNA的蛋白质互作网络分析
将PPI网络引入Cytoscape进行可视化,使用MCODE插件进行模块识别,模块1包含28个基因及357连线,模块2包含10个基因及29连线(图4)。对模块进行KEGG通路富集,结果显示模块1主要与卵母细胞减数分裂、细胞周期相关;模块2主要与视黄醇代谢、化学致癌作用、药物代谢-细胞色素P450、代谢途径、类固醇激素生物合成、细胞色素P450对异生素的代谢、亚油酸代谢、药物代谢-其他酶等信号通路相关(表1)。
2.5 与关键lncRNA共表达的mRNA与HCC患者生存曲线相关性
为了进一步探讨上述关键lncRNA在HBV相关肝癌发生、发展中的作用,使用GSE14520数据分析与关键lncRNA存在高相关性的mRNA与HBV相关肝癌患者生存预后关系。K-M曲线结果显示,与9个关键lncRNA(DNM3OS、HAND2-AS1、HELLPAR、AC126118.1、FAM230E、LINC01139、LINC01943、AL022344.1和PCAT7)共表达的16个mRNA与HBV相关肝癌患者存在显著相关性(P<0.05),其中8个mRNA存在高度相关性(P<0.01)。见表2、图5。
3 讨 论
肝癌是一种发病率及病死率高的、世界范围的、常见的消化系统肿瘤。虽然有多种治疗方法,但其临床预后仍很差;鉴于早期诊断对生存的重要性,急需更准确和更特异的诊断及预后标志物。越来越多的研究报道lncRNA在HBV相关肝细胞癌发生中起着至关重要的作用[19],然而,关于lncRNAs作为预测性生物标志物和治疗靶点的研究仍然非常有限。
LncRNA通过表观遗传修饰、转录调控等多种方式影响其靶基因mRNA的表达[12]。LncRNA-mRNA共表达分析是鉴定lncRNA潜在靶基因和进一步研究lncRNA在疾病中生物学功能的常用方法。本文运用生物信息学技术,对NCBI-GEO数据库中HBV相关肝癌的数据进行综合分析,筛选出HBV相关肝癌可信度高的差异lncRNA及mRNA表达谱,并对差异表达基因行lncRNA-mRNA共表达分析。GO功能富集分析发现共表达网络中的mRNA主要影响多细胞生物过程的负向调控、细胞黏附、细胞运动的负调控、生物黏附、细胞周期进程、酶联受体蛋白信号通路、细胞趋化性、单加氧酶活性、跨膜受体蛋白酪氨酸激酶活性等。以上结果提示,共表达差异mRNA在HBV相关肝癌的细胞增殖和转移中起重要作用。KEGG分析发现,共表达差异基因主要参与类固醇激素生物合成、补体和凝血级联、视黄醇代谢、PI3K-Akt信号通路、ECM-受体相互作用、化学致癌作用、黏着斑、Rap1信号通路等。以上显著富集的与代谢相关的信号通路,包括类固醇激素生物合成、视黄醇代谢、化学致癌作用等信号通路主要为涉及细胞色素P450酶系统(CYP)的蛋白编码RNA;CYP在药物代谢中起着重要作用,参与内源性和外源性物质的代谢,包括药物和环境化合物[20],其通过化学致癌物的生物活性催化、癌症治疗药物的激活、作为癌症治疗的靶点和代谢酶等多种机制参与多种癌症[21]。黏着斑是一种膜相关的高分子集合体,将肌动蛋白、细胞骨架和整合素与细胞外基质连接起来,其在维持细胞张力和细胞生存的信号转导中起着重要作用,参与调节肿瘤细胞的EMT过程,调控肿瘤的侵袭和转移[22~23]。PI3K-Akt通路调节肿瘤细胞的增殖和存活,其活性异常不仅能导致细胞恶性转化,而且与肿瘤细胞的迁移、黏附、肿瘤血管生成以及细胞外基质的降解等相关[24~25]。有研究表明,HBV感染通过促进NF-κB与IAP家族成员细胞凋亡蛋白2(cIAP2)启动子的结合激活PI3K/AKT/NF-κB信号通路,在肝脏中诱导cIAP2表达而致肝癌[26]。细胞外基质(ECM)由基底膜细胞间质组成,可影响细胞分化、增殖、黏附、形态发生和表型表达等,在肿瘤的转移中起重要的组织屏障作用。肿瘤细胞通过与ECM中组分黏附后激活或分泌降解酶来消耗基质,形成局部溶解的肿瘤细胞转移通道。胶原在ECM影响肿瘤细胞生物学行为的功能密切相关[27],胶原降解是肿瘤细胞侵袭和转移的关键环节之一,ECM中胶原蛋白及其他蛋白主要被基质金属蛋白酶(MMPs)降解,如肝细胞癌组织MMP-2高于癌旁组织,可用于判断肝癌的侵袭转移。Ras蛋白是原癌基因ras的表达产物,Ras相关蛋白1(Rap1)为一种小的GTPase,通过调节整合素和其他黏附分子在不同细胞类型中的功能,在细胞-细胞和细胞-基质相互作用中起主导作用,它控制着细胞增殖、黏附、细胞间连接形成和细胞极性等多种过程;Rap1信号通路的异常激活,可促进肝癌细胞的增殖和侵袭转移[28]。这进一步说明本研究中发现的lncRNA 及其共表达差异mRNA在乙肝相关肝癌的发生、发展中起重要作用,研究这些通路将有助于阐明HBV相关肝癌增殖和侵袭的机制,并有助于预测肿瘤的进展和病人的预后。
本研究中发现的关键lncRNA在肝癌或其他肿瘤中有不同程度的报道。如DNM3OS在口腔癌、胃癌及其细胞系中表达上调,与细胞活力及侵袭转移相关[29~30],本研究发现DNM3OS在HBV相关肝癌中表达下调,其机理还有待进一步研究。HAND2-AS1在肝癌组织及细胞系中均呈低表达,其过表达降低了HCC细胞的活力和增殖[31]。有研究发现,HELLP综合征相关长链非编码RNA(HELLPAR/LINC-HELLP)可激活大量与细胞周期有关的基因,通过改变增殖速率或退出细胞周期而对滋养层细胞分化产生负面影响,减少增殖和侵袭,减少孕早期绒毛外滋养层细胞从增生型到浸润型的分化,且阻断HELLP突变位点可降低绒毛外滋养层细胞的侵袭能力[32~33];与本研究中预测HBV相关肝癌中表达下调的HELLPAR可能通过细胞周期的调控影响HCC进程一致。LINC01139在HCC组织和细胞系中过表达,并且与晚期TNM分期、淋巴结转移和HCC患者临床预后不良有关,敲低LINC01139可抑制HCC细胞的增殖、转移;相关机制研究显示,LINC01139可能充当miR-30的海绵来上调MYBL2表达而表现出HCC的致癌作用[34]。PCAT7在前列腺癌、非小细胞肺癌和鼻咽癌等恶性肿瘤中高表达,与肿瘤的侵袭转移相关[35~37],本研究发现PCAT7在HBV相关肝癌中表达下调,其机理还有待进一步研究。
本研究发现另4个lncRNA可能在HBV相关肝癌中有重要作用,并预测其功能。反义lncRNA可通过多种机制在转录水平或转录后水平调控相应正义的mRNA,从而发挥生物学功能。AC126118.1是LRRFIP2的反义链lncRNA,LRRFIP2基因编码的蛋白质与MYD88一起结合胞质尾部toll样受体4(TLR4),其导致NF-κB信号传导的激活;NF-κB在细胞增殖和凋亡的相关基因调控中起关键作用,与肿瘤的发生发展密切相关[38]。FAM230E是基因间长链非编码RNA基因家族成员,其序列相似性为230,该家族成员基因通过相似基因序列复制形成,特别是在人类染色体低拷贝重复序列(LCR)或节段性复制中,其功能尚未见相关报道[39~40]。另外本研究发现的长链非编码RNA LINC01943和AL022344.1也未见有相关文献的报道,其在HBV相关肝癌中的功能及机制有待进一步研究。
生存分析发现,共表达网络中16个mRNA与HBV相关肝癌患者的生存率显著相关,其中8个mRNA具有高度相关性。如细胞分裂蛋白调节因子1(PRC1)编码微管相关蛋白,在有丝分裂和细胞周期调控中起重要作用,敲低PRC1与微管相关因子可抑制胞质分裂,并显著减轻HCC的发展和肝损伤,高表达PRC1增加了HCC细胞化疗耐药性,并与不良预后相关[41~42]。CEP55在细胞质分裂中有重要作用,其可通过调节JAK2/STAT3/MMPs信号传导来促进HCC细胞迁移和侵袭[43]。DPT编码一种细胞外基质蛋白,该蛋白在细胞-基质相互作用和基质组装中发挥作用;DPT在肝癌中低表达且其表达水平与癌症转移和患者预后密切相关,其过表达显著抑制了体外HCC细胞迁移和体内肝内转移[44];DPT可能通過与TGF-β1相互作用或其他的潜在机制影响HCC的发生和进展[45]。TEK编码受体蛋白属蛋白酪氨酸激酶Tie2家族,为内皮细胞特异性受体,在调节血管生成和重塑中起重要作用;有研究显示,TEK低表达的透明细胞肾细胞癌患者预后较差并具有良好的诊断区分性,有望成为新的肿瘤标志物[46],这与我们在HBV相关HCC中的发现基本一致。STAB2基因编码跨膜受体蛋白,其可作用于血管生成、细胞黏附或受体清除等生物过程;在肿瘤细胞和淋巴管内皮细胞共培养的mRNA谱分析中,透明质酸受体STAB2、血管生成因子apelin受体(APLNR)和糖基化酶MAN1A1呈低表达,其参与肿瘤进程机制可能为促进肿瘤的淋巴转移[47]。研究表明,内皮细胞特异性分子-1(ESM1)在肝癌中过表达,可作为预测HCC生长和死亡的独立危险因素[48]。以上结果进一步证实了本研究发现的lncRNA在HBV相关肝癌的发生、发展中有着重要作用。
生物信息学作为一门新兴学科,目前已成为寻找癌症诊断及治疗靶点的一种分析方法。本研究通过生物信息学方法,综合分析了lncRNA及其共表达mRNA在HBV相关肝癌发生发展中的作用,为HBV相关HCC发生发展的机制研究、预后指标、药物治疗靶点的选择等提供参考。
参 考 文 献
[1] BRAY F,FERLAY J,SOERJOMATARAM I,et al.Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA:A Cancer J Clin,2018,68(6):394-424.
[2] LIU Y C,LU L F,LI C J,et al.Hepatitis B virus X protein induces RHAMM-dependent motility in hepatocellular carcinoma cells via PI3K-Akt-oct-1 signaling[J].Mol Cancer Res,2020,18(3):375-389.
[3] ZHENG S,WU H,WANG F,et al.The oncoprotein HBXIP facilitates metastasis of hepatocellular carcinoma cells by activation of MMP15 expression[J].Cancer Manag Res,2019,11:4529-4540.
[4] ZHA Y, YAO Q, LIU J S, et al. Hepatitis B virus X protein promotes epithelial-mesenchymal transition and metastasis in hepatocellular carcinoma cell line HCCLM3 by targeting HMGA2[J]. Oncol Lett, 2018,16(5):5709-5714.
[5] ALI O M, EL AMIN H A, SHARKAWY Y L, et al. Golgi Protein 73 versus Alpha-Fetoprotein as a New Biomarker in Early Diagnosis of Hepatocellular Carcinoma[J]. Int J Gen Med, 2020,13:193-200.
[6] CHO H J,BAEK G O,SEO C W,et al.Exosomal microRNA-4661-5p-based serum panel as a potential diagnostic biomarker for early-stage hepatocellular carcinoma[J].Cancer Med,2020,9(15):5459-5472.
[7] MA X L, TANG W G, YANG M J, et al. Serum STIP1, a Novel Indicator for Microvascular Invasion, Predicts Outcomes and Treatment Response in Hepatocellular Carcinoma[J]. Front Oncol, 2020,10:511.
[8] IYER M K, NIKNAFS Y S, MALIK R, et al. The landscape of long noncoding RNAs in the human transcriptome[J]. Nat Genet, 2015,47(3):199-208.
[9] ZHANG X P, WANG W, ZHU W D, et al. Mechanisms and Functions of Long Non-Coding RNAs at Multiple Regulatory Levels[J]. Int J Mol Sci, 2019,20(22):5573.
[10] PANDEY R R, KANDURI C. Transcriptional and Posttranscriptional Programming by Long Noncoding RNAs[J]. Prog Mol Subcell Biol, 2011,51:1-27.
[11] KLEC C, GUTSCHNER T, PANZITT K, et al. Involvement of long non-coding RNA HULC (highly up-regulated in liver cancer) in pathogenesis and implications for therapeutic intervention[J]. Expert Opin Ther Targets, 2019,23(3):177-186.
[12] HUANG Z, ZHOU J K, PENG Y, et al. The role of long noncoding RNAs in hepatocellular carcinoma[J]. Mol Cancer, 2020,19(1):77.
[13] HUANG J F, GUO Y J, ZHAO C X, et al. Hepatitis B virus X protein (HBx)-related long noncoding RNA (lncRNA) down-regulated expression by HBx (Dreh) inhibits hepatocellular carcinoma metastasis by targeting the intermediate filament protein vimentin[J]. Hepatology, 2013,57(5):1882-1892.
[14] XU D, YANG F, YUAN J H, et al. Long noncoding RNAs associated with liver regeneration 1 accelerates hepatocyte proliferation during liver regeneration by activating Wnt/β-catenin signaling[J]. Hepatology, 2013,58(2):739-751.
[15] LAN T, CHANG L, WU L, et al. Downregulation of ZEB2-AS1 decreased tumor growth and metastasis in hepatocellular carcinoma[J]. Mol Med Rep, 2016,14(5):4606-4612.
[16] 魏超, 張晓, 高杰. 长链非编码RNA与mRNA在胰腺癌中的差异表达及其预后价值[J]. 癌变·畸变·突变, 2019,31(2):119-126,132.
[17] RITCHIE M E, PHIPSON B, WU D, et al. limma powers differential expression analyses for RNA-sequencing and microarray studies[J]. Nucleic Acids Res, 2015,43(7):e47.
[18] BOLSTAD B M, IRIZARRY R A, STRAND M, et al. A comparison of normalization methods for high densityoligonucleotide array data based on variance and bias[J]. Bioinformatics, 2003, 19(2): 185-193.
[19] CHAUHAN R, LAHIRI N. Tissue- and Serum-Associated Biomarkers of Hepatocellular Carcinoma[J]. Biomark Cancer, 2016,8(Suppl 1):37-55.
[20] TORNIO A, BACKMAN J T. Cytochrome P450 in Pharmacogenetics: An Update[J]. Adv Pharmacol, 2018,83:3-32.
[21] ALZAHRANI A M, RAJENDRAN P. The Multifarious Link between Cytochrome P450s and Cancer[J]. Oxid Med Cell Longev, 2020,2020:3028387.
[22] LIU C Y,LIN H H,TANG M J,et al.Vimentin contributes to epithelial-mesenchymal transition cancer cell mechanics by mediating cytoskeletal organization and focal adhesion maturation[J].Oncotarget,2015,6(18):15966-15983.
[23] SHAH P P,FONG M Y,KAKAR S S.PTTG induces EMT through integrin αVβ3-focal adhesion kinase signaling in lung cancer cells[J].Oncogene,2012,31(26):3124-3135.
[24] MAYER I A,ARTEAGA C L.The PI3K/AKT pathway as a target for cancer treatment[J].Annu Rev Med,2016,67:11-28.
[25] RUIZ-SAENZ A, DREYER C, CAMPBELL M R, et al. HER2 Amplification in Tumors Activates PI3K/Akt Signaling Independent of HER3[J]. Cancer Res, 2018,78(13):3645-3658.
[26] LIAN J P,ZOU Y H,HUANG L,et al.Hepatitis B virus upregulates cellular inhibitor of apoptosis protein 2 expression via the PI3K/AKT/NF-κB signaling pathway in liver cancer[J].Oncol Lett,2020,19(3):2043-2052.
[27] JABOńSKA-TRYPU A, MATEJCZYK M, ROSOCHACKI S. Matrix metalloproteinases (MMPs), the main extracellular matrix (ECM) enzymes in collagen degradation, as a target for anticancer drugs[J]. J Enzyme Inhib Med Chem, 2016,31(sup1):177-183.
[28] MO S J, HOU X, HAO X Y, et al. EYA4 inhibits hepatocellular carcinoma growth and invasion by suppressing NF-κB-dependent RAP1 transactivation[J]. Cancer Commun (Lond), 2018,38(1):9.
[29] FANG X,TANG Z,ZHANG H,et al.Long non-coding RNA DNM3OS/miR-204-5p/HIP1 axis modulates oral cancer cell viability and migration[J].J Oral Pathol Med,2020,49(9):865-875.
[30] WANG S, NI B, ZHANG Z, et al. Long non-coding RNA DNM3OS promotes tumor progression and EMT in gastric cancer by associating with Snail[J]. Biochem Biophys Res Commun, 2019,511(1):57-62.
[31] BI H Q,LI Z H,ZHANG H.Long noncoding RNA HAND2-AS1 reduced the viability of hepatocellular carcinoma via targeting microRNA-300/SOCS5 axis[J].Hepatobiliary Pancreat Dis Int,2020,19(6):567-574.
[32] VAN DIJK M,VISSER A,BUABENG K M,et al.Mutations within the LINC-HELLP non-coding RNA differentially bind ribosomal and RNA splicing complexes and negatively affect trophoblast differentiation[J].Hum Mol Genet,2015,24(19):5475-5485.
[33] VAN DIJK M,THULLURU H K,MULDERS J,et al.HELLP babies link a novel lincRNA to the trophoblast cell cycle[J].J Clin Invest,2012,122(11):4003-4011.
[34] LI Z B, CHU H T, JIA M, et al. Long noncoding RNA LINC01139 promotes the progression of hepatocellular carcinoma by upregulating MYBL2 via competitively binding to miR-30 family[J]. Biochem Biophys Res Commun, 2020,525(3):581-588.
[35] LANG C, DAI Y, WU Z, et al. SMAD3/SP1 complex-mediated constitutive active loop between lncRNA PCAT7 and TGF-β signaling promotes prostate cancer bone metastasis[J]. Mol Oncol, 2020,14(4):808-828.
[36] LIU Q, WU Y, XIAO J, et al. Long Non-Coding RNA Prostate Cancer-Associated Transcript 7 (PCAT7) Induces Poor Prognosis and Promotes Tumorigenesis by Inhibiting mir-134-5p in Non-Small-Cell Lung (NSCLC)[J]. Med Sci Monit, 2017,23:6089-6098.
[37] LIU Y, TAO Z, QU J, et al. Long non-coding RNA PCAT7 regulates ELF2 signaling through inhibition of miR-134-5p in nasopharyngeal carcinoma[J]. Biochem Biophys Res Commun, 2017,491(2):374-381.
[38] VERZELLA D, PESCATORE A, CAPECE D, et al. Life, death, and autophagy in cancer: NF-κB turns up everywhere[J]. Cell Death Dis, 2020,11(3):210.
[39] DELIHAS N.Formation of a family of long intergenic noncoding RNA genes with an embedded translocation breakpoint motif in human chromosomal low copy repeats of 22q11.2—some surprises and questions[J].NcRNA,2018,4(3):16.
[40] DELIHAS N. A family of long intergenic non-coding RNA genes in human chromosomal region 22q11.2 carry a DNA translocation breakpoint/AT-rich sequence[J]. PLoS One, 2018,13(4):e0195702.
[41] WANG Y, SHI F, XING G H, et al. Protein Regulator of Cytokinesis PRC1 Confers Chemoresistance and Predicts an Unfavorable Postoperative Survival of Hepatocellular Carcinoma Patients[J]. J Cancer, 2017,8(5):801-808.
[42] LIU X, LI Y, MENG L, et al. Reducing protein regulator of cytokinesis 1 as a prospective therapy for hepatocellular carcinoma[J]. Cell Death Dis, 2018,9(5):534.
[43] LI M,GAO J,LI D,et al.CEP55 promotes cell motility via JAK2dSTAT3dMMPs cascade in hepatocellular carcinoma[J].Cells,2018,7(8):99.
[44] FU Y,FENG M X,YU J,et al.DNA methylation-mediated silencing of matricellular protein dermatopontin promotes hepatocellular carcinoma metastasis by α3β1 integrin-Rho GTPase signaling[J].Oncotarget,2014,5(16):6701-6715.
[45] LI X,FENG P,OU J,et al.Dermatopontin is expressed in human liver and is downregulated in hepatocellular carcinoma[J].Biochemistry:Mosc,2009,74(9):979-985.
[46] HA M, SON Y R, KIM J, et al. TEK is a novel prognostic marker for clear cell renal cell carcinoma[J]. Eur Rev Med Pharmacol Sci, 2019,23(4):1451-1458.
[47] OLIVEIRA-FERRER L,MILDE-LANGOSCH K,EYLMANN K,et al.Mechanisms of tumor-lymphatic interactions in invasive breast and prostate carcinoma[J].Int J Mol Sci,2020,21(2):602.
[48] VILLA E,CRITELLI R,LEI B,et al.Neoangiogenesis-related genes are hallmarks of fast-growing hepatocellular carcinomas and worst survival.Results from a prospective study[J].Gut,2016,65(5):861-869.
(收稿日期:2020-10-26 修回日期:2020-12-04)
(編辑:潘明志)
