益气化痰活血方对动脉粥样硬化小鼠主动脉p-NF-κB(p65)、p-IκB表达的影响
2021-02-22郭杨志杜娟姜敏郭伟
郭杨志 杜娟 姜敏 郭伟
动脉粥样硬化(atherosclerosis,AS)是一种以血清中异常升高的脂类物质为启动因子,伴有多种炎症因子参与的炎症性动脉疾病,以动脉内膜下脂质沉积、内膜纤维性增厚、AS斑块形成为主要病理变化[1]。课题组前期研究发现,载脂蛋白E(apolipoprotein E,ApoE)基因敲除小鼠构建的AS模型中,核因子κB(nuclear factor-kappa B, NF-κB)通路相关炎性因子,如可溶性细胞间黏附分子-1、可溶性血管细胞黏附分子-1均明显升高,主动脉弓内的NF-κB表达较正常小鼠增多,而以益气化痰活血法为治疗原则的调脂通脉颗粒对以上蛋白表达具有一定抑制作用[2-3]。在本研究中,课题组以NF-κB通路中的NF-κB(p65)及κB 抑制蛋白(inhibitor of κB,IκB)的磷酸化产物为切入点,进一步探讨调脂通脉颗粒改善AS病变的作用机制。
1 材料与方法
1.1 实验动物
SPF级6周龄ApoE基因敲除雄性小鼠30只,同种系6周龄C57 BL/6 J雄性小鼠10只,体重均为(22±2)g,均购自北京维通利华实验动物技术有限公司,实验动物合格证号:SCXK(京) 2012-0001。实验小鼠饲养于北京市卫生局临床药学研究所SPF级动物房,饲养条件:室温22~24℃,相对湿度50%, 光照时间7:00~19:00,各组小鼠均自由采食摄水。研究期间所有操作严格依照首都医科大学实验动物伦理委员会的要求进行。
1.2 实验药物
调脂通脉颗粒由太子参25 g、丹参25 g、红花10 g、陈皮15 g、茯苓25 g、泽泻25 g等组成,汤药组方饮片量由北京康仁堂药业有限公司配制,为全成分颗粒剂;非诺贝特胶囊(力平之,注册证号:H20100602),购自法国利博福尼制药公司。
1.3 主要试剂与仪器
一抗兔抗鼠p-NF-κB(p65)、p-IκB多克隆抗体(美国Cell Signaling Technology公司,批号:3033、2859);辣根过氧化酶标记的山羊抗兔IgG二抗(美国Jackson公司,批号:111-035-003);荧光(Cy3)标记的山羊抗兔IgG二抗(武汉博士德生物工程有限公司,批号:BA1032);BCA蛋白浓度检测试剂盒(北京Cwbiotech公司,批号:02912E); DAB显色剂及EDTA抗原修复液,均购自北京中科万邦生物科技有限公司; 普通饲料及高脂饲料(脂肪21%、胆固醇0.15%、普通饲料78.85%)均购自北京科澳协力饲料有限公司,合格证号:SCXK(京) 2014-0010。
高速冷却离心机(长沙湘仪离心机仪器有限公司);电泳仪(美国 Bio-Rad公司);形态学图像分析系统(江苏省捷达科技发展有限公司);全自动生化仪AU480(日本 Olympus公司);光学显微镜(日本 Olympus公司);转膜系统及凝胶成像仪(上海天能科技有限公司);PH检测仪(德国 Sartorius公司);包埋机(武汉俊杰电子有限公司);酶标仪(美国 Thermo公司);病理切片机(德国徕卡公司);荧光显微镜(上海彼爱姆光学仪器制造有限公司)。
1.4 造模分组及给药
30只ApoE基因敲除小鼠使用随机数字表法随机分为模型组、非诺贝特组和调脂通脉颗粒组,每组各10只,在高脂饮食饲养基础上,分别予生理盐水、非诺贝特及调脂通脉颗粒灌胃。另取10只C57BL/6J小鼠予普通饮食饲养,并予等量生理盐水灌胃。各组药物用量参考《药理实验方法学》[4]及课题组前期研究制定[2,5]。非诺贝特用量:30 mg/kg(为人用量的9.01倍);调脂通脉颗粒用量:以调脂通脉颗粒饮片方人用生药量的20倍作为小鼠实验用量,再将对应用量的饮片提取为颗粒剂,最终用量相当于生药量为110 g/(kg·d)。各组适应性饲养1周后,每日给药1次,连续给药12周。
1.5 实验动物取材
各组连续给药12周,最后一次用药干预后,各组小鼠禁食、不禁水12小时,麻醉并称重后采用眼球取血法收集约1 mL血量,静置2小时,3000 r/min,离心15分钟,分离血清并分装,-80℃冰箱保存。取血后,暴露并分离各组小鼠主动脉弓及腹主动脉组织。将主动脉弓组织横向分为两份,均投入4%多聚甲醛溶液固定,分别进行病理观察及荧光免疫染色。腹主动脉组织放入液氮中短时保存,再置于-80℃冰箱中保存待测。
1.6 观察指标及检测方法
1.6.1 血清生化指标测定 使用全自动生化分析仪,采用氧化酶法测定小鼠血清总胆固醇(total cholesterol,TC)、甘油三酯(thyroglobulin,TG)水平,采用直接法测定低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)水平。
1.6.2 病理学观察 将4%多聚甲醛固定后的小鼠主动脉弓组织常规石蜡包埋切片,每张切片厚度约5 μm。常规HE染色后,使用光学显微镜观察主动脉弓组织内膜结构及AS斑块表现,并于高倍镜(×400)视野下拍照。
1.6.3 荧光免疫染色 将小鼠主动脉弓组织常规石蜡包埋切片,切片厚度为5 μm,分别经二甲苯及乙醇处理后,加入EDTA修复液,于微波炉内修复。经PBS冲洗3次后,滴加1∶100的一抗兔抗鼠p-NF-κB(p65)多克隆抗体,4℃过夜;再次 PBS冲洗,加入荧光(Cy3)标记的山羊抗兔 IgG二抗,于37℃温箱内孵育30分钟,4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)液复染,使用水溶性封片剂封片,置于荧光显微镜下观察p-NF-κB(p65)表达,高倍镜(×200)视野下拍照。
1.6.4 NF-κB经典通路蛋白表达 使用Western blot法检测各组小鼠腹主动脉内的p-NF-κB(p65)、p-IκB蛋白水平。预冷RIPA蛋白抽提试剂,加入磷酸酶抑制剂及蛋白酶抑制剂。组织按10%匀浆,即20 mg组织加入200 μL RIPA裂解液,电动匀浆器30000 r/min,匀浆10分钟,于4℃,13000 r/min离心20分钟,取上清进行蛋白定量及蛋白样本制备。按照BCA蛋白定量试剂盒使用说明操作,测定蛋白浓度,并以RIPA调整蛋白浓度,样品终浓度为3 μg/uL。每泳道上样蛋白30 μg,SDS-PAGE电泳后,电转膜至PVDF膜, 加入1∶1000兔抗鼠 p-NF-κB(p65)、p-IκB多克隆抗体、GAPDH,4℃封闭过夜,TBST洗涤3次,每次10分钟,加入 HRP标记的羊抗兔二抗,1小时后,TBST洗涤3次,每次10分钟。将ECL滴加到膜的蛋白面,反应3分钟,胶片曝光后显影2分钟,定影。 图片扫描后,使用Gel Image system(上海天能科技有限公司,4.00版本)进行灰度分析。
1.7 统计学方法
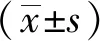
2 结果
2.1 血清血脂水平
与正常组比较,模型组、调脂通脉颗粒组、非诺贝特组小鼠血清TC、TG、LDL-C、HDL-C水平均明显升高(P<0.05);与模型组比较,调脂通脉颗粒组、非诺贝特组小鼠血清TG明显降低(P<0.05);与非诺贝特组比较,调脂通脉颗粒组小鼠血清TG水平明显降低(P<0.05),其余组间比较差异无统计学意义(P>0.05),结果见表1。

表1 各组AS小鼠血清血脂水平比较只)
2.2 主动脉弓HE染色
正常组主动脉内膜光滑,结构完整,局部无断裂及缺损,内膜无增厚、无炎性细胞浸润, 管壁无可见斑块,血管管腔通畅无狭窄(图1A)。模型组内膜结构局部断裂而不连续,部分内膜明显增厚,并可见炎性细胞浸润,在内膜局部还可看到大量脂类物质进入内膜下形成的胆固醇结晶及较大斑块,血管管腔壁明显狭窄,斑块纤维帽较薄(图1B)。调脂通脉颗粒组及非诺贝特组主动脉内膜亦可观察到增厚及局部结构破坏(图1C、D),并可在内膜局部观察到脂类物质沉积形成的粥样斑块。与模型组比较,调脂通脉颗粒及非诺贝特组斑块内部的胆固醇结晶较少,且调脂通脉颗粒组斑块纤维帽较厚。
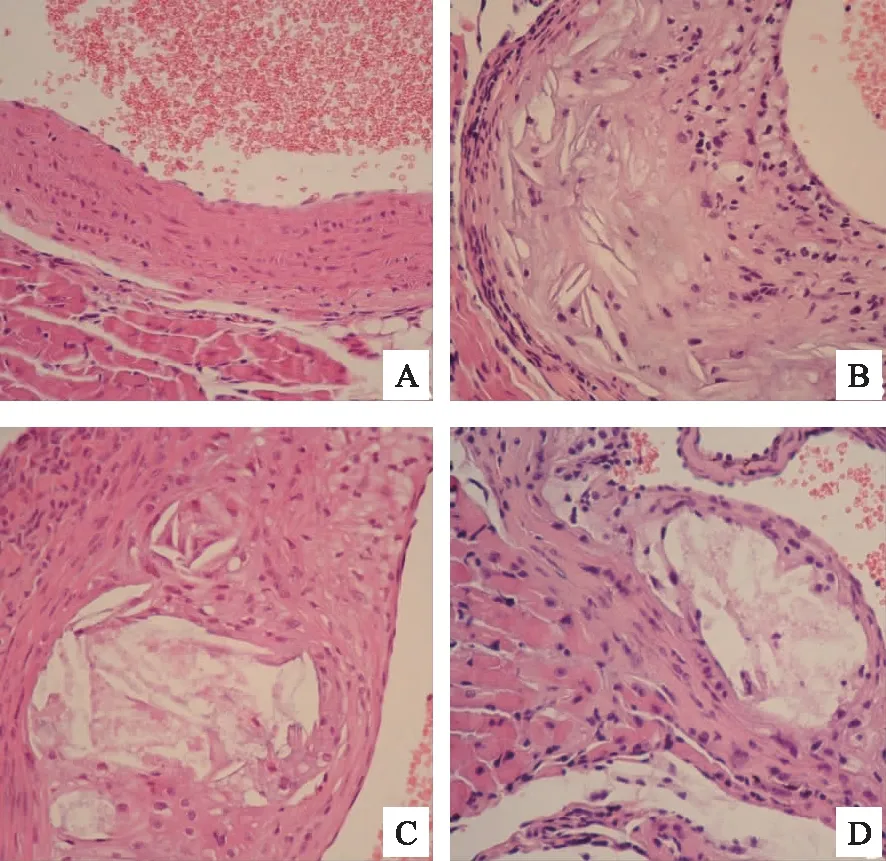
注:A正常组;B模型组;C调脂通脉颗粒组;D非诺贝特组。
2.3 主动脉弓p-NF-κB(p65)荧光免疫染色
正常组可见主动脉内膜结构连续完整,其内可见红色荧光显示的p-NF-κB(p65)表达(图2A)。与正常组比较,模型组主动脉弓内皮增厚,局部断裂,结构不完整,并可见p-NF-κB(p65)表达增多,红色荧光密集分布于主动脉内皮上(图2B)。与模型组比较,非诺贝特组和调脂通脉颗粒组主动脉弓结构尚完整,损伤较模型组小,内膜中的红色荧光亮度低于模型组(图2C、D)。
2.4 腹主动脉p-NF-κB(p65)、p-IκB蛋白表达
模型组小鼠腹主动脉p-NF-κB(p65)、p-IκB表达明显高于正常组(P<0.05);经药物干预后,非诺贝特组、调脂通脉颗粒组腹主动脉p-NF-κB(p65)、 p-IκB表达较模型组明显降低(P<0.05)。而与非诺贝特组比较,调脂通脉颗粒组腹主动脉p-NF-κB(p65)、p-IκB表达差异不明显,结果见表2、图3。

注:A正常组;B模型组;C调脂通脉颗粒组;D非诺贝特组。

表2 各组AS小鼠腹主动脉p-NF-κB、 p-IκB蛋白表达比较

注:A正常组;B模型组;C调脂通脉颗粒组;D非诺贝特组。
3 讨论
脂类代谢异常导致低密度脂蛋白、氧化型低密度脂蛋白等脂质向血管内皮下浸润,是AS的重要病因,而血清TG及富含TG脂蛋白水平升高,均具有类似LDL-C的致AS作用[6-8]。本研究发现,调脂通脉颗粒可有效降低血清TG水平,且其主动脉弓处形成的斑块,较模型组损伤较小,提示调脂通脉颗粒可能通过降低血清TG水平,起到一定的改善AS斑块形成的作用。
NF-κB是AS炎症反应过程中的关键因子。在无转录活性的静息状态下,组成NF-κB蛋白二聚体的RelA(p65)及p50停留在胞浆中,并与IκB结合。当炎症因子等刺激时,IκB 的上游激酶(IκB kinase, IKK)激活并使 IκB磷酸化(p-IκB)及泛素化而降解。由于p50亚基有核定位信号,IκB降解后p50同RelA(p65)移入细胞核内。而磷酸化的RelA(p-RelA)能识别并结合特定的DNA序列,发挥其对靶基因转录的调控作用[9-10]。在本研究疫荧光染色中发现,正常组小鼠主动脉内皮即有一定量的 p-NF-κB(p65)表达,说明在生理情况下血管内皮存在一定量激活的NF-κB,以维持内皮生理功能。模型组可见p-NF-κB(p65)荧光亮度明显增加,即蛋白表达增多,可能提示AS过程中活跃的炎症反应。经调脂通脉颗粒组干预后,p-NF-κB(p65)荧光亮度下降,蛋白表达受到抑制,推测调脂通脉颗粒可能具有抑制 NF-κB磷酸化,从而缓解AS病变的作用。此外,在本研究的Western blot检测中观察到,调脂通脉颗粒能够明显减少腹主动脉p-NF-κB(p65)及p-IκB蛋白表达,结合课题组前期发现其对动脉粥样硬化过程中黏附分子表达的影响[5],说明调脂通脉颗粒对NF-κB及其下游炎症因子均有一定的抑制作用。
在AS的临床治疗中,调节血脂水平药物和抑制血小板聚集药物是目前重要的防治手段[11]。虽然对于NF-κB及其下游炎性因子参与动脉粥样硬化发病的机制研究已有了大量成果,但临床上仍缺乏将NF-κB直接作为干预靶点的药物。这可能由于NF-κB除了参与多种疾病的病理过程之外,更具有维持机体正常免疫应答反应、维持内稳态等重要生理功能。而以高浓度、强作用的化学药物抑制NF-κB,虽然体外实验效果明显,但应用于人体可能直接导致细胞功能障碍从而损伤机体[12]。但目前研究发现,一些中药复方对NF-κB及其通路相关因子都有不同程度的调节作用[13-14],而调脂通脉颗粒以益气化痰活血为指导原则,亦对NF-κB因子及其下游炎症产物具有调节作用,似乎能够成为防治AS的补充手段。
总之,本研究说明调脂通脉颗粒具有改善AS病变的作用,该作用可能与其抑制血管内皮的NF-κB磷酸化、减少p-NF-κB(p65)、p-IκB蛋白表达相关。
