长链非编码RNA CCHE1在胰腺导管腺癌中的表达及临床意义
2021-02-22邵庆亮臧辉郭恩玲张志强
邵庆亮,臧辉,郭恩玲,张志强
·论著·
长链非编码RNA CCHE1在胰腺导管腺癌中的表达及临床意义
邵庆亮,臧辉,郭恩玲,张志强
110016 沈阳,辽宁省人民医院胆胰外科
检测长链非编码 RNA(lncRNA)CCHE1 在胰腺导管腺癌(PDAC)细胞和组织中的表达,探讨 lncRNA CCHE1 与 PDAC 临床病理特征及预后间的关系。RT-PCR 检测 PDAC 组织及配对癌旁组织以及 PDAC 细胞和胰腺导管上皮细胞中 lncRNA CCHE1 的表达;利用单因素方差分析探讨 lncRNA CCHE1 与 PDAC 患者临床病理特征之间的关系;利用生存曲线分析 lncRNA CCHE1 与 PDAC 患者术后 5 年生存率的关系;利用 Cox 风险比例模型分析 lncRNA CCHE1 与 PDAC 患者预后的关系。lncRNA CCHE1 在 PDAC 组织和细胞中均呈过表达;lncRNA CCHE1 的表达与 PDAC 的分化程度以及 TNM 分期密切相关(< 0.05);lncRNA CCHE1 高表达的 PDAC 患者术后无病生存时间和总生存时间均低于低表达的患者,lncRNA CCHE1 高表达是 PDAC 患者预后的独立危险因素。lncRNA CCHE1 在 PDAC 中表达升高,与 PDAC 的分化程度、TNM 分期以及生存时间及预后相关。
lncRNA CCHE1; 胰腺导管腺癌; 预后; 生存
胰腺癌是常见的消化系统恶性肿瘤[1],也是我国癌症死亡的主要原因之一,其发病率呈上升趋势。在所有的胰腺癌中,胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)约占 90%[2]。PDAC 因其早期诊断率低,恶性程度高,容易对传统治疗手段产生耐药,所以治疗效果差[3]。虽然在过去的几十年里,人们在胰腺癌的研究上付出了巨大的努力,但进展期胰腺癌的存活率并没有明显提高。临床实践中,TNM 分期仍然是对患者进行分层、制定治疗方案和推测预后的最可靠工具。但是相同 TNM 分期、接受相同治疗的 PDAC 患者生存结局可能存在显著差异[4]。为了改善预后,有必要寻找可靠的分子标志物,进而识别需要重点随访和治疗的高危患者。
长链非编码 RNA(long noncoding RNAs,lncRNA)是一种长度大于 200个核苷酸的 RNA 转录本,其编码蛋白质的能力较弱[4]。但其在基因的转录调控和转录后修饰中发挥重要作用,广泛参与染色体重构、细胞分化以及免疫应答[5]。目前已有 lncRNA 参与 PDAC 发生发展的相关研究报道:lncRNA SOX2OT可促进胰腺癌细胞增殖[6],lncRNA NORAD 通过诱导上皮间质转化促进胰腺癌的侵袭转移等[7]。
本研究中,我们应用 RT-PCR 检测 lncRNA宫颈癌高表达 1(cervical carcinoma high-expressed 1,CCHE1)在 PDAC 组织和癌旁组织以及其在胰腺癌细胞株中的表达情况,并分析其与 PDAC 患者临床病理数据的相关性,为 PDAC 预后评估提供新的潜在分子标志物。
1 材料与方法
1.1 材料
1.1.1 组织标本 本研究方案经医院道德与伦理委员会批准通过,所用PDAC 组织及癌旁组织选取 2008 年 1 月 – 2015 年 12 月于我院行手术治疗患者的组织标本,共计 90 例。入组患者在我院确诊为 PDAC 并行根治性切除术,所有患者肿瘤组织及配对癌旁组织新鲜取材,癌旁组织距肿瘤边缘 2 cm 以上,避免肿瘤中心明显钙化或坏死部分;标本获取后放入冻存管并立即保存于液氮中,备后续实验使用。所有患者均未接受术前放化疗,且无其他肿瘤病史及器官重大疾病史。电话随访(最长随访时间 72 个月,失访 5 人)记录预后生存资料:无病生存时间(disease-free survival,DFS),总生存时间(overall survival,OS)。共纳入:男性53 例,女性 37 例;TNM 分期,I 期 25 例,II 期 18 例,III 期 45 例,IV 期 2 例;胰头癌患者 34 例行标准胰十二指肠切除术,14 例胰腺中段占位行胰腺中段切除,42 例胰尾占位行胰体尾切除联合脾切除。随访终点时间为死亡或本研究截止日,具体如表 1 所示。
1.1.2 细胞 胰腺癌细胞系 AsPC-1、HPAC、BxPC-3、Panc-1和正常胰腺导管上皮细胞系 HPDE6-C7取自辽宁省人民医院中心实验室。
1.1.3 培养基 RPMI1640 培养基购自美国 Invitrogen 公司;10% 胎牛血清购自天津市灏洋生物制品科技有限责任公司;DMEM 培养液购自美国 Gibico 公司;CO2无菌培养箱购自美国 Thermo 公司。
1.2 方法
采用TRIzol 法提取病理标本和细胞中的总RNA,并检测 RNA 的纯度及浓度。以 U6 作为内参进行相对定量,每组设 3 个复孔。lncRNA CCHE1 的上游引物序列为 5' TCACAGCCTATTG ACCTCT 3',下游引物序列为 5' GAGCAGCATACA GACATCTA 3';U6 的上游引物序列为 5' TTATG GGTCCTAGCCTGAC 3',下游引物序列为 5' CAC TATTGCGGGCTGC 3'。采用 2-△△Ct法计算两者的相对表达量。
1.3 统计学处理

表1 患者特征和单变量分析(n = 90)
2 结果
2.1 lncRNA CCHE1 在 PDAC 组织和细胞中的表达水平
RT-PCR 结果显示,相对癌旁组织,lncRNA CCHE1在 PDAC 组织中表达水平为 2.32 ± 0.53,差异具有统计学意义(< 0.05,图 1A)。而 lncRNA CCHE1 在人胰腺癌细胞系 AsPC-1、HPAC、BxPC-3、Panc-1 中的相对表达水平分别为 2.587 ± 0.285、2.756 ± 0.388、3.410 ± 0.398、3.09 ± 0.29,较胰腺导管上皮细胞 HPDE6-C7 中的 lncRNA CCHE1 的表达水平明显升高,差异有统计学意义(< 0.05,图 1B)。
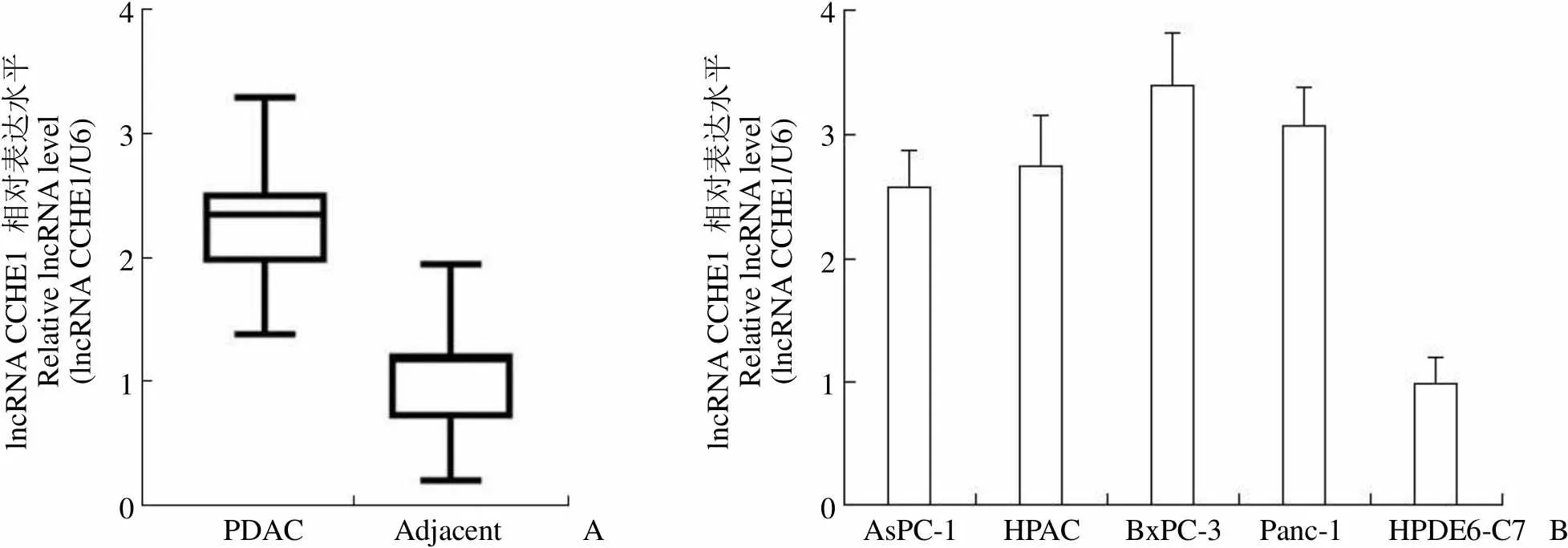
lncRNA CCHE1 相对表达水平Relative lncRNA level(lncRNA CCHE1/U6)4 3 2 1 0 lncRNA CCHE1 相对表达水平Relative lncRNA level(lncRNA CCHE1/U6)4 3 2 1 0 PDAC AdjacentA AsPC-1 HPAC BxPC-3 Panc-1 HPDE6-C7B
Figure 1 Comparison of lncRNA CCHE1 expressions between PDAC cells and tissues (A: The expression of lncRNA CCHE1 in PDAC tissue and adjacent tissue; B: The expression of lncRNA CCHE1 in PDAC and ductal epithelial cells of the pancreas cells)

表 2 lncRNA CCHE1 表达与临床病理特征
2.2 lncRNA CCHE1 的表达水平同 PDAC 患者临床病理特征关系
lncRNA CCHE1 在 PDAC 组织中表达的均数为 2.32,将表达水平高于 2.32 的患者归为 lncRNA CCHE1 高表达组,共包括 46 名患者(51.1%),将表达水平低于 2.32 的患者作为 lncRNA CCHE1 低表达组,共包括患者 44 名(48.9%)。单因素 ANOVA 分析 lncRNA CCHE1 表达与 PDAC 临床病理特征的关系。表 2 显示 lncRNA CCHE1 的表达水平与 PDAC 的分化程度和 TNM 分期密切相关(< 0.05)。lncRNA CCHE1 表达与其他临床病理特征(性别、年龄、肿瘤大小)不相关(> 0.05)。
2.3 lncRNA CCHE1 的表达水平与 PDAC 预后相关性
本研究共随访 90 例患者,术后 5 年内死亡病例 69 例(死亡率 76.66%),中位 DFS 25.73 个月,OS 30.96 个月。lncRNA CCHE1 高表达组患者 46 例,DFS 16.87 个月,OS 23.24 个月;lncRNA CCHE1 低表达组患者 44 例,DFS 35.00 个月,OS 39.02 个月;两组之间具有明显统计学差异(< 0.01,表1)。
Kaplan-Meier 生存曲线显示 lncRNA CCHE1 表达水平越高,患者的 DFS 越短(Chi-Square = 10.38,= 0.01,图 2A)、OS 越短(Chi-Square = 9.79,= 0.02,图 2B),差异具有统计学意义。
Cox 多因素分析发现,lncRNA CCHE1 表达与 PDAC 患者 DFS、OS 密切相关,HR 分别为 1.68(1.46 ~ 1.97),1.67(1.47 ~ 1.98),差异具有统计学意义(< 0.05,表 3),提示 lncRNA CCHE1 的高表达有可能作为 PDAC 的预后判断指标。
3 讨论
PDAC 是一种具有高侵袭性的恶性肿瘤,由于诊断延迟、易早期转移和对大多数细胞毒性药物耐药导致预后极差[8]。因此,建立新的诊断、预后和治疗相关生物标志物至关重要。随着高通量测序技术准确性的不断提高,曾经作为转录“暗物质”的 lncRNAs 在生物领域的重要性越来越受到科研工作者的重视。大量致力于 lncRNAs 如何参与调控肿瘤的发生发展的研究已成为热点。lncRNAs 可在多个水平参与基因表达的调控:作为信号,lncRNAs 可与蛋白质发生特异性结合,诱导该生物复合物与下游基因的启动子结合,调控转录,影响基因表达; lncRNAs 可作为引导员,引导蛋白移动到靶向基因启动子位点;作为诱饵,依据碱基互补配对原则,调控 RNA 之间的相互结合;或作为骨架来招募蛋白复合物[9]。因此,识别 PDAC 相关的 lncRNAs 能够为进一步明晰 PDAC 发生发展以及判断预后提供更有价值的理论基础。

AB
Figure 2 Kaplan-Meier survival analysis for DFS (A) and OS (B) of lncRNA CCHE1expression in PDAC patients

表 3 胰腺导管腺癌患者预后因素多元分析
lncRNA CCHE1 参与恶性肿瘤的发生发展,首先由 Yang 等[10]在卵巢癌中发现。Chen 等[11]的研究提示lncRNA CCHE1 与卵巢癌不良预后相关。其后有研究提示,lncRNA CCHE1 可通过ERK/MAPK 信号通路参与肝癌和非小细胞肺癌的发生发展[12];并且在肠癌中和 ERK/COX-2 通路的激活正相关[13];lncRNA CCHE1 在口腔鳞状细胞癌中通过竞争性内源 RNA 机制与 miR-922 结合,调控 PAK2 的表达从而加速其发生发展[14];另外,Jin 等[15]的研究提示,lncRNA CCHE1 能调控 ROCK1 的表达,从而促进 PDAC 的侵袭转移。但 lncRNA CCHE1 在 PDAC 中的临床意义未见报道。
本研究通过 PDAC 的细胞和组织样本进行分析,发现同胰腺导管上皮细胞和正常癌旁组织相比,lncRNA CCHE1 在癌细胞和组织中均呈过表达。回顾临床病理资料,lncRNA CCHE1 的表达同肿瘤分化程度和 TNM 分期密切相关。单因素和多因素生存分析显示,lncRNA CCHE1 是 PDAC 不良预后的独立危险因素,同患者的 DFS 以及 OS 均密切相关,虽然其统计学意义尚不能撼动 TNM 分期的临床预测效能,但在未来的研究中如果能够发现更多的同 PDCA 预后相关的转录组学分子,综合分析并建立多分子的联合预测模型,可能为 PDCA 的预后评效提供有意义的参考。本研究的结果证实 lncRNA CCHE1 可作为判断 PDAC 患者生存及预后的分子标志物,进一步阐释 lncRNA CCHE1 的功能和临床意义,有助于 PDAC 患者的治疗。但由于本研究纳入的为单中心数据,研究结论有待大宗数据进行进一步补充和完善。另一方面,关于 lncRNA CCHE1 表达变化同 PDAC 恶性表型的关系及其具体调控机制仍需我们通过分子生物学实验对结论进行进一步阐述。
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019. CA Cancer J Clin, 2019, 69(1):7-34.
[2] Maitra A, Fukushima N, Takaori K, et al. Precursors to invasive pancreatic cancer. Adv Anat Pathol, 2005, 12(2):81-91.
[3] Okusaka T, Furuse J. Recent advances in chemotherapy for pancreatic cancer: evidence from Japan and recommendations in guidelines.J Gastroenterol, 2020, 55(4):369-382.
[4] Pu N, Yin L, Habib JR, et al. Optimized modification of the eighth edition of AJCC TNM staging system for resected pancreatic ductal adenocarcinoma. Future Oncol, 2019, 15(30):3457-3465.
[5] Muers M. RNA: genome-wide views of long non-coding RNAs. Nat Rev Genet, 2011, 12(11):742.
[6] Chen L, Zhang J, Chen Q, et al. Long noncoding RNA SOX2OT promotes the proliferation of pancreatic cancer by binding to FUS. Int J Cancer, 2020, 147(1):175-188.
[7] Li H, Wang X, Wen C, et al. Long noncoding RNA NORAD, a novel competing endogenous RNA, enhances the hypoxia-induced epithelial-mesenchymal transition to promote metastasis in pancreatic cancer. Mol Cancer, 2017, 16(1):169.
[8] Egawa S, Toma H, Ohigashi H, et al. Japan Pancreatic Cancer Registry; 30th year anniversary: Japan Pancreas Society. Pancreas, 2012, 41(7):985-992.
[9] Mattick JS, Rinn JL. Discovery and annotation of long noncoding RNAs. Nat Struct Mol Biol, 2015, 22(1):5-7.
[10] Yang M, Zhai X, Xia B, et al. Long noncoding RNA CCHE1 promotes cervical cancer cell proliferation via upregulating PCNA. Tumour Biol, 2015, 36(10):7615-7622.
[11] Chen Y, Wang CX, Sun XX, et al. Long non-coding RNA CCHE1 overexpression predicts a poor prognosis for cervical cancer. Eur Rev Med Pharmacol Sci, 2017, 21(3):479-483.
[12] Liao Y, Cheng S, Xiang J, et al. lncRNA CCHE1 increased proliferation, metastasis and invasion of non-small lung cancer cells and predicted poor survival in non-small lung cancer patients. Eur Rev Med Pharmacol Sci, 2018, 22(6):1686-1692.
[13] Gaballah HH, Gaber RA, Elrashidy MA, et al. Expression of long non-coding RNA CCHE1 in colorectal carcinoma: correlations with clinicopathological features and ERK/COX-2 pathway. Mol Biol Rep, 2019, 46(1):657-667.
[14] Wang Y, Tong J, Lin H, et al. CCHE1 accelerated the initiation of oral squamous cell carcinoma through enhancing PAK2 expression by sponging miR-922. J Oral Pathol Med, 2020, 49(7):636-644.
[15] Jin X, Ye L, Lin M, et al. lncRNA-CCHE1 is involved in migration and invasion but not in proliferation of pancreatic adenocarcinoma cells possibly by interacting with ROCK1. Oncol Lett, 2019, 18(2):1218-1224.
Clinical significance of long non-coding RNA CCHE1 in pancreatic ductal adenocarcinoma
SHAO Qing-liang, ZANG Hui, GUO En-ling, ZHANG Zhi-qiang
Department of General Surgery, The People's Hospital of Liaoning Province, Shenyang 110016, China
To investigate the expression level of long non-coding RNA cervical carcinoma high-expressed 1 (lncRNA CCHE1) in pancreatic ductal adenocarcinoma (PDAC) cell and tissue and evaluate its prognostic value in PDAC.PDAC tissue as well as adjacent normal tissue and PDAC cells and pancreatic ductal epithelial cells from patients diagnosed with PDAC and PDAC cells were harvested in this study. Expression of lncRNA CCHE1 was measured by real-time PCR. ANOVA analysis was performed to evaluate the association between lncRNA CCHE1 and clinical manifestation of PDAC patients. K-M survival analysis was utilized to determine correlation of PDAC expression with 5-year survival. Cox's proportional hazards regression models were applied to analyze the relationships between lncRNA CCHE1 and prognosis of PDAC patients.lncRNA CCHE1 was up-regulated in PDAC cells and tissues. Expression of lncRNA CCHE1 was closely associated with tumor differentiation and TNM stage of PDAC (< 0.05). Expression of lncRNA CCHE1 was negatively correlated with disease free survival and overall survival.Expression of lncRNA CCHE1 is negatively associated with survival outcome of PDAC. lncRNA CCHE1 is an independent prognostic risk factor of PDAC.
lncRNA CCHE1; pancreatic ductal adenocarcinoma; prognosis; survival
SHAO Qing-liang, Email: sky7711@sina.com
辽宁省自然科学基金(20170540566)
邵庆亮,Email:sky7711@sina.com
2020-08-28
10.3969/j.issn.1673-713X.2021.01.003
