吉林省2018⁃2020年甲型H3N2亚型流感病毒耐药基因分析
2021-02-22李静柳鸿敏侯程程吴东林杨显达
李静 柳鸿敏 侯程程 吴东林 杨显达
流感病毒是引起人类呼吸道感染的常见病原,是人类面临的主要公共健康问题之一[1],每年都会造成3 000~5 000 万人感染呼吸道疾病,导致25~50 万人死亡,给全球带来严重的经济损失[2]。甲型H3N2亚型流感首次大爆发发生于1968年并引起20世纪的第三次流感大流行,造成约300万人死亡,又被称为“香港流感”。从此后甲型H3N2 亚型流感一直在人群中呈季节性流行并逐年发生变异,较H1N1pdm 亚型和乙型流感病毒,H3N2 亚型抗原进化快,感染症状重,更易引起流行[3⁃4]。目前流感的防治措施主要是疫苗接种和抗流感病毒药物,流感疫苗接种用于预防流感,抗流感病毒药物用于预防性用药和临床治疗。抗流感病毒药物主要包括M2 离子通道阻断剂,即金刚烷胺类药物[5],如金刚烷胺、金刚乙胺,以及靶向神经氨酸酶抑制剂类药物(neuraminidase inhibitor,NAI),如奥司他韦、扎那米韦等[6]。由于抗病毒药物的广泛使用以及流感病毒的不断变异,流感病毒耐药株呈增长趋势,为更好的指导临床用药和治疗,对流感毒株的耐药性监测具有十分重要的意义。为了解吉林省甲型H3N2 亚型流感病毒的耐药基因特征及耐药情况,本研究对流感毒株进行M2 和NA 基因扩增并进行了基因序列比对,分析吉林省甲型H3N2 亚型流感病毒毒株的耐药位点变化。
1 材料与方法
1.1 标本来源
采集2018年4月至2020年3月吉林省内13家国家级流感监测哨点医院具有流感样症状(体温≥38℃,伴咳嗽或者咽痛之一)的流感样病例标本,发热3 天内患者的咽拭子或鼻咽拭子。
1.2 方法
1.2.1 核酸检测
使用用QIAamp Viral RNA kit(Qiagen)试剂盒(货号:52904)提取核酸,具体操作参照说明书。使用Thermo fisher 公司AgPath⁃IDTMOne⁃Step RT⁃PCR Reagent Kit 进行流感病毒亚型Real⁃time PCR 检测,相关引物及探针序列参考《全国流感监测技术指南(2017年版)》[7],检测所使用的引物及探针序列由英潍捷基(上海)贸易有限公司合成。
1.2.2 流感病毒分离与鉴定
核酸检测阳性标本接种于狗肾细胞(MDCK)对进行流感病毒分离。7 天内发生细胞病变的细胞使用红细胞凝集方法进行试验,对于HA≥1∶8 的毒株进行红细胞凝集抑制试验对流感病毒亚型进行鉴定,鉴定试剂由国家流感中心提供。所有毒株均经过国家流感中心复核鉴定后用于本研究分析。
1.3 病毒选择
随机挑选2018⁃2020年流感监测年度34 株甲型H3N2 亚型流感毒株。
1.4 序列扩增
流感毒株进行核酸提取后,使用上海伯杰公司季节性流感病毒H3N2 亚型全基因扩增试剂盒对M 和NA 基因进行扩增。按照试剂说明书配制PCR 反应体系,反应条件为:50℃30 min;94℃3 min;35 个循环(94℃30 s,60℃30 s,72℃1.5 min);72℃7 min。取扩增产物5 μL,1%琼脂糖凝胶电泳。电压80 V,电泳时间为40 min,凝胶成像仪观察电泳结果,将阳性条带送公司测序。
1.5 序列分析
采用Bioedit 和Mega7.0 分析软件对M2 基因和NA 基因进行比对、分析核酸序列和氨基酸序列。以WHO 北半球H3N2 流感疫苗推荐株A/Sin⁃gapore/INFIMH⁃16⁃0019/2016(2018⁃2019),A/Kan⁃sas/14/2017(2019⁃2020)作为参比序列(来源于GI⁃SAID 数据库)。
1.6 统计学方法
利用Excel 工作表对数据进行整理、汇总、分类以及比例计算。采用Bioedit 和Mega7.0 分析软件对M2 基因和NA 基因进行比对、分析核酸序列和氨基酸序列。
2 结果
2.1 甲型H3N2 流感流行情况
2018⁃2020年度,吉林省共采集流感样病例标本17 930 份,分离到流感毒株981 株,其中甲型流感病毒毒株934 株,乙型流感毒株47 株。在分离到的甲型流感病毒毒株中,57.49%为H1N1pdm 亚型毒株,39.61%为H3N2 亚型毒株。见表1。
2.2 M2 基因耐药位点分析
吉林省2018⁃2020年度34 株H3N2 亚型流感病毒在M2 耐药相关基因位点L26F、V27A、A30T、G34E 均未发生突变,但全部在S31N 基因位点上发生了突变,即对金刚烷胺类抗病毒药物产生耐药。见图1。
2.3 NA 基因耐药位点分析
吉林省2018⁃2020年度34 株H3N2 亚型流感病毒在NA 耐药相关基因位点E119V、Q136K、D151A、I222V、H274Y、R292K、N294S 及R371K 均未发生突变,即对NAI 敏感。见图2。

图1 M2 基因耐药位点比对结果Figrue 1 Comparison results of drug resistance sites of the M2 gene
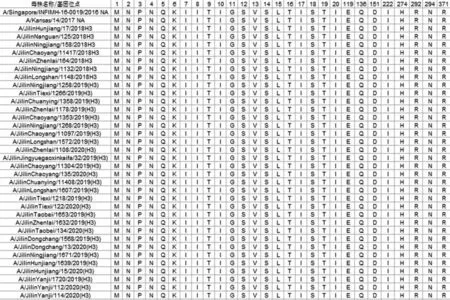
图2 2018⁃2020年吉林省H3N2 亚型流感毒株NA 基因氨基酸耐药位点突变情况Figure 2 Amino acid mutation relate with neuraminidase resistance of H3N2 influenza strains in Jilin Province during 2018⁃2020
3 讨论
流行性感冒一直以来严重威胁人类健康,流感病毒是正粘病毒科,分为甲(A)、乙(B)、丙(C)、丁(D)4 型[8],其中甲、乙两个型别是季节性流感的主要病原。甲型流感病毒抗原性易发生变异,多次引起世界性大流行。流感疫苗是预防流感病毒感染的最主要手段[9],由于H3N2 亚型很难在鸡胚中生长良好,且在抗原决定簇区域发生数个鸡胚适应性突变,与流行株的抗原特性有差异[10],另外病毒快速和显著的变异,也阻止机体产生持久的保护性免疫[11]。抗病毒药物主要用于流感治疗以及暴露后的预防用药。M2 离子通道阻断剂已经在临床应用大约六十年了,自从2019年H1N1 流感大流行时已经出现耐药情况[12]。自2000年代中期以来,H3N2 亚型也已经开始出现耐药性。为掌握吉林省内H3N2 亚型流感流行株对金刚烷胺类药物以及神经氨酸酶抑制剂类药物的耐药情况,开展本次研究。据相关文献报道,与M2 基因耐药有关的分子标记有L26F、V27A、A30T、S31N 和G34E,其中任何一个发生变异,金刚烷胺类药物则无法与M2 蛋白离子通道结合,从而产生耐药现象。本次研究结果与国内相关报道结果一致[5,13]。NA 基因耐药有关的分子标记有E119V/I、Q136K、D151A、I222V、H274Y、R292K、N294S 和R371K,只要其中任意位点发生突变,病毒即对NAI 产生耐药现象[14⁃15]。其中NA 基因第274 位和294 位突变导致对奥司他韦和帕拉米韦耐药,第119 位突变导致对奥司他韦和扎扎那米韦耐药[12]。但仍然要保持高度重视,由于神经氨酸酶抑制剂在临床中的广泛应用及H3N2 流感病毒的不断变异,已在临床中出现神经氨酸酶抑制剂敏感染度降低的病例[16⁃17],以及由于NA 基因上H275Y 的变异导致出现澳大利亚、日本等国家A(H1N1)pdm09 耐药毒株的聚集性病例和散发病例[18]。在临床治疗中,应选择多种治疗方式联合使用,减少药物压力产生的耐药株,同时坚持长期、持续的流感毒株耐药性监测,以便及时发现本省内药物敏感度降低的毒株,为流感的防控以及指导抗流感药物的选择和使用提供实验依据。
